ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH103 et n°SPEPHCH112
Télécharger l’exercice en PDF :
Le peroxyde d’hydrogène (eau oxygénée), de formule brute H2O2, fut découvert par le chimiste français Louis Jacques Thenard au début du 19ème siècle. Il est utilisé dans de nombreux produits cosmétiques, dans la composition de bain de bouche pour blanchir les dents, ainsi que dans des produits pour éclaircir les cheveux ou pour blanchir les ongles.
En 2018, trois marques de produit pour blanchir les dents ont été retirées des magasins en Europe à cause d’une concentration trop élevée en peroxyde d’hydrogène. Une exposition à une trop grande concentration en peroxyde d’hydrogène peut provoquer d’une part une irritation de la bouche et d’autre part une sensibilité accrue des dents aux variations de température.
Des normes ont donc été établies pour limiter la concentration de peroxyde d’hydrogène dans les produits bucco dentaires vendus dans le commerce. Ces normes dépendent du pays de vente.
Nous allons étudier la composition d’un bain de bouche vendu sur internet qui contient du peroxyde d’hydrogène et ainsi déterminer si ce produit a toute légitimité ou non à être vendu dans le commerce.
Indications sur l’étiquette du bain de bouche étudié :
L’action moussante du peroxyde d’hydrogène vous procurera une bouche très propre.
Ce produit nettoie et rend les dents étincelantes.
Sans parabène, sulfate, phtalate, parfum et conservateur.
Ingrédients : Eau purifiée, peroxyde d’hydrogène, arome naturel végétal, fluorure de sodium.
Données :
- Formule développée de la molécule de peroxyde d’hydrogène : H – O – O – H
- Électronégativité : hydrogène χ(H)= 2,2 ; oxygène χ(O) = 3,2.
- Numéros atomiques : élément hydrogène H : Z = 1 ; élément oxygène O : Z = 8.
- Configuration électronique à l’état fondamental de l’atome d’hydrogène H : 1s1 et de l’atome d’oxygène O : 1s2 2s2 2p4.
Structure et solubilité du peroxyde d’hydrogène
Sur l’étiquette du bain de bouche, nous pouvons remarquer que le peroxyde d’hydrogène se trouve en solution aqueuse.
1. Déterminer les électrons de valence de l’atome d’hydrogène et de l’atome d’oxygène à partir de leur configuration électronique à l’état fondamental.
• Z(O) = 8 Configuration électronique de l’oxygène : 1s2 2s2 2p4.
Électrons de valence de l’oxygène : 2+4=6
- Z(H) = 1 : Configuration électronique de l’hydrogène : 1s1.
Électrons de valence de l’hydrogène : 1=1
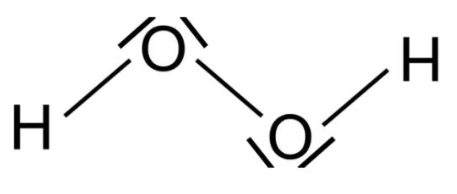
2. Établir les schémas de Lewis de la molécule d’eau et de la molécule de peroxyde d’hydrogène.
- Z(H) = 1 : Configuration électronique de l’hydrogène : 1s1.
Électrons de valence de l’hydrogène : 1=1
Structure électronique du gaz noble le plus proche : 1s2
Électrons engagés dans une liaison covalente : 2−1=1
Doublets liants : 1
Électrons non engagés dans une liaison covalente : 1−1=0
Doublets non liants : 0/2=0
L’hydrogène à 1 liaison covalentes et 0 doublets non liants.
Z(O) = 8 Configuration électronique de l’oxygène : 1s2 2s2 2p4.
Électrons de valence de l’oxygène : 2+4=6
Structure électronique du gaz noble le plus proche : 1s2 2s2 2p6
Électrons engagés dans une liaison covalente : 8−6=2
Doublets liants : 2
Électrons non engagés dans une liaison covalente : 6−2=4
Doublets non liants : 4/2=2
L’oxygène à 2 liaisons covalentes et 2 doublets non liants.
Schéma de Lewis de la molécule d’eau H2O :
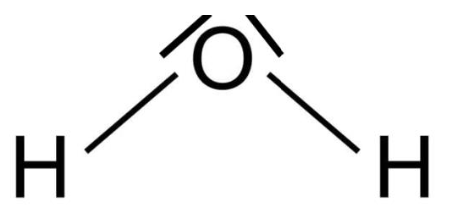
Schéma de Lewis de la molécule de peroxyde d’hydrogène H2O2 :
3. Déterminer le caractère polaire de la liaison O-H.
Calculons la différence d’électronégativité entre l’atome d’oxygène et l’atome d’hydrogène :
∆χ=χ(O)-χ(H)
∆χ=3,2-2,2
∆χ=1,0
∆χ>0,4 : la liaison O—H est polaire.
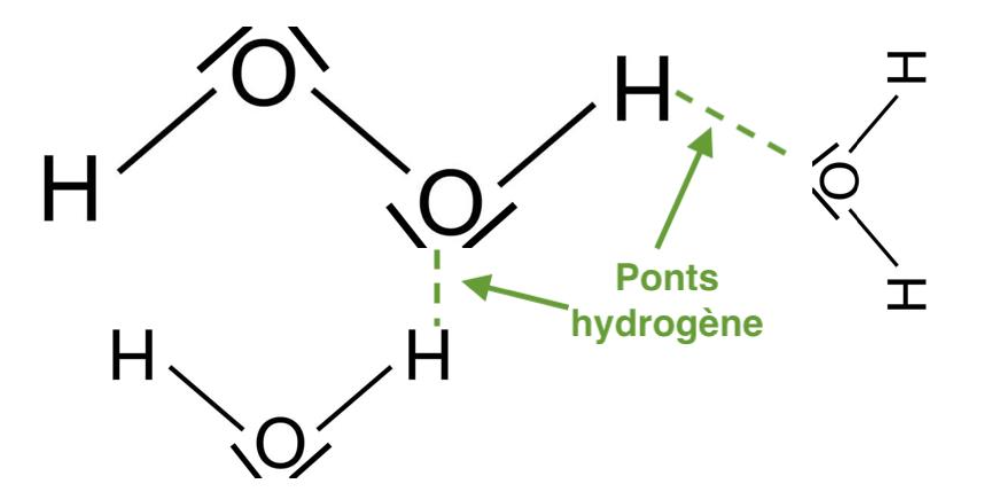
4. Représenter sur un schéma les interactions entre une molécule d’eau et une molécule de peroxyde d’hydrogène. Nommer ces interactions et justifier la miscibilité du peroxyde d’hydrogène dans l’eau.
L’eau est une molécule polaire et la molécule de peroxyde d’hydrogène possède des atomes d’oxygène qui sont très électronégatifs.
Elles établissent entre elles des liaisons (ou ponts) hydrogène.
Ces liaisons hydrogènes peuvent s’établir entre un atome d’hydrogène lié à un atome A et un atome B. Les atomes A et B pouvant être l’oxygène, le fluor ou l’azote (atomes de grande électronégativité).
Détermination de la concentration en peroxyde d’hydrogène
On souhaite déterminer la concentration en peroxyde d’hydrogène de la solution commerciale de bain de bouche vendue sur internet. La solution est incolore. Pour cela nous allons effectuer un titrage avec suivi colorimétrique.
Pour déterminer à la concentration en quantité de matière C1 en peroxyde d’hydrogène de la solution commerciale de bain de bouche on va étudier la transformation chimique modélisée par la réaction d’oxydoréduction qui prend place entre le peroxyde d’hydrogène H2O2 (aq) et les ions permanganate MnO4– (aq).
Il s’agit d’une réaction d’oxydoréduction mettant en jeu les couples O2(g) / H2O2(aq) et MnO4–(aq)/Mn2+(aq) dont l’équation est la suivante :
2MnO4–(aq) + 5 H2O2(aq) + 6 H+(aq) → 2Mn2+(aq) + 8 H2O(l) + 5 O2(g)
Une solution aqueuse contenant des ions permanganate MnO4–(aq) est de couleur rose. En revanche, la présence des espèces Mn2+(aq) ou H2O2 (aq) dans l’eau laissent la solution aqueuse incolore.
5. Écrire les demi-équations électroniques associées aux couples O2(g) / H2O2(aq) et MnO4–(aq)/Mn2+(aq).
Demi-équations électroniques associées aux couples O2(g) / H2O2(aq) et MnO4– (aq) / Mn2+(aq) :
\[ \mathrm{ \text{O}_2 \, (g) / \text{H}_2\text{O}_2 \, (aq) \, \text{:} \quad \text{O}_2 \, (g) + 2\text{H}^+ \, (aq) + 2e^- = \text{H}_2\text{O}_2 \, (aq)}\]
\[ \mathrm{ \text{MnO}_4^- \, (aq) / \text{Mn}^{2+} \, (aq) \, \text{:} \quad \text{MnO}_4^- \, (aq) + 8\text{H}^+ \, (aq) + 5e^- = \text{Mn}^{2+} \, (aq) + 4\text{H}_2\text{O} \, (l)}\]
6. Retrouver l’équation de la réaction entre H2O2(aq) et MnO4–(aq), réaction support du titrage.
\[ \mathrm{ 5 \times \left(\text{H}_2\text{O}_2 \, (aq) \rightarrow \text{O}_2 \, (g) + 2\text{H}^+ \, (aq) + 2e^- \right) }\]
\[ \mathrm{ 2 \times \left(\text{MnO}_4^- \, (aq) + 8\text{H}^+ \, (aq) + 5e^- \rightarrow \text{Mn}^{2+} \, (aq) + 4\text{H}_2\text{O} \, (l) \right) }\]
$2\text{MnO}_4^- \, (aq) + 16\text{H}^+ \, (aq) + 5\text{H}_2\text{O}_2 \, (aq) \rightarrow 2\text{Mn}^{2+} \, (aq) + 8\text{H}_2\text{O} \, (l) + 5\text{O}_2 \, (g) + 10\text{H}^+ \, (aq)$
On simplifie de part et d’autre les ions H+ :
$2\text{MnO}_4^- \, (aq) + 6\text{H}^+ \, (aq) + 5\text{H}_2\text{O}_2 \, (aq) \rightarrow 2\text{Mn}^{2+} \, (aq) + 8\text{H}_2\text{O} \, (l) + 5\text{O}_2 \, (g)$
Dans la même forme que le sujet :
$2\text{MnO}_4^- \, (aq) + 5\text{H}_2\text{O}_2 \, (aq) + 6\text{H}^+ \, (aq) \rightarrow 2\text{Mn}^{2+} \, (aq) + 8\text{H}_2\text{O} \, (l) + 5\text{O}_2 \, (g)$
Dans un erlenmeyer, on verse un volume V1= 5,0 mL de la solution de bain de bouche de concentration C1 en quantité de matière de peroxyde d’hydrogène. On y ajoute 50 mL d’eau distillée et 10 mL d’une solution d’acide sulfurique de concentration 1,0 mol·L-1. On verse ensuite, progressivement, une solution de permanganate de potassium de concentration en quantité de matière C2= 5,0.10-2 mol·L-1. L’équivalence est atteinte pour un volume versé de la solution de permanganate de potassium V2,eq = 14,7 mL.
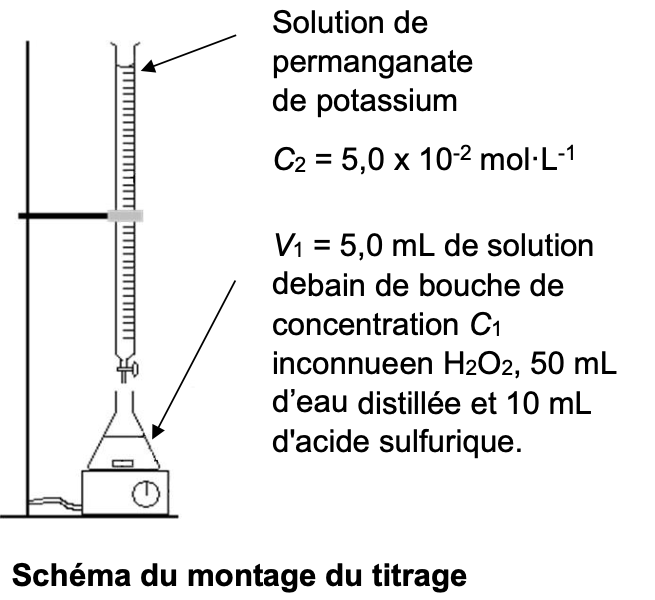
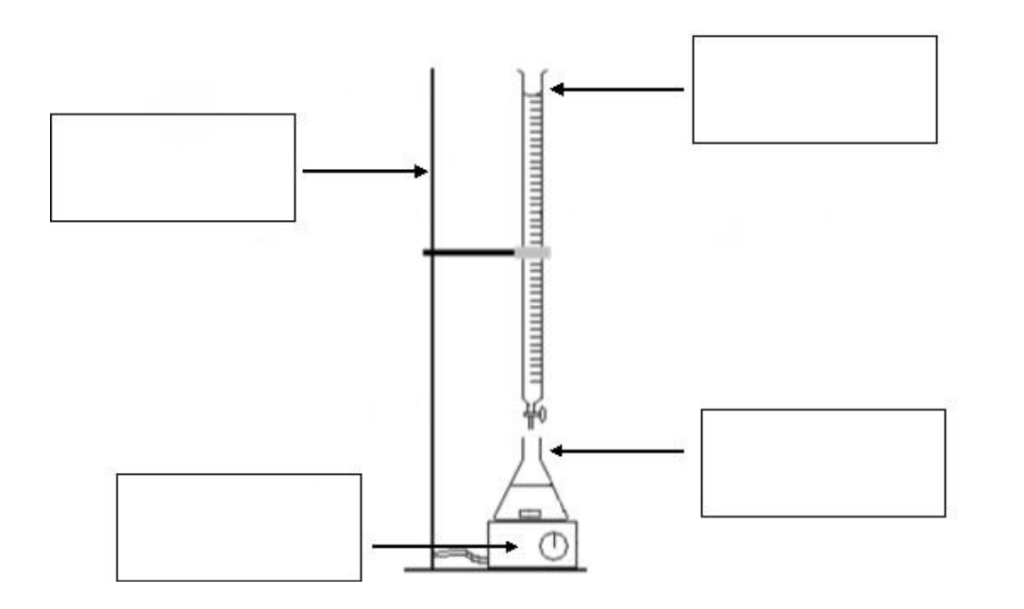
7. Légender le montage du titrage sur le document réponse en annexe en indiquant le nom du matériel de laboratoire.
8. Indiquer le nom du réactif limitant avant l’équivalence et celui du réactif limitant après l’équivalence.
Avant l’équivalence, le réactif limitant est le permanganate de potassium.
Après l’équivalence, le réactif limitant est le peroxyde d’hydrogène.
9. Indiquer et justifier le changement de couleur de la solution lors de l’équivalence.
Le peroxyde d’hydrogène (l’eau oxygénée) est incolore et le permanganate de potassium est rose.
Avant l’équivalence, le permanganate de potassium est le réactif limitant et l’eau oxygénée le réactif en excès. Le mélange est de la couleur du réactif en excès : il est incolore.
Après l’équivalence, le permanganate de potassium est le réactif en excès et l’eau oxygénée le réactif limitant. Le mélange est de la couleur du réactif en excès : il est rose.
Ainsi, à l’équivalence on observe un changement de couleur de l’incolore au rose.
10. Démontrer que la relation à l’équivalence entre les volumes et les concentrations des solutions est : 2 C1 x V1 = 5 C2 x V2,eq .
2MnO4–(aq) + 5 H2O2(aq) + 6 H+(aq) → 2Mn2+(aq) + 8 H2O(l) + 5 O2(g)
À l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques :
\[ \mathrm{\frac{n(\text{H}_2\text{O}_2)}{5} = \frac{n(\text{MnO}_4^-)_\text{eq}}{2}}\]
Ainsi :
\[ \mathrm{\frac{c_1 \times V_1}{5} = \frac{c_2 \times V_\text{eq}}{2}}\]
D’où :
\[ \mathrm{2c_1 \times V_1 = 5c_2 \times V_\text{eq}}\]
11. Calculer la valeur de la concentration C1 en peroxyde d’hydrogène de la solution commerciale de bain de bouche.
\[ \mathrm{ 2c_1 \times V_1 = 5c_2 \times V_{2,eq}}\]
\[ \mathrm{ c_1 = \frac{5 \times c_2 \times V_{2,eq}}{2 \times V_1}}\]
\[ \mathrm{ c_1 = \frac{5 \times 5,0 \times 10^{-2} \times 14,7}{2 \times 5,0}}\]
\[ \mathrm{ c_1 = 3,7 \times 10^{-1} \, \text{mol.L}^{-1}}\]
Titre en volume de la solution commerciale
Le peroxyde d’hydrogène peut se dismuter (se décomposer) ; cette transformation peut être modélisée par l’équation de la réaction suivante :
2 H2O2(aq) → 2 H2O (l) + O2 (g)
C’est pourquoi les concentrations commerciales de peroxyde d’hydrogène sont généralement reliées à une grandeur appelée titre en volume.
En effet, par convention, le titre en volume correspond au volume en litre de dioxygène gazeux que peut dégager un litre de solution aqueuse de peroxyde d’hydrogène lors de sa dismutation. On rappelle que dans les conditions normales de température et de pression le volume molaire du dioxygène O2(g) est de Vm = 22,4 L·mol-1.
Des normes ont été établies pour limiter la concentration de peroxyde d’hydrogène dans les produits vendus dans le commerce. Ces normes dépendent du pays de vente.
Titre maximal autorisé dans les produits cosmétiques (exprimé en volume) :
| Type de produit | Titre maximal dans les préparations vendues dans le commerce en Europe | Titre maximal dans les préparations vendues dans le commerce aux États-Unis |
| Produits pour les cheveux | 40 volumes | 42 volumes |
| Produits pour la peau | 13,3 volumes | 10 volumes |
| Produits pour durcir les ongles | 6,6 volumes | Non renseigné |
| Produits bucco- dentaires | 0,3 volume | 15,4 volumes |
12. Montrer qu’un litre de solution commerciale de bain de bouche de concentration en peroxyde d’hydrogène C1= 3,7 x 10-1 mol·L-1 produit, lors de sa dismutation, une quantité de dioxygène O2 environ égale à 1,9×10-1 mol.
Calculons la quantité de peroxyde d’hydrogène dans la solution :
\[ \mathrm{ n_1 = C_1 \times V_1}\]
\[ \mathrm{ n_1 = 3,7 \times 10^{-1} \times 1,0}\]
\[ \mathrm{ n_1 = 3,7 \times 10^{-1} \, \text{mol}}\]
| Équation | 2 H2O2(aq) → 2 H2O (l) + O2 (g) | |||
| État | Avancement | |||
| État initial | 0 | 3,7×10-1 | Excès | 0 |
| État intermédiaire | x | 3,7×10-1-x | Excès | x |
| État final | xf | 3,7×10-1-xf | Excès | xf=nO2 |
Calculons l’avancement maximale :
\[ \mathrm{3,7 \times 10^{-1} – 2x_{\text{max}} = 0}\]
\[ \mathrm{-2x_{\text{max}} = -3,7 \times 10^{-1}}\]
\[ \mathrm{2x_{\text{max}} = 3,7 \times 10^{-1}}\]
\[ \mathrm{x_{\text{max}} = \frac{3,7 \times 10^{-1}}{2}}\]
\[ \mathrm{x_{\text{max}} = 1,9 \times 10^{-1} \, \text{mol}}\]
Considérons la réaction totale :
\[ \mathrm{x_f = n_{\text{O}_2}}\]
\[ \mathrm{n_{\text{O}_2} = x_f}\]
\[ \mathrm{n_{\text{O}_2} = x_{\text{max}}}\]
\[ \mathrm{n_{\text{O}_2} = 1,9 \times 10^{-1} \, \text{mol}}\]
Ainsi, un litre de solution commerciale de bain de bouche de concentration en peroxyde d’hydrogène C1= 3,7 x 10-1 mol·L-1 produit, lors de sa dismutation, une quantité de dioxygène O2 environ égale à 1,9×10-1 mol.
13. Déterminer le titre en volume de la solution de bain de bouche. Conclure sur la possibilité de vendre ce bain de bouche en Europe et aux Etats-Unis.
Par convention, le titre en volume correspond au volume en litre de dioxygène gazeux que peut dégager un litre de solution aqueuse de peroxyde d’hydrogène lors de sa dismutation.
Calculons le titre :
\[ \mathrm \text{Titre} = {V_{\text{O}_2}}\]
\[ \mathrm{n_{\text{O}_2} = \frac{V_{\text{O}_2}}{V_m}}\]
\[ \mathrm{\frac{V_{\text{O}_2}}{V_m} = n_{\text{O}_2}}\]
\[ \mathrm{V_{\text{O}_2} = n_{\text{O}_2} \times V_m}\]
D’où :
\[ \mathrm{\text{Titre} = n_{\text{O}_2} \times V_m}\]
\[ \mathrm{\text{Titre} = 1,9 \times 10^{-1} \times 22,4}\]
\[ \mathrm{\text{Titre} = 4,3 \, \text{L}}\]
Le titre en volume de la solution de bain de bouche dépasse le titre maximal pour les préparations vendues dans le commerce en Europe mais ne dépasse pas le Titre maximal dans les préparations vendues dans le commerce aux États-Unis.
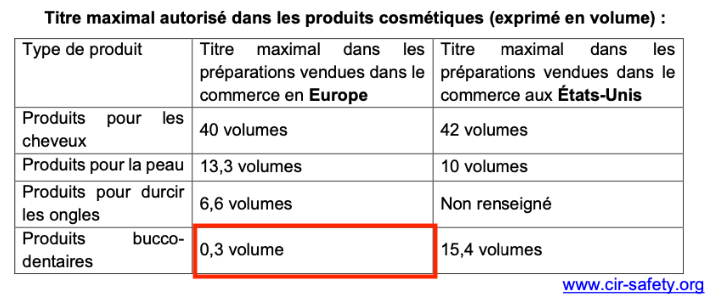
Ainsi, il est interdit de vendre ce bain de bouche en Europe et il est autorisé de vendre ce bain de bouche aux Etats-Unis.
ANNEXE À RENDRE AVEC LA COPIE
Document réponse : Question 7