ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH110
Télécharger l’exercice en PDF :
Lorsque l’on s’intéresse à l’impact sur l’environnement d’une voiture, on peut se poser deux types de questions :
- Quel carburant utilise cette voiture ? Ce carburant impacte-t-il les ressources fossiles ?
- Combien de gaz à effet de serre (CO2 par exemple) cette voiture émet-elle ? Aura-t-elle un malus écologique (taxe sur les véhicules fortement émetteurs de CO2) ?
Nous allons étudier deux carburants différents :
- Le E85 est un carburant qui correspond à un mélange de 85 % en volume d’éthanol d’origine agricole, bioéthanol, et de 15 % en volume d’essence SP95.Le bioéthanol est produit à partir des sucres présents dans la betterave ou dans les céréales. Ces sucres proviennent de la photosynthèse utilisant le dioxyde de carbone de l’air. L’utilisation du bioéthanol d’origine agricole permet donc de limiter l’impact de la consommation de carburant sur le bilan carbone de la planète sans puiser dans les ressources d’énergie fossiles.
- Le E0 est un carburant qui correspond à de l’essence SP95 contenant 0 % d’éthanol, donc du SP95 pur.
Données :
Masse volumique de l’éthanol à 25 °C : 0,789 kg·L-1
Masses molaires atomiques (en g·mol-1) : M(H) = 1,0 ; M(C) = 12,0 ; M(O) = 16,0.
La combustion des carburants
– La combustion de l’essence SP95
1. Écrire l’équation de la réaction modélisant la combustion complète de l’essence SP95, qu’on assimile à de l’octane C8H18(l), dans le dioxygène O2(g) de l’air.
Équation de la réaction modélisant la combustion complète de l’essence SP95, qu’on assimile à de l’octane C8H18(l), dans le dioxygène O2(g) de l’air :
\[ \text{C}_8\text{H}_{18} (\text{l}) + \frac{25}{2} \text{O}_2 (\text{g}) \rightarrow 8 \text{CO}_2 (\text{g}) + 9 \text{H}_2\text{O} (\text{g}) \]
– La combustion de l’éthanol
L’équation de la réaction modélisant la combustion complète de l’éthanol dans le dioxygène de l’air est :
C2H6O(l) + 3 O2(g) ⮕ 2 CO2 (g) + 3 H2O(g) (Équation A)
Comme toute réaction de combustion, elle peut être assimilée à une réaction d’oxydoréduction mettant en jeu deux couples oxydant / réducteur :
- le couple : CO2(g) / C2H6O(l) ;
- le couple : O2(g) / H2O(g), associé à la demi-équation électronique : O2(g) + 4 H+(aq) + 4 e– = 2 H2O(g).
2. Écrire la demi-équation électronique associée au couple : CO2(g) / C2H6O(l).
Demi-équation électronique associée au couple : CO2(g) / C2H6O(l).
\[ 2 \text{CO}_2 (\text{aq}) + 12 \text{H}^+ (\text{aq}) + 12 e^- = \text{C}_2 \text{H}_6 \text{O} (\text{l}) + 3 \text{H}_2 \text{O} (\text{l}) \]
3. Retrouver l’équation de la réaction modélisant la combustion de l’éthanol dans le dioxygène de l’air (Équation A), à l’aide des demi-équations électroniques.
Le couple : O2(g) / H2O(g), associé à la demi-équation électronique :
\[ \text{O}_2 (\text{g}) + 4 \text{H}^+ (\text{aq}) + 4 e^- = 2 \text{H}_2\text{O} (\text{g}) \]
Équation de la réaction modélisant la combustion de l’éthanol \(\text{C}_2\text{H}_6\text{O} (\text{l})\) dans le dioxygène de l’air \(\text{O}_2 (\text{g})\) :
\[ \text{C}_2\text{H}_6\text{O} (\text{l}) + 3 \text{H}_2\text{O} (\text{l}) = 2 \text{CO}_2 (\text{aq}) + 12 \text{H}^+ (\text{aq}) + 12 e^- \]
\[ 3 \text{O}_2 (\text{g}) + 4 \text{H}^+ (\text{aq}) + 4 e^- = 2 \text{H}_2\text{O} (\text{g}) \]
Additionnons les deux équations :
\[ \text{C}_2\text{H}_6\text{O} (\text{l}) + 3 \text{H}_2\text{O} (\text{l}) + 3 \text{O}_2 (\text{g}) + 12 \text{H}^+ (\text{aq}) \rightarrow 2 \text{CO}_2 (\text{aq}) + 12 \text{H}^+ (\text{aq}) + 6 \text{H}_2\text{O} (\text{g}) \]
On simplifie les \(\text{H}^+\) et \(\text{H}_2\text{O}\) de part et d’autre de l’équation :
\[ \text{C}_2\text{H}_6\text{O} (\text{l}) + 3 \text{O}_2 (\text{g}) \rightarrow 2 \text{CO}_2 (\text{aq}) + 3 \text{H}_2\text{O} (\text{g}) \]
On retrouve bien l’équation de la réaction modélisant la combustion de l’éthanol dans le dioxygène.
4. Définir ce qu’est un oxydant puis déterminer le caractère oxydant ou réducteur de l’éthanol.
Un oxydant est une espèce capable de capter un ou plusieurs électrons.
L’éthanol C2H6O cède des électrons : c’est le réducteur.
Dans la suite de l’exercice, nous allons étudier un véhicule dont les caractéristiques techniques sont les suivantes :
- consommation du carburant E0 (Essence SP95 pur sans éthanol) : 8,28 L pour 100 km ;
- consommation du carburant E85 : 11,6 L pour 100 km.
L’objectif de cet exercice est d’étudier si le choix du conducteur de consommer du carburant E85 lui permet de ne pas être soumis au malus écologique.
L’émission de CO2 par le véhicule étudié
L’éthanol est un carburant qui produit moins d’énergie que l’essence SP95. Son introduction dans la composition du carburant nécessite de consommer davantage pour obtenir une même quantité d’énergie : on parle de surconsommation occasionnée par l’utilisation d’éthanol.
Le graphique ci-dessous représente la surconsommation en fonction du pourcentage volumique d’éthanol introduit dans le carburant utilisé.
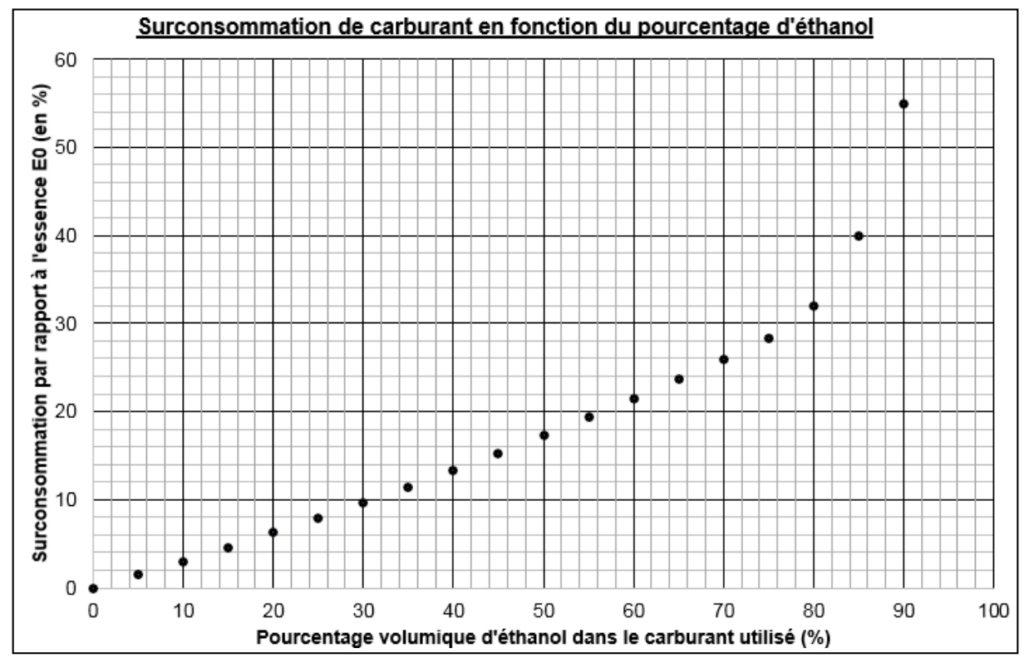
Le E0 correspond à du SP95 contenant 0 % d’éthanol, donc du SP95 pur. On voit que sa surconsommation est naturellement de 0 %.
D’après http://turbo-moteurs.cnam.fr/enseignement/conferences/
Consulté le 7/9/20
5. Justifier que les consommations données en carburants E0 (8,28 L pour 100 km) et E85 (11,6 L pour 100 km) sont cohérentes avec la surconsommation obtenue grâce au graphique.
Le E0 correspond à du SP95 contenant 0 % d’éthanol, donc du SP95 pur. On voit que sa surconsommation est naturellement de 0 %.
Le E85 correspond à du SP95 contenant 85 % d’éthanol. Graphiquement, sa surconsommation est de 40%.
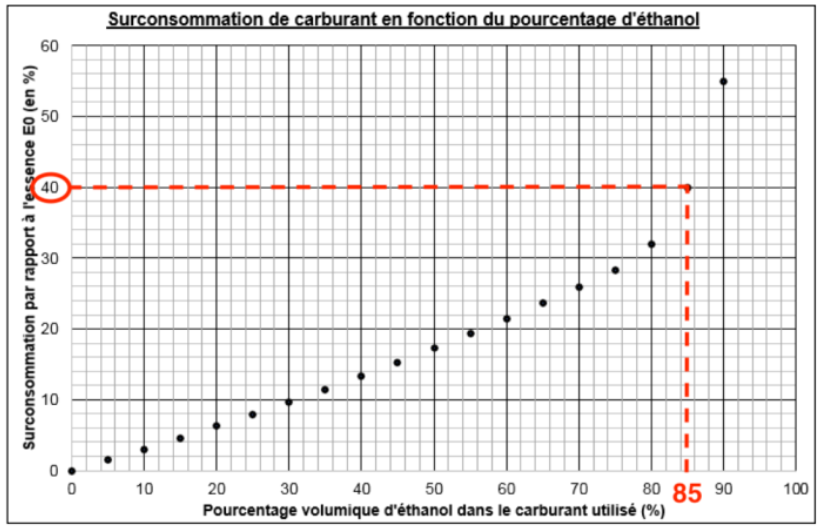
Une consommation en carburants E0 : 8,28 L pour 100 km, calculons la consommation avec une surconsommation de 40% :
\[ 8{,}28 + \frac{40}{100} \times 8{,}28 = 11{,}6 \, \text{L} \]
Ainsi, les consommations données en carburants E0 (8,28 L pour 100 km) et E85 (11,6 L pour 100 km) sont cohérentes avec la surconsommation obtenue grâce au graphique.
Émission de CO2 liée à l’essence SP95 contenue dans le carburant E85
6. Déterminer le volume d’essence SP95 contenu dans le volume nécessaire de carburant E85 pour que le véhicule étudié parcourt 100 km.
Pour que le véhicule étudié parcourt 100 km, il faut 11,6 L de E85.
\[ P_{\text{E85}} = \frac{V_{\text{éthanol}}}{V_{\text{E85}}} \]
\[ \frac{V_{\text{éthanol}}}{V_{\text{E85}}} = P_{\text{E85}} \]
\[ V_{\text{éthanol}} = P_{\text{E85}} \times V_{\text{E85}} \]
\[ V_{\text{éthanol}} = \frac{85}{100} \times 11{,}6 \]
\[ V_{\text{éthanol}} = 9{,}86 \, \text{L} \]
Or,
\[ V_{\text{E85}} = V_{\text{éthanol}} + V_{\text{Essence SP95}} \]
\[ V_{\text{éthanol}} + V_{\text{Essence SP95}} = V_{\text{E85}} \]
\[ V_{\text{Essence SP95}} = V_{\text{E85}} – V_{\text{éthanol}} \]
\[ V_{\text{Essence SP95}} = 11{,}6 – 9{,}86 \]
\[ V_{\text{Essence SP95}} = 1{,}74 \, \text{L} \]
Un volume de 1,74 L d’essence SP95 est contenu dans le volume nécessaire de carburant E85 pour que le véhicule étudié parcourt 100 km.
7. Déterminer la masse de dioxyde de carbone (CO2) émis par la combustion de l’essence SP95 contenu dans le carburant E85, pendant que le véhicule étudié parcourt 100 km, sachant que la combustion de 1 L d’essence SP95 émet 2,09 kg de CO2.
| 1 L d’essence SP95 | 2,09 kg de CO2 |
| 1,74 L d’essence SP95 | m de CO2 |
\[ m = \frac{1{,}74 \times 2{,}09}{1} \]
\[ m = 3{,}64 \, \text{kg} \]
La combustion de l’essence SP95 contenu dans le carburant E85, pendant que le véhicule étudié parcourt 100 km produit 3,64 kg de CO2.
Émission de CO2 liée à l’éthanol contenu dans le carburant E85
8. Calculer le volume d’éthanol consommé lorsque le véhicule étudié parcourt 100 km avec le carburant E85.
Pour que le véhicule étudié parcourt 100 km, il faut 11,6 L de E85.
\[ P_{\text{E85}} = \frac{V_{\text{éthanol}}}{V_{\text{E85}}} \]
\[ \frac{V_{\text{éthanol}}}{V_{\text{E85}}} = P_{\text{E85}} \]
\[ V_{\text{éthanol}} = P_{\text{E85}} \times V_{\text{E85}} \]
\[ V_{\text{éthanol}} = \frac{85}{100} \times 11{,}6 \]
\[ V_{\text{éthanol}} = 9{,}86 \, \text{L} \]
Lorsque le véhicule étudié parcourt 100 km avec le carburant E85, il consomme 9,86L d’éthanol.
9. Vérifier que la quantité de matière en éthanol nécessaire pour parcourir ces 100 km est net = 169 mol.
\[ n_{\text{éthanol}} = \frac{m_{\text{éthanol}}}{M_{\text{éthanol}}} \]
Or
\[ \rho_{\text{éthanol}} = \frac{m_{\text{éthanol}}}{V_{\text{éthanol}}} \]
\[ \frac{m_{\text{éthanol}}}{V_{\text{éthanol}}} = \rho_{\text{éthanol}} \]
\[ m_{\text{éthanol}} = \rho_{\text{éthanol}} \times V_{\text{éthanol}} \]
D’où
\[ n_{\text{éthanol}} = \frac{\rho_{\text{éthanol}} \times V_{\text{éthanol}}}{M_{\text{éthanol}}} \]
\[ n_{\text{éthanol}} = \frac{0{,}789 \times 10^3 \times 9{,}86}{2 \times 12{,}0 + 6 \times 1{,}0 + 16{,}0} \]
\[ n_{\text{éthanol}} = 169 \, \text{mol} \]
10. Déterminer la quantité de matière de CO2 émis par la combustion de l’éthanol lorsque le véhicule étudié parcourt 100 km. En déduire la masse de CO2 émis.
| Équation | $\text{C}_2\text{H}_6\text{O} (\text{l}) + 3 \text{O}_2 (\text{g}) \rightarrow 2 \text{CO}_2 (\text{aq}) + 3 \text{H}_2\text{O} (\text{g})$ | ||||
| État | Avancement | ||||
| État initial | x=0 | 169 | Excès | 0 | 0 |
| État intermédiaire | x | $ 169 – x $ | Excès | 2x | 3x |
| État final | xf | $ 169 – x_f $ | Excès | $ 2 x_f = n_{\text{CO}_2}^{\text{émis}} $ | $ 3 x_f $ |
La réaction est totale, le dioxygène de l’air est en excès. A la fin de la réaction il ne reste plus d’éthanol :
\[ 169 – x_f = 0 \]
\[ -x_f = -169 \]
\[ x_f = 169 \, \text{mol} \]
La quantité de CO2 émis :
\[ 2 x_f = n_{\text{CO}_2}^{\text{émis}} \]
\[ n_{\text{CO}_2}^{\text{émis}} = 2 \times 169 \]
\[ n_{\text{CO}_2}^{\text{émis}} = 338 \, \text{mol} \]
Masse de CO2 émise :
\[ n_{\text{CO}_2} = \frac{m_{\text{CO}_2}}{M_{\text{CO}_2}} \]
\[ \frac{m_{\text{CO}_2}}{M_{\text{CO}_2}} = n_{\text{CO}_2} \]
\[ m_{\text{CO}_2} = n_{\text{CO}_2} \times M_{\text{CO}_2} \]
\[ m_{\text{CO}_2} = 338 \times (12{,}0 + 2 \times 16{,}0) \]
\[ m_{\text{CO}_2} = 1{,}49 \times 10^4 \, \text{g} \]
\[ m_{\text{CO}_2} = 14{,}9 \times 10^3 \, \text{g} \]
\[ m_{\text{CO}_2} = 14{,}9 \, \text{kg} \]
11. Vérifier que la masse totale de CO2 émis par la combustion du carburant E85 pour 1 km est de 185 g.
Pour 100 km la masse totale de CO2 émis :
\[ m_{\text{CO}_2}^{\text{totale}} = m_{\text{CO}_2}^{\text{essence}} + m_{\text{CO}_2}^{\text{éthanol}} \]
\[ m_{\text{CO}_2}^{\text{totale}} = 3{,}64 + 14{,}9 \]
\[ m_{\text{CO}_2}^{\text{totale}} = 18{,}5 \, \text{kg} \]
| 100 km | 18,5 kg de CO2 |
| 1 km | m de CO2 |
\[ m = \frac{1 \times 18{,}5}{100} \]
\[ m = 0{,}185 \, \text{kg} \]
\[ m = 0{,}185 \times 10^3 \, \text{g} \]
\[ m = 185 \, \text{g} \]
Ainsi, la masse totale de CO2 émis par la combustion du carburant E85 pour 1 km est de 185 g.
Calcul du malus écologique
Le malus écologique est une taxe sur les véhicules fortement émetteurs de CO2 : son objectif est d’orienter la consommation vers l’achat de véhicules moins polluants.
La taxe sur un véhicule est calculée en fonction du nombre de grammes de dioxyde de carbone (CO2) émis par kilomètre (g/km).
| Taux d’émission de CO2 | Montant |
| Inférieur à 138 g/Km | 0 € |
| Supérieur à 138 g/km | 50 € |
| Supérieur à 148 g/km | 260 € |
| Supérieur à 158 g/km | 818 € |
| Supérieur à 168 g/km | 1 901 € |
| Supérieur à 178 g/km | 3 781 € |
| Supérieur à 188 g/km | 6 724 € |
D’après https://www.legifrance.gouv.fr/
(Consulté le 7/9/20)
Un véhicule équipé pour fonctionner au carburant E85 bénéficie d’un abattement de 40 % sur les taux d’émission de CO2. Cet abattement ne s’applique pas aux véhicules dont les émissions de CO2 dépassent 250 g/km.
Exemple :
Un véhicule neuf roulant au carburant E85 émet 180 g de CO2 par km. Un abattement de 40 % s’applique sur son taux de CO2, soit 180 x 40 % = 72 g/km. Le taux retenu pour calculer le malus vaut : 180 – 72 = 108 g/km. Ce véhicule n’est donc pas soumis au malus.
D’après service-public.fr/particuliers/vosdroits (Consulté le 7/9/20)
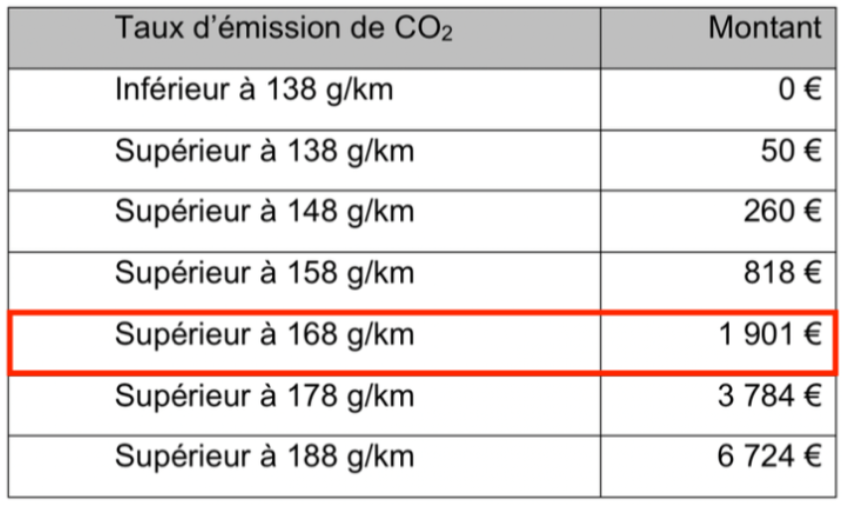
12. Déterminer le malus écologique à appliquer à un véhicule consommant de l’essence SP95 et émettant 173 g de CO2 émis par km.
Un véhicule consommant de l’essence SP95 et émettant 173 g de CO2 émis par km.
Cette masse est supérieure à 168 g/km et inférieure à 178 g/km.
D’après le tableau, la taxe sur un véhicule s’élève à 1901 €.
13. Démontrer que le véhicule étudié, consommant du carburant E85, n’est pas soumis au malus écologique.
Le véhicule étudié, consommant du carburant E85 bénéficie d’un abattement de 40 % sur les taux d’émission de CO2 :
\[ \frac{40}{100} \times 173 = 69 \, \text{g} \]
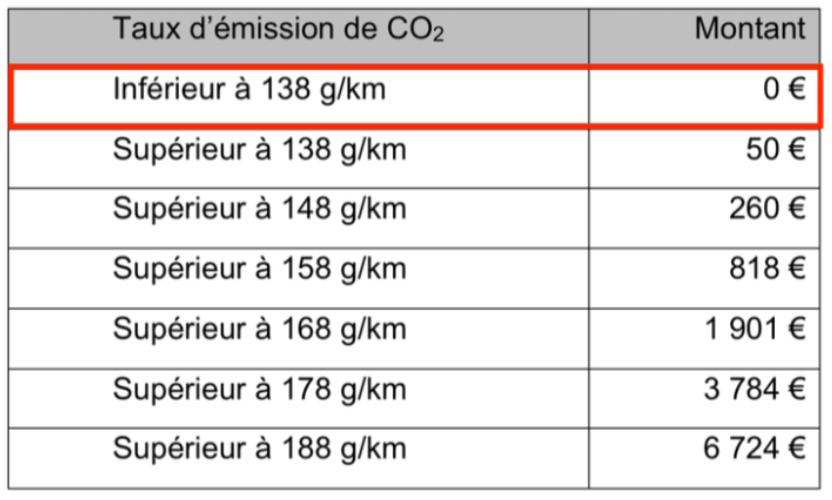
Le taux retenu pour calculer le malus vaut : 173 – 69= 104 g/km.
Cette masse est inférieure à 138 g/km.
D’après le tableau, la taxe sur un véhicule s’élève à 0 €.
Ainsi, le véhicule étudié, consommant du carburant E85, n’est pas soumis au malus écologique.
14. Commenter l’abattement sur les émissions de dioxyde de carbone pour les véhicules roulant au carburant E85, constitué de 85 % de bioéthanol.
D’après l’énoncé : Un véhicule neuf roulant au carburant E85 émet 180 g de CO2 par km.
D’après la question 12 : Un véhicule consommant de l’essence SP95 et émettant 173 g de CO2 émis par km.
Le véhicule roulant au carburant E85 émet donc une masse de CO2 plus importante que celui consommant de l’essence SP95.
L’abattement sur les émissions de dioxyde de carbone pour les véhicules roulant au carburant E85, constitué de 85 % de bioéthanol ne semble pas justifié avec le critère de l’émission de CO2.
