ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH102 et n°SPEPHCH109
Télécharger l’exercice en PDF :
Le photochromisme est la transformation d’une espèce chimique d’une forme A vers une forme B (ou inversement) provoquée par l’absorption d’un rayonnement électromagnétique. Chacune des deux formes, A et B, possède un spectre d’absorption différent. Le passage d’une forme à l’autre est accompagnée par un changement des propriétés physiques de l’espèce chimique, telles que l’indice de réfraction, la solubilité, la viscosité.
La plupart des composés photochrome passe d’une forme incolore ou légèrement colorée (jaune pâle) à une forme plus colorée (bleu, rouge…). Les applications de ce type de composé sont nombreuses : verre photochromique (qui s’assombrit à la lumière du soleil), capteurs UV, revêtements intelligents, stockage d’information, encre de sécurité.
https://fr.wikipedia.org/wiki/Photochromisme
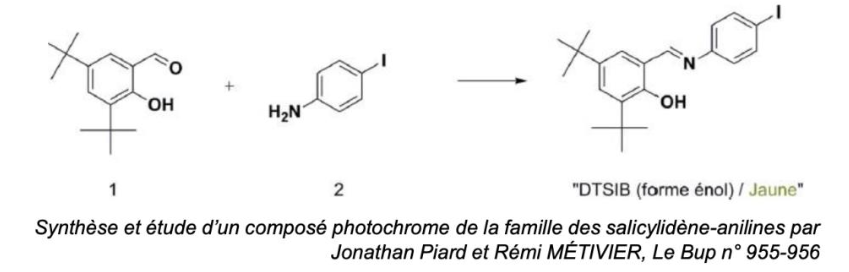
Nous nous intéressons à la synthèse d’un composé photochrome le N-(3,5-di-tert- butylsalicylidène)-4-iodobenzène, que nous noterons DTSIB.
L’équation de la réaction modélisant la synthèse du DTSIB à partir du 3,5-di-tert-butyl-2- hydroxybenzaldéhyde (1) et du 4-iodoaniline (2) est la suivante :
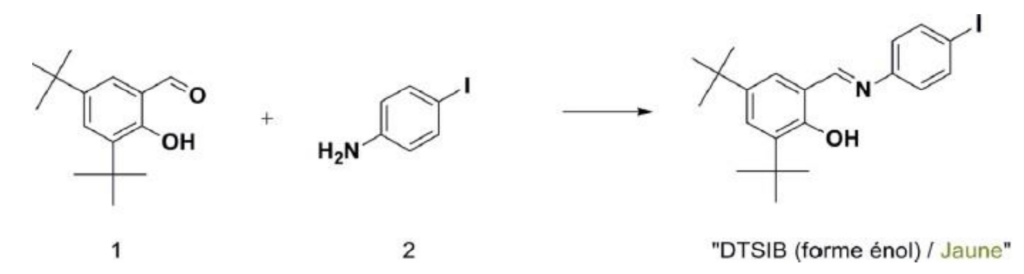
Synthèse et étude d’un composé photochrome de la famille des salicylidène-anilines par Jonathan Piard et Rémi MÉTIVIER, Le Bup n° 955-956
Données
- Electronégativité de certains atomes : hydrogène χ(H) = 2,2 ; carbone χ(C) = 2,5 ; oxygène χ(O) = 3,44.
- Informations concernant certaines molécules :
| Molécule | Propriétés | Dangers |
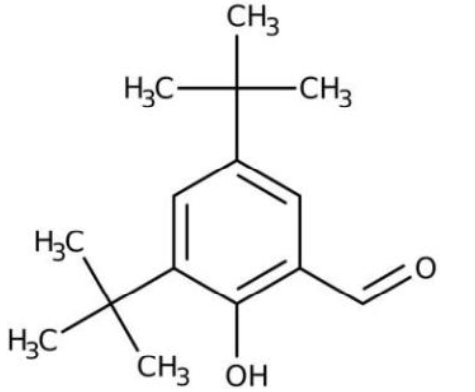
| 3,5-di-tert-butyl- 2-hydroxybenzaldéhyde (ou pourra la noter DTBHB) | Etat solide à température ambiante Soluble dans le méthanol et l’éthanol Masse molaire moléculaire: 234,33 g·mol-1 | Provoque une irritation cutanée Provoque une sévère irritation des yeux Peut irriter les voies respiratoires |
3,5-di-tert-butyl- 2-hydroxybenzaldéhyde (ou pourra la noter DTBHB) :
| Molécule | Propriétés | Dangers |
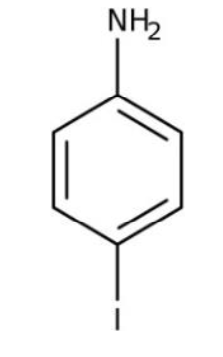
| 4-iodoaniline | Etat solide à température ambiante Légèrement soluble dans l’eau. Soluble dans le chloroforme, le méthanol et l’éthanol Masse molaire moléculaire: 219,02 g·mol-1 | Nocif par contact cutané Provoque une sévère irritation des yeux Nocif par inhalation Provoque une irritation cutanéeNocif en cas d’ingestion Peut irriter les voies respiratoires |
4-iodoaniline
| Molécule | Propriétés | Dangers |
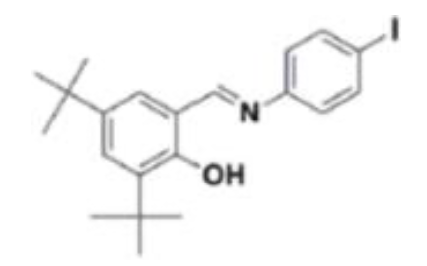
| N-(3,5-di-tert- butylsalicylidène)-4- iodobenzène (on pourra le noter DTSIB) | Peu soluble dans le méthanol Soluble dans le dichlorométhane Masse molaire moléculaire: 435,34 g·mol-1 |
N-(3,5-di-tert- butylsalicylidène)-4- iodobenzène (on pourra le noter DTSIB)
| Molécule | Propriétés | Dangers |
| Dichlorométhane | Masse molaire moléculaire : 84,93 g·mol-1 | Nocif par contact cutané Provoque une sévère irritation des yeux Nocif par inhalation Provoque une irritation cutanée Nocif en cas d’ingestion Cancérogénicité |
Dichlorométhane
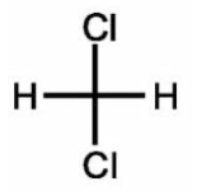
| Molécule | Propriétés | Dangers |
| Méthanol CH3 – OH | Masse molaire moléculaire : 32 g·mol-1 |
| Molécule | Propriétés | Dangers |
| Ethanol CH3 – CH2 – OH | Masse molaire moléculaire : 46 g·mol-1 |
| Molécule | Propriétés | Dangers |
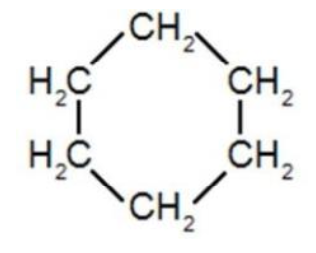
| Cyclohexane | Masse molaire moléculaire : 78 g·mol-1 |
Cyclohexane
- Table de données pour la spectroscopie infrarouge :
| Liaison | Nombre d’onde (cm-1) | Intensité |
| O-H | 2900-3200 | forte |
| N-H amine | 3100-3500 | moyenne |
| O-H acide carboxylique | 2500-3200 | forte à moyenne, large |
| N-H amine ou amide | 1560-1640 | forte |
| C = N imine | 1615-1700 | forte |
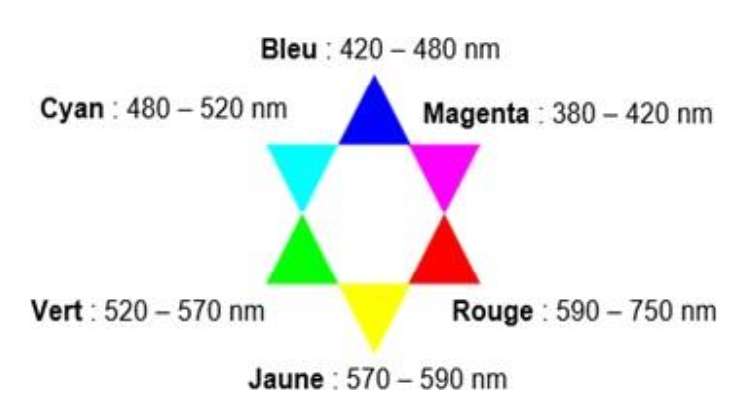
- Cercle chromatique :
Étude du protocole expérimental
Le protocole expérimental de la synthèse du DTSIB est le suivant :
Dans un erlenmeyer, introduire 400 mg de 3,5-di-tert-butyl-2-hydroxybenzaldéhyde et 400 mg de 4-iodoaniline dissous dans 15 mL d’éthanol. Le 4-iodoaniline est donc ajouté en léger excès.
Ajouter une pointe de spatule d’acide para-toluènesulfonique. Agiter vigoureusement la solution à température ambiante. Au bout de vingt minutes d’agitation environ, vérifier l’apparition d’un précipité jaune persistant. Après quarante-cinq minutes d’agitation, le mélange réactionnel est filtré sur Büchner, lavé avec 15 mL d’éthanol par petites fractions, essoré cinq minutes sous vide puis séché sur papier filtre.
Synthèse et étude d’un composé photochromede la famille des salicylidène-anilines par Jonathan Piard et Rémi MÉTIVIER, Le Bup n° 955-956
1. Indiquer les précautions à prendre lors de l’utilisation du 3,5 di-tert-butyl-2- hydroxybenzaldéhyde et du 4-iodoaniline.
Le 3,5 di-tert-butyl-2- hydroxybenzaldéhyde (DTBHB) :
- Provoque une irritation cutanée
- Provoque une sévère irritation des yeux
- Peut irriter les voies respiratoires
Il faut donc mettre une blouse, des gants et des lunettes de protections et travailler sous hotte aspirante pour ne pas être en contact avec les vapeurs de ce produit.
Le 4-iodoaniline :
- Nocif par contact cutané
- Provoque une sévère irritation des yeux
- Nocif par inhalation
- Provoque une irritation cutanée
- Nocif en cas d’ingestion
- Peut irriter les voies respiratoires
Il faut donc mettre une blouse, des gants et des lunettes de protections et travailler sous hotte aspirante pour ne pas être en contact avec les vapeurs de ce produit.

Ainsi, les précautions à prendre lors de l’utilisation du 3,5 di-tert-butyl-2- hydroxybenzaldéhyde et du 4-iodoaniline sont :
- Mettre une blouse
- Porter lunettes de protections
- Porter des lunettes de protections
- Travailler sous hotte aspirante
2. Justifier par un calcul la phrase suivante : « Le 4-iodoaniline est donc ajouté en léger excès. »
Calculons la quantité de 3,5 di-tert-butyl-2- hydroxybenzaldéhyde (DTBHB) introduit initialement dans le milieu réactionnel :
\[ \mathrm{n_{\text{DTBHB}} = \frac{m_{\text{DTBHB}}}{M_{\text{DTBHB}}}}\]
\[ \mathrm{n_{\text{DTBHB}} = \frac{400 \times 10^{-3}}{234{,}33}}\]
\[ \mathrm{n_{\text{DTBHB}} = 1{,}71 \times 10^{-3} \, \text{mol}}\]
Calculons la quantité de 4-iodoaniline introduit initialement dans le milieu réactionnel :
\[ \mathrm{n_{\text{4-iodoaniline}} = \frac{m_{\text{4-iodoaniline}}}{M_{\text{4-iodoaniline}}}}\]
\[ \mathrm{n_{\text{4-iodoaniline}} = \frac{400 \times 10^{-3}}{219{,}02}}\]
\[ \mathrm{n_{\text{4-iodoaniline}} = 1{,}82 \times 10^{-3} \, \text{mol}}\]
L’équation de la réaction modélisant la synthèse du DTSIB à partir du 3,5-di-tert-butyl-2-hydroxybenzaldéhyde (1) et du 4-iodoaniline (2) est la suivante :
\[ \mathrm{x_{\text{max}1} = \frac{n_{\text{DTBHB}}}{1}}\]
\[ \mathrm{x_{\text{max}1} = \frac{1{,}71 \times 10^{-3}}{1}}\]
\[ \mathrm{x_{\text{max}1} = 1{,}71 \times 10^{-3} \, \text{mol}}\]
\[ \mathrm{x_{\text{max}2} = \frac{n_{\text{4-iodoaniline}}}{1}}\]
\[ \mathrm{x_{\text{max}2} = \frac{1{,}82 \times 10^{-3}}{1}}\]
\[ \mathrm{x_{\text{max}2} = 1{,}82 \times 10^{-3} \, \text{mol}}\]
\(x_{\text{max}1} < x_{\text{max}2}\) : \(x_{\text{max}} = x_{\text{max}1} = 1{,}71 \times 10^{-3} \, \text{mol}\).
La différence entre les deux valeurs est faible.
C’est pourquoi, on peut affirmer que se 4-iodoaniline est donc ajouté en léger excès.
3. Indiquer le rôle joué par l’éthanol lors de cette synthèse.
Le 3,5 di-tert-butyl-2- hydroxybenzaldéhyde (DTBHB) est soluble dans le méthanol et l’éthanol.
Le 4-iodoaniline est soluble dans le chloroforme, le méthanol et l’éthanol
Lors de cette synthèse, l’éthanol joue le rôle de solvant.
4. Déterminer le caractère polaire ou apolaire des molécules d’éthanol et de cyclohexane.
Calculons la différence d’électronégativité entre l’atome d’oxygène et l’atome d’hydrogène :
∆χ=χ(O)-χ(H)
∆χ=3,44-2,2
∆χ=1,24
∆χ>0,4 : la liaison O—H est polaire.
Calculons la différence d’électronégativité entre l’atome de carbone et l’atome d’hydrogène :
∆χ=χ(C)-χ(H)
∆χ=2,5-2,2
∆χ=0,3
0≤∆χ≤0,4 : la liaison C—H n’est polaire.
Calculons la différence d’électronégativité entre l’atome d’oxygène et l’atome de carbone :
∆χ=χ(O)-χ(C)
∆χ=3,44-2,5
∆χ=0,94
∆χ>0,4 : la liaison C—O est polaire.
Le cyclohexane ne contient que du carbone et de l’hydrogène. Toutes les liaisons ne sont pas polaires : le cyclohexane est apolaire.
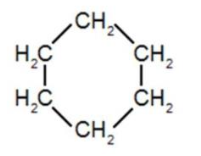
L’éthanol à des liaisons O—H et C—O sui sont polaires. L’éthanol est une molécule polaire.
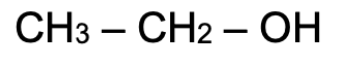
5. Indiquer si on peut utiliser le cyclohexane à la place de l’éthanol lors de cette synthèse.
Le cyclohexane est apolaire et l’éthanol est une molécule polaire. Ainsi, on ne peut pas utiliser le cyclohexane à la place de l’éthanol lors de cette synthèse.
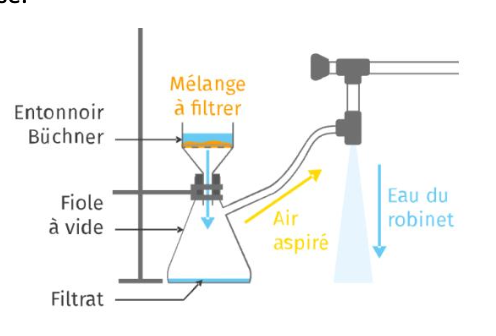
6. Indiquer le nom de la technique de séparation utilisée à la fin de la synthèse. Schématiser le matériel utilisé et légender le schéma.
La technique de séparation utilisée à la fin de la synthèse s’appelle la filtration sous vide ou filtration Büchner.
A la fin de la synthèse, on recueille 392 mg de DTSIB brut.
7. Déterminer le rendement de cette synthèse. Commenter le résultat obtenu.
Déterminons la masse maximale de de DTSIB qu’il est possible d’obtenir si la transformation est considérée comme totale :
\[ \mathrm{ n_{\text{DTSIB}}^{\text{max}} = \frac{m_{\text{DTSIB}}^{\text{max}}}{M_{\text{DTSIB}}}}\]
\[ \mathrm{ m_{\text{DTSIB}}^{\text{max}} = n_{\text{DTSIB}}^{\text{max}} \times M_{\text{DTSIB}}}\]
Or,
\[ \mathrm{ n_{\text{DTSIB}}^{\text{max}} = x_{\text{max}}}\]
Donc,
\[ \mathrm{ m_{\text{DTSIB}}^{\text{max}} = x_{\text{max}} \times M_{\text{DTSIB}}}\]
\[ \mathrm{ m_{\text{DTSIB}}^{\text{max}} = 1{,}71 \times 10^{-3} \times 435{,}34}\]
\[ \mathrm{ m_{\text{DTSIB}}^{\text{max}} = 0{,}744 \, \text{g}}\]
\[ \mathrm{ m_{\text{DTSIB}}^{\text{max}} = 744 \, \text{mg}}\]
Déterminons le rendement :
\[ \mathrm{ \eta = \frac{m_{\text{DTSIB}}^{\text{expérimentale}}}{m_{\text{DTSIB}}^{\text{max}}}}\]
\[ \mathrm{ \eta = \frac{392}{744}}\]
\[ \mathrm{ \eta = 0{,}527}\]
\[ \mathrm{ \eta = 52{,}7 \, \%}\]
Le rendement de cette synthèse est de 52,7 %.
Identification et propriétés du produit obtenu
Une analyse du produit de synthèse obtenu par chromatographie sur couche mince donne les résultats suivants :
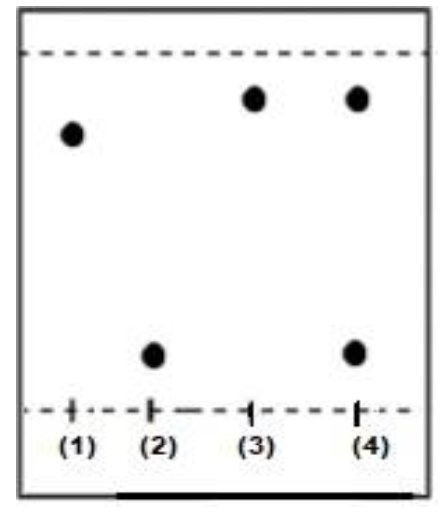
(1) 3,5- di-tert-butyl-2 hydroxybenzaldéhyde
(2) 4-iodoaniline
(3) DTSIB pur
(4) Produit de synthèse brut
8. Interpréter le chromatogramme obtenu.
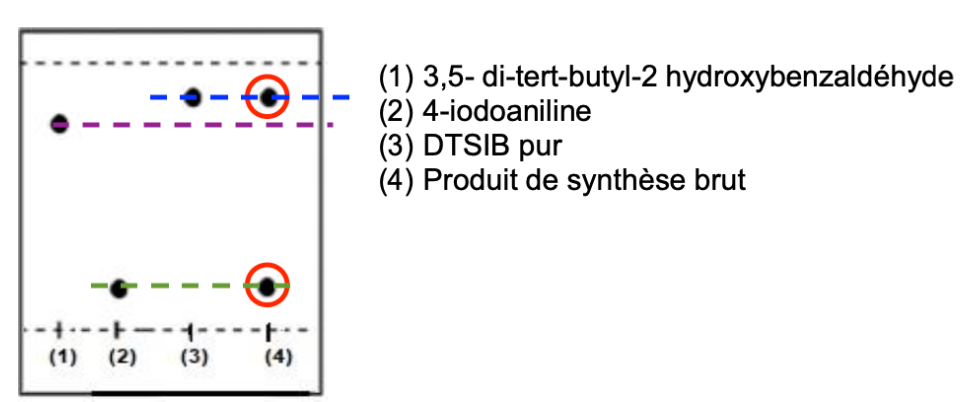
Le produit de synthèse brut obtenu par synthèse (4) présente deux taches dans la chromatographie sur couche mince.
Une tache est sur le même niveau que la tâche du DTSIB pur (3). Ainsi, il y a du DTSIB dans le produit obtenu par synthèse.
Une tache est sur le même niveau que la tâche du 4-iodoaniline (2). Ainsi, il y a du 4-iodoaniline dans le produit obtenu par synthèse.
Il n’y a pas de tâche sur le même niveau que la tâche du 3,5- di-tert-butyl-2 hydroxybenzaldéhyde (1). Ainsi, il n’y a pas de 3,5- di-tert-butyl-2 hydroxybenzaldéhyde dans le produit obtenu par synthèse.
En conclusion, le produit de synthèse brut obtenu contient du DTSIB et du 4-iodoaniline : il ne contient pas de 3,5- di-tert-butyl-2 hydroxybenzaldéhyde.
9. Indiquer si les résultats de la CCM paraissent en accord avec les conditions expérimentales choisies.
Le produit de synthèse brut obtenu contient du DTSIB et du 4-iodoaniline : il ne contient pas de 3,5- di-tert-butyl-2 hydroxybenzaldéhyde. (Voir question 8.)
La réaction est totale (sinon il y aurait encore du 3,5- di-tert-butyl-2 hydroxybenzaldéhyde) et il reste du 4-iodoaniline car il a été ajouté en léger excès.
Ainsi, les résultats de la CCM paraissent en accord avec les conditions expérimentales choisies.
Afin de purifier le produit brut obtenu, on peut procéder à une recristallisation en utilisant du méthanol comme solvant de recristallisation.
10. Justifier l’utilisation du méthanol comme solvant permettant d’éliminer les éventuelles traces de 3,5-di-tert-butyl-2-hydroxybenzaldéhyde et de 4-iodoaniline présentes dans le produit final.
Le produit final DTSIB est peu soluble dans le méthanol, il ne va donc pas se dissoudre avec l’ajout de méthanol.
Le 3,5-di-tert-butyl-2-hydroxybenzaldéhyde et de 4-iodoaniline sont solubles dans le méthanol, elles vont donc se dissoudre dans le méthanol.
En filtrant, on récupère le DTSIB sans le 3,5-di-tert-butyl-2-hydroxybenzaldéhyde et le 4-iodoaniline qui sont dissous.
Ainsi, l’utilisation du méthanol comme solvant permettant d’éliminer les éventuelles traces de 3,5-di-tert-butyl-2-hydroxybenzaldéhyde et de 4-iodoaniline présentes dans le produit final.
11. Nommer la famille associée au groupe caractéristique entouré sur la molécule DTSIB représentée ci-dessous :
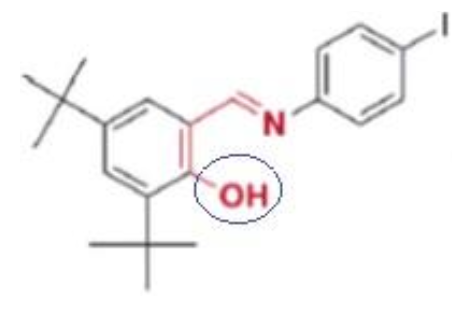
La famille associée au groupe caractéristique entouré sur la molécule DTSIB est la famille des alcools.
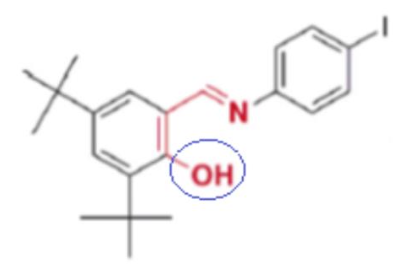
Les groupes caractéristiques présents dans cette molécule peuvent être identifiées grâce aux spectres infrarouge (I.R.). Celui de cette molécule DTSIB est proposé ci-dessous :
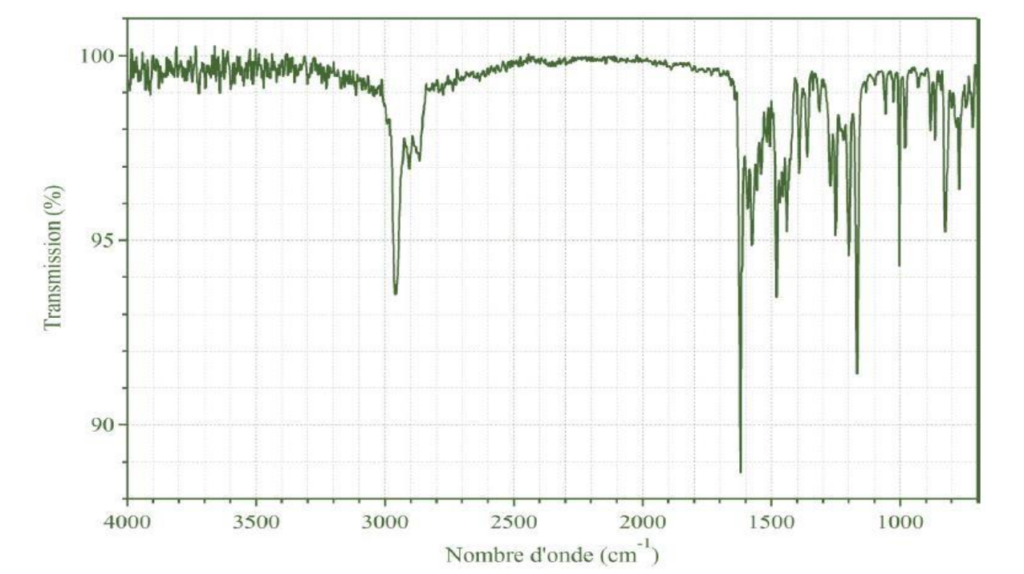
Spectre infrarouge du DTSIB sous sa forme énol
Synthèse et étude d’un composé photochromede la famille des salicylidène-anilines par Jonathan Piard et Rémi MÉTIVIER, Le Bup n° 955-956
12. Analyser le spectre infrarouge ci-dessus et justifier qu’il peut correspondre à celui de la molécule de DTSIB.
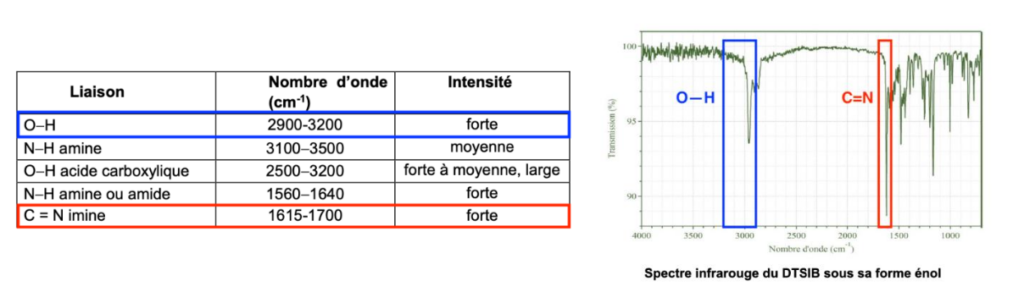
D’après la table spectroscopique IR pour la spectroscopie infrarouge, la molécule de DTSIB qui contient une liaison O—H et C=N donne un spectre ayant :
- Une bande forte dont le nombre d’onde est compris entre 2900 et 3200 cm-1 pour la liaison O-H
- Une bande forte dont le nombre d’onde est compris entre 1615 et 1700 cm-1 pour la liaison C=N
Ces bandes caractéristiques sont présentes dans le spectre. Ainsi, le spectre IR peut correspondre à celui de la molécule de DTSIB.
Le DTSIB existe sous deux formes : une forme énol de couleur jaune et une forme cétone de couleur rouge. Il est possible d’analyser le passage de la forme cétone à la forme énol grâce à la spectrophotométrie.
13. Indiquer dans quel intervalle de longueur d’onde régler le spectrophotomètre afin de suivre la disparition de la forme cétone.
Le DTSIB existe sous deux formes : une forme énol de couleur jaune et une forme cétone de couleur rouge.
Les deux se distinguent avec de la lumière visible (jaune et rouge).
Il faut donc régler le spectrophotomètre dans intervalle des longueurs d’ondes du visible entre 400 nm et 800nm afin de suivre la disparition de la forme cétone.
