E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02790 et n°G1SPHCH02800
Télécharger l’exercice en PDF :
Partie 1. Se désaltérer sans altérer sa santé
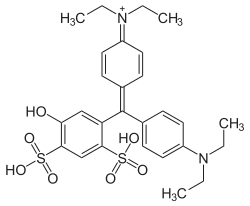
Pour se désaltérer, il est coutume de consommer du sirop de menthe ; ce dernier contient plusieurs colorants dont le bleu patenté V (E131) de couleur bleue.

DJA du bleu patenté V
Les colorants alimentaires font l’objet de contrôles sanitaires par l’Union Européenne (UE).
Un de ces contrôles, réalisé par l’EFSA (autorité européenne de sécurité des aliments), consiste à déterminer la dose journalière admissible(DJA) qui est la quantité d’une substance qu’une personne peut ingérer quotidiennement tout au long de sa vie sans risque appréciable pour sa santé.
La DJA du bleu patenté est de 2,5 mg de produit absorbable par kg de masse corporelle et par jour.
Source : d’après le site : http://www.efsa.europa.eu/
Le but de cette première partie est de déterminer le nombre de verres de sirop de menthe que l’on peut boire sans dépasser la dose journalière admissible en bleu patenté V.
Données :
- masse molaire du bleu patenté : 560,7 g.mol -1 ;
- spectre d’absorption d’une solution aqueuse de bleu patenté V et cercle chromatique :
Source : d’après le site : http://sciences-physiques-et-chimiques-de-laboratoire.org/
1.1. Nommer le groupe caractéristique – OH présent dans le bleu patenté.
Le groupe caractéristique – OH présent dans le bleu patenté est le groupe hydroxyle.
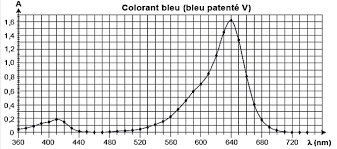
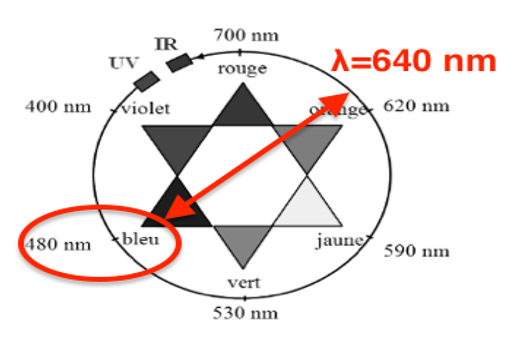
1.2. Décrire et commenter le spectre d’absorption du bleu patenté.
Le spectre présente 2 maximums :
1er maximum pour $\lambda=410\ nm$
2nd maximum pour $\lambda=640\ nm$
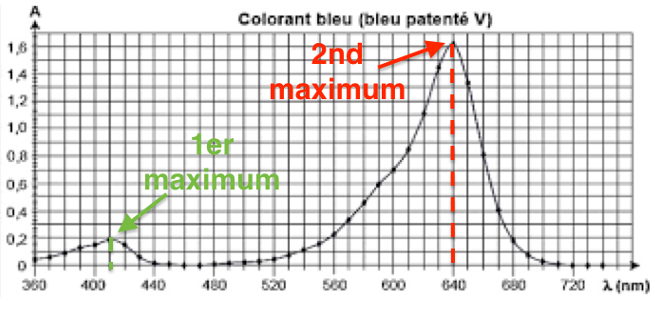
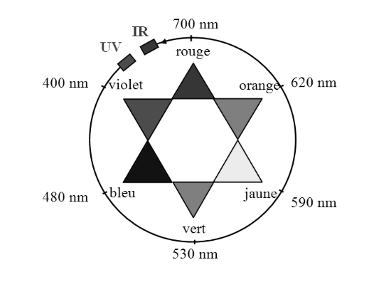
Il absorbe principalement pour $\lambda=640\ nm$. Sa couleur est la couleur complémentaire (couleur diamétralement opposée sur le cercle chromatique). Le bleu patenté est donc bleu.
1.3. On se propose de déterminer la valeur de la concentration en quantité de matière de bleu patenté dans un sirop de menthe à partir d’un dosage par étalonnage utilisant des mesures d’absorbance de solutions de concentrations connues.
On réalise à partir d’une solution aqueuse mère de bleu patenté V (notée S0) une échelle de teintes constituée de cinq solutions diluées S1, S2, S3, S4 et S5 versées dans des cuves identiques.
Par ailleurs, on dilue dix fois le sirop de menthe et on note S la solution aqueuse obtenue à l’issue de cette dilution. Les résultats sont consignés dans le tableau ci-dessous :
| Solution Si | S0 | S1 | S2 | S3 | S4 | S5 | S |
| Concentration en quantité de matière C (en µmol.L-1) | 10 | 5,0 | 2,5 | 2,0 | 1,5 | 1,0 | …… |
| Absorbance A | 1,6 | 0,80 | 0,39 | 0,32 | 0,24 | 0,16 | 0,75 |
Les mesures sont reportées sur le graphe ci-dessous représentant l’évolution de l’absorbance A de la solution aqueuse de bleu patenté en fonction de la concentration C en quantité de matière de bleu patenté.

1.3.1. Rédiger le protocole de dilution mis en œuvre pour préparer 100,0 mL de solution S2 à partir de la solution S0.
Lors d’une dilution la quantité de matière se conserve :
$$n_0=n_2$$
Or
$$n=C\times V$$
Donc
$$C_0V_0=C_2V_2$$
$$V_0=\frac{C_2V_2}{C_0}$$
$$V_0=\frac{2,5{.10}^{-6}\times 100,0{.10}^{-3}}{10{.10}^{-6}}$$
$$V_0=2,50{.10}^{-2}L$$
$$V_0=25,0\ mL$$
V0 le volume fille est celui d’une fiole jaugée et V2 le volume de la solution mère est prélevé avec une pipette jaugée.
Prenons une pipette jaugée de 25,0 mL et une fiole jaugée de 100,0 mL.
Protocole :
- Verser la solution mère dans un bécher
- Prélever à l’aide d’une pipette jaugée V0 =25,0 mL de la solution mère
- Introduire V2 dans une fiole jaugée 100,0 mL
- Ajouter de l’eau distillée jusqu’au trait de jauge
- Homogénéiser la solution
1.3.2. Déterminer le nombrede verres de sirop de menthe que peut boire au maximum une personne adulte sans dépasser la dose journalière admissible (DJA) en bleu patenté V. Commenter.
Le candidat est invité à prendre des initiatives, à estimer notamment la valeur du volume d’un verre de sirop de menthe et de celle de la masse d’une personne adulte, et à présenter la démarche suivie, même si elle n’a pas abouti.
L’absorbance de la solution S est A=0,75. Par lecture graphique $$C=4,75{.10}^{-6}mol{.L}^{-1}$$
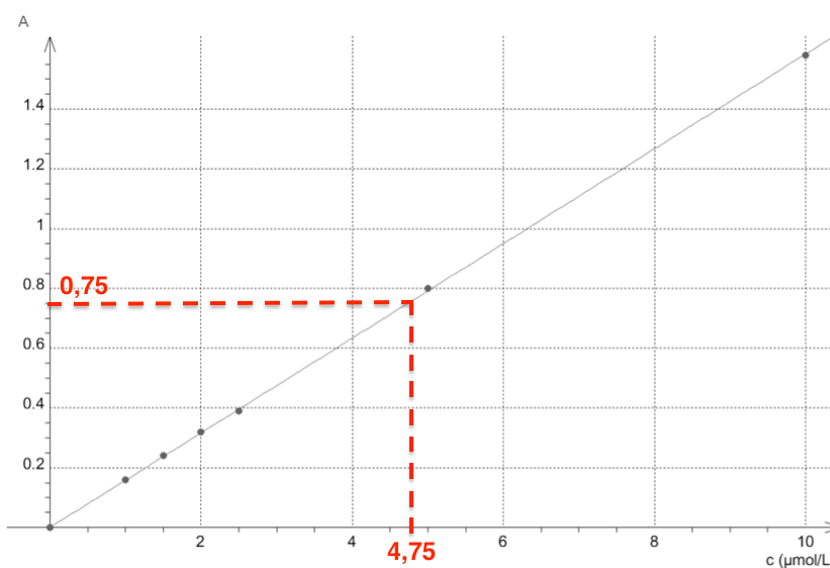
Or on a dilué dix fois le sirop de menthe et on note S
$$C_{sirop}=10\times C$$
$$C_{sirop}=10\times 4,75{.10}^{-6}$$
$$C_{sirop}=4,75{.10}^{-5}mol{.L}^{-1}$$
La DJA du bleu patenté est de 2,5 mg de produit absorbable par kg de masse corporelle et par jour.
« Le candidat est invité à prendre des initiatives » : on considère une personne de 75Kg.
Cette personne peut consommer : $$m=2,5{.10}^{-3}\times 75=1,88{.10}^{-1}g$$
Trouvons le volume de sirop correspondant à cette masse maximale.
$$C=\frac{n}{V}$$
$$V=\frac{n}{C}$$
Or
$$n=\frac{m}{M}$$
D’ou
$$V=\frac{m}{M\times C}$$
$$V=\frac{1,88{.10}^{-1}}{560,7\times 4,75{.10}^{-5}}=7,06\ L$$
« Le candidat est invité à prendre des initiatives » : on considère qu’un verre mesure 200 mL.
Nombre de verre :
$$N=\frac{7,06}{200{.10}^{-3}}=35\ verres$$
Ce volume n’est pas consommable en une journée. C’est pourquoi ce sirop ne présente pas de danger.
Partie 2. Utilisation d’un microcontrôleur pour réaliser un spectrophotomètre
Le but de cette deuxième partie est de réaliser un spectrophotomètre à l’aide d’un microcontrôleur en l’associant à une diode électroluminescente (DEL) et à un détecteur de lumière afin de calculer l’absorbance de la solution de sirop de menthe diluée (solution S) étudiée dans la partie 1.
Le dispositif constituant le spectrophotomètre est composé d’une diode émettrice considérée comme monochromatique (DEL), d’un capteur de lumière et d’un microcontrôleur. Ce dernier mesure l’éclairement lumineux Er en lux (lx) après passage du faisceau lumineux à travers la cuve et la solution.
En traversant une solution colorée, un rayonnement monochromatique perd une partie de son intensité lumineuse. Ce phénomène est quantifié par la grandeur absorbance.
Schéma de principe :
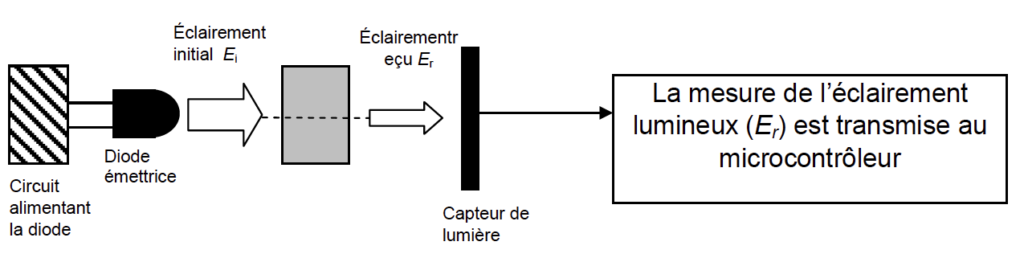
L’absorbance peut être définie par la relation : A = – log (Er/Ei)
Afin de négliger l’absorption de l’eau dans le domaine spectral d’étude, on considère que l’éclairementreçu dans le cas de la cuve témoin contenant uniquement de l’eau est égal à l’éclairement initial Ei et vaut 63,8 lx.
Données :
- La valeur de la célérité c de la lumière dans le vide est supposée connue ;
- constante de Planck : h = 6,63×10 – 34 J.s ;
- électron-volt : 1 eV = 1,60×10–19 J.
On dispose des diodes électroluminescentes monochromatiques suivantes :
- une DEL bleue émettant une radiation de longueur d’onde égale à 466 nm ;
- une DEL verte émettant une radiation de longueur d’onde égale à 525 nm ;
- une DEL jaune émettant une radiation de longueur d’onde égale à 589 nm ;
- une DEL orange émettant une radiation de longueur d’onde égale à 630 nm.
2.1. Indiquer la diode à choisir pour mesurer l’absorbance d’une solution aqueuse de bleu patenté V. Justifier en se référant aux données de la partie 1.
Le bleu patenté a son maximum d’absorption pour $\lambda_{max}=640\ nm$ (Voir question 1.2). Il faut une diode qui produise cette lumière.
La DEL orange émettant une radiation de longueur d’onde égale à 630 nm est la plus adaptée.
2.2. On donne un extrait du diagramme énergétique de l’atome d’oxygène :
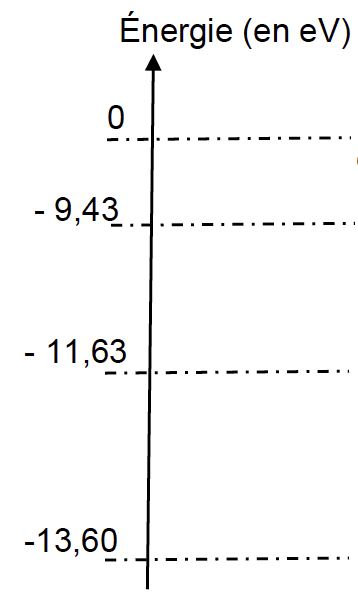
2.2.1. Calculer, en eV, la valeur de la variation d’énergie ∆E correspondant à l’absorption par un atome d’oxygène d’une radiation monochromatique émise par une DEL orange. Commenter.
$$\Delta E=h\times \nu= h\times \frac{c}{\lambda}$$
$$\Delta E= 6,63.10^{-34}\times \frac{3,00.10^8}{630.10^{-9}}$$
$$\Delta E= 3,16.10^{-19}\ J$$
$$\Delta E= \frac{3,16.10^{-19}}{1,6.10^{-19}}=1,97\ ev$$
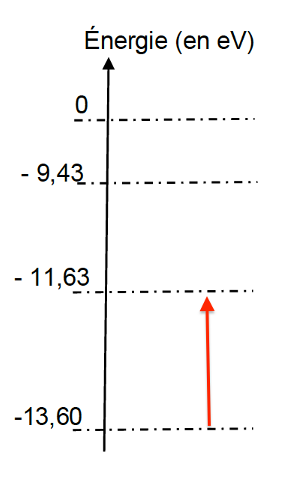
2.2.2. Reproduire le diagramme énergétique de l’atome d’oxygène sur la copie et représenter la transition énergétique correspondante.
Il faut trouver une différence d’énergie entre 2 niveaux de 1,97 ev.
-11,63-(-13,60)= 1,97 ev
De plus transition énergétique correspond à l’absorption d’une radiation (Voir question 2.2.1). Donc la flèche monte.
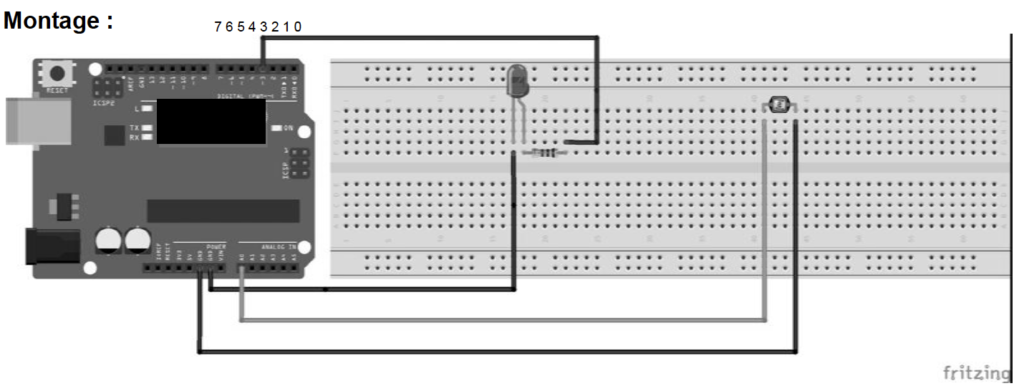
2.3. Le programme ci-dessous permet d’obtenir la mesure de l’éclairement reçu Er par le capteur de lumière :

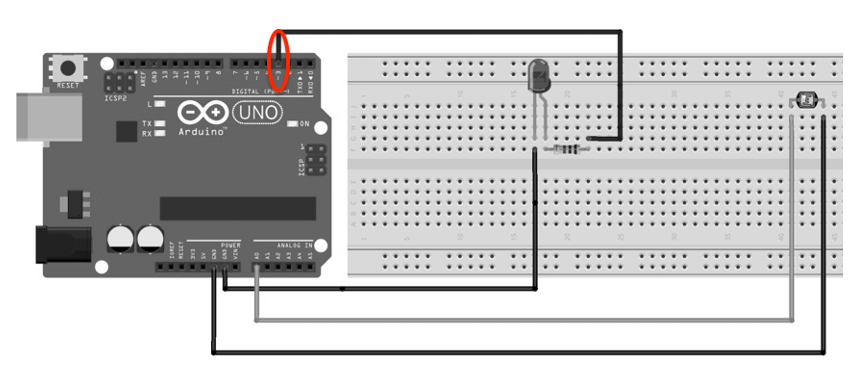
2.3.1. D’après le montage réalisé, dire si la LED a été déclarée sur la broche à laquelle elle est connectée. Si non, réécrire la ligne de code en la corrigeant.
La LED est connectée sur la broche 3.
Cependant elle est déclarée sur la broche 2 dans le programme.
Ligne 1 int ledPin = 3
(au lieu de int ledPin = 2 )
2.3.2. Rédiger le commentaire à ajouter pour expliquer la ligne de code « delay(300) ; ».
La fonction delay réalise une pause dans l’exécution du programme pour la durée (en millisecondes) indiquée en paramètre. Ici la pause est de 300 ms.
Il faut donc mettre le commentaire : // Le programme fait une pause de 300 ms
2.4. L’éclairement reçu mesuré par le capteur de lumière est de 11,3 lx.
Comparer la valeur de l’absorbance mesurée à l’aide de ce dispositif à celle mesurée dans la partie 1.
D’après les données : l’absorbance peut être définie par la relation : $A\ =\ -\ log\ \left(\frac{E_r}{E_i}\right)$
Avec Ei qui vaut 63,8 lx.
Calculons l’absorbance de la solution :
$$A\ =\ -\ log\ \left(\frac{E_r}{E_i}\right)$$
$$A\ =\ -\ log\ \left(\frac{11,3}{63,8}\right)=0,75$$
La valeur de l’absorbance mesurée à l’aide de ce dispositif est identique à celle mesurée dans la partie 1.
