E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02704 et n°G1SPHCH02741
Télécharger l’exercice en PDF :
La plupart des sirops de menthe commerciaux partagent un goût mentholé et une couleur verte.
L’objectif de l’exercice est d’une part d’étudier des voies de synthèse de deux molécules au goût mentholé – la menthone et l’éthanoate de menthyle- et d’autre part, de proposer une méthode de dosage d’un colorant présent dans le sirop, le bleu patenté V, afin d’estimer la quantité maximale de sirop qui peut être consommé sans risque pour la santé.
- Goût de menthe : le menthol et ses dérivés
Le menthol tire son nom de l’essence de menthe. C’est un composé qui est utilisé fréquemment dans les industries agroalimentaire, pharmaceutique et cosmétique.
La menthone, qui entre dans la composition de certains parfums et arômes naturels, est obtenue par oxydation en milieu acide du menthol.
L’éthanoate de menthyle, présent dans l’huile essentielle de menthe, contribue à l’odeur et au goût de la menthe poivrée. Il peut être obtenu à partir d’acide éthanoïque et de menthol.
Données :
- Formules brutes et semi-développées du menthol, de la menthone et de l’éthanoate de menthyle :
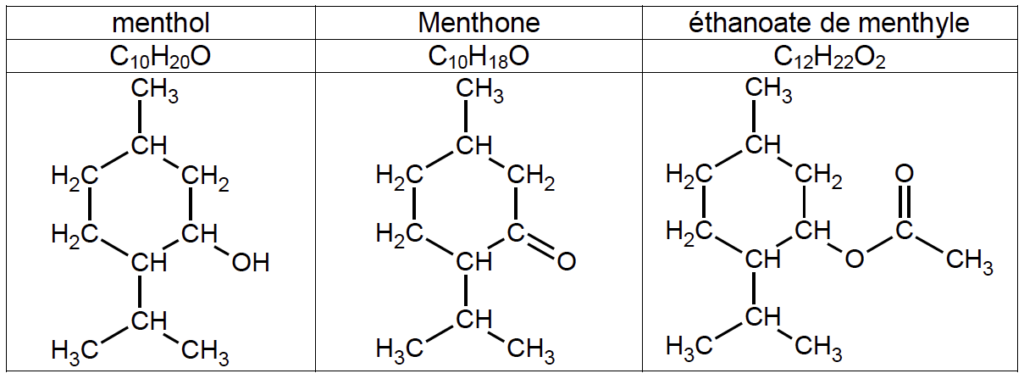
1.1. Indiquer les familles de composés auxquelles appartiennent le menthol, la menthone. Justifier.
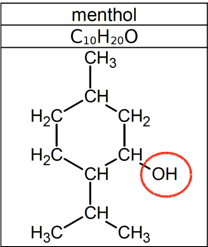
Le menthol : présence d’un groupe hydroxyle –OH , famille des alcools.
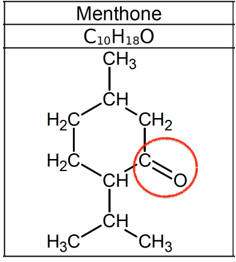
La menthone : présence d’un groupe carbonyle C=O, famille des cétones.
1.2. La menthone peut être obtenue au laboratoire par oxydation du menthol par le trioxyde de chrome CrO3.
menthone / menthol
C10H18O/ C10H20O
C10H18O + 2H+ + 2e– =C10H20O
Le menthol (C10H20O) est un réducteur, il subit une oxydation (perte d’électrons) quand il réagit pour se transformer en menthone.
Écrire la demi-équation électronique associée au couple menthone / menthol et justifier que le terme d’oxydation pour le passage du menthol à la menthone.
1.3. Synthèse de l’éthanoate de menthyle à partir d’acide éthanoïque et de menthol.
L’équation de la réaction modélisant la synthèse est la suivante :
C10H20O + C2H4O2 → C12H22O2 + H2O
menthol acide éthanoïque éthanoate de menthyle
Protocole de synthèse en laboratoire :
- étape 1 : verser dans un ballon 15,6 g de menthol, puis, avec précaution, 11,0 mL d’acide éthanoïque pur, et enfin, quelques gouttes d’acide sulfurique concentré ;
- étape 2 : chauffer à reflux le mélange réactionnel durant 40 minutes environ ;
- étape 3 : verser le mélange obtenu dans un bécher contenant 100 mL de solution aqueuse de chlorure de sodium ;
- étape 4 : extraire la phase organique contenant l’éthanoate de menthyle à l’aide d’une ampoule à décanter ;
- étape 5 : laver la phase organique avec une solution saturée d’hydrogénocarbonate de sodium, on observe une effervescence ;
- étape 6 : agiter prudemment quelques instants en dégazant régulièrement, puis éliminer la phase aqueuse ;
- étape 7 : sécher la phase organique avec du sulfate de magnésium anhydre.
Quelques propriétés des espèces chimiques de la synthèse :
| Nom | Formule brute | Masse molaire (g.mol-1) | Masse volumique (g.mL-1) | Miscibilité avec l’eau |
| Menthol | C10H20O | 156 | 0,89 | partielle |
| Acide éthanoïque | C2H4O2 | 60 | 1,05 | presque totale |
| Éthanoate de menthyle | C12H22O2 | 198 | 0,92 | très faible |
– Électronégativités de quelques éléments :
O : 3,2 C : 2,6 H : 2,2
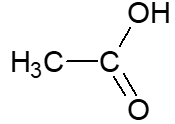
1.3.1. Justifier le nom de l’acide éthanoïque.
Acide éthanoïque
éthan : chaine carbonée composée de deux atomes de carbone.
Acide ……..oïque : famille des acides carboxyliques, présence d’un groupe carboxyle COOH.
1.3.2. Indiquer l’intérêt d’utiliser un chauffage à reflux durant la synthèse.
Le chauffage à reflux permet d’accélérer la réaction, sans pertes de matière.
1.3.3. Expliquer la très forte miscibilité de l’acide éthanoïque avec l’eau.
Les liaisons C-H ne sont pas polarisées du fait de leurs électronégativités semblables.
Les liaisons C-O, C=O et O-H sont polarisées du fait de la différence d’électronégativités importante entres les atomes liés.
Ainsi la molécule est polaire.
L’eau étant également polaire, l’acide éthanoïque présente une très forte miscibilité avec l’eau.
1.3.4. Justifier la présence de deux phases dans le bécher à l’issue de l’étape 3 du protocole.
Dans l’étape 3, nous avons versé une solution aqueuse de chlorure de sodium (eau salée).
Or l’éthanoate de menthyle n’est pas miscible avec l’eau (le caractère salé de l’eau diminue encore plus sa miscibilité avec al solution). Ainsi la séparation crée deux phases dans le bécher.
1.3.5. Montrer que le menthol est le réactif limitant.
Calculons la quantité initiale de menthol :
$$n_{menthol}=\frac{m_{menthol}}{M_{menthol}}$$
$$n_{menthol}=\frac{15,6}{156}=1,00.10^{-1}\ mol$$
Calculons la quantité initiale d’Acide éthanoïque :
$$n_{acide\ éthanoïque}=\frac{m_{acide\ éthanoïque}}{M_{acide\ éthanoïque}}$$
Or $$m_{acide\ éthanoïque}=\rho_{acide\ éthanoïque}\times V_{acide\ éthanoïque}$$
d’ou
$$n_{acide\ éthanoïque}=\frac{\rho_{acide\ éthanoïque}\times V_{acide\ éthanoïque}}{M_{acide\ éthanoïque}}$$
$$n_{acide\ éthanoïque}=\frac{1,05\times 11,0}{60}=1,93.10^{-1}\ mol$$
Déterminons le réactif limitant :
| Équation de réaction | C10H20O + C2H4O2 → C12H22O2 + H2O | ||||
| Avancement (en mol) | Quantités de matière (en mol) | ||||
| État initial | 0 | $1,00.10^{-1}$ | $1,93.10^{-1}$ | 0 | 0 |
| État intermédiaire | x | $1,00.10^{-1}-x$ | $1,93.10^{-1}-x$ | x | x |
| État final | $x_f$ | $1,00.10^{-1}-x_f$ | $1,93.10^{-1}-x_f$ | $x_f$ | $x_f$ |
$1,00.10^{-1}$-$x_{max1}$=0
$x_{max1}$=$1,00.10^{-1}$ mol
$1,93.10^{-1}$-$x_{max2}$=0
$x_{max2}$=$1,93.10^{-1}$ mol
$x_{max1}<x_{max2}$
Ainsi le menthol est le réactif limitant.
1.3.6. À la fin de la synthèse on a obtenu un volume égal à 13 mL d’éthanoate de menthyle. Déterminer le rendement de la réaction.
Rendement :
$$\eta=\frac{m_{exp}}{m_{Th}}$$
$$m_{exp}=\rho_{Éthanoate\ de\ menthyle}\times V_{Éthanoate\ de\ menthyle}$$
et
$$m_{Th}=n_{Th\ Éthanoate\ de\ menthyle}\times M_{Éthanoate\ de\ menthyle}$$
$$m_{Th}=x_{max}\times M_{Éthanoate\ de\ menthyle}$$
d’ou
$$\eta=\frac{\rho_{Éthanoate\ de\ menthyle}\times V_{Éthanoate\ de\ menthyle}}{x_{max}\times M_{Éthanoate\ de\ menthyle}}$$
$$\eta=\frac{0,92\times 13}{1,00.10^{-1}\times 198}=0,60=60%$$
2. Couleur du sirop : dosage du bleu patenté V
Dans de nombreux sirops commerciaux la couleur verte est obtenue en mélangeant deux colorants couramment utilisés dans l’industrie agroalimentaire : la tartrazine (E102) et le bleu patenté V (E131).
L’Autorité européenne de sécurité des aliments conseille que la consommation de bleu patenté V reste inférieure à 5 mg/kg de masse corporelle par jour pour toute catégorie de population (enfants, adultes, séniors).
http://www.efsa.europa.eu/fr/efsajournal/pub/2818
Pour déterminer le risque de dépasser cette recommandation européenne, on se propose d’effectuer un dosage du bleu patenté V dans un sirop commercial.
On prépare l’échelle de teinte suivante à partir d’une solution mère de bleu patenté V, notée S0, de concentration en masse égale à 16 mg∙L-1 :
| Solution fille | S1 | S2 | S3 | S4 |
| Concentration en masse | 12 mg∙L-1 | 10 mg∙L-1 | 8,0 mg∙L-1 | 4,0 mg∙L-1 |
On mesure l’absorbance de chaque solution à la longueur d’onde 630 nm où seul le bleu patenté V absorbe. Après modélisation, on obtient le graphique représentant l’absorbance A en fonction de la concentration en masse Cm en mg∙L-1 :
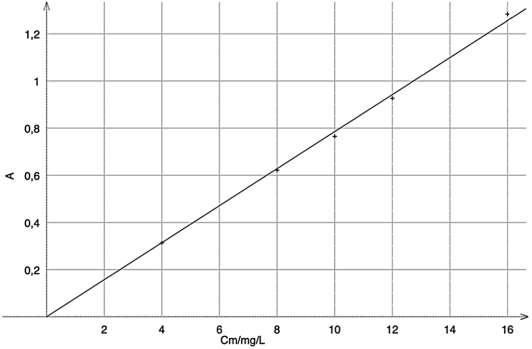
Le fabricant de sirop conseille de diluer 7 fois le sirop (on ajoute de l’eau au sirop jusqu’à obtenir un volume 7 fois plus important que le volume du sirop pur) pour une dégustation optimale. La mesure de l’absorbance à 630 nm du sirop dilué 7 fois est égale à A = 0,512.
2.1. En déduire la concentration en masse en bleu patenté V du sirop dilué.
La courbe est une droite passant par l’origine, ainsi A=KC
Calculons le coefficient directeur :
$$K=\frac{A_B-A_A}{C_B-C_A}$$
Avec les points A(0 ;0) et B(16;1,25)
$$K=\frac{1,25-0}{16-0}=0,0781\ L.mg^{-1}$$
Ainsi
A=0,0781C
Trouvons C pour notre sirop dilué :
C=A/0,0781
C=0,512/0,0781=6,6 mg.L-1
2.2. Pour une personne de 60 kg, déterminer le volume maximal de sirop dilué qu’elle peut ingérer en suivant la recommandation de l’Autorité européenne de sécurité. Conclure.
L’Autorité européenne de sécurité des aliments conseille que la consommation de bleu patenté V reste inférieure à 5 mg/kg.
Une personne de 60 Kg peut ingérer m=60×5=300 mg
C=m/V
V=m/C
V=300/6,6=45,5 L
Il est impossible qu’une personne boive autant de sirop dilué. Ainsi le sirop de menthe ne présente pas de risque pour la santé.
