E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02702 , n°G1SPHCH02705 , n°G1SPHCH02712 et n°G1SPHCH02744
Télécharger l’exercice en PDF :
Le bleu de méthylène est une espèce chimique organique de formule brute C16H18N3SCl. A l’état pur, le bleu de méthylène se présente sous la forme d’une poudre soluble dans l’eau. Il peut être utilisé, à la fois comme colorant ou comme médicament. Son action repose sur ses propriétés oxydo-réductrices : sa forme oxydée est bleue et sa forme réduite est incolore.
Certaines propriétés du bleu de méthylène sont utilisées pour des expériences en biochimie. Par exemple, en présence de glucose le bleu de méthylène est réduit et ce dernier se transforme en une espèce non colorée.
D’autres propriétés sont utilisées en médecine. Le bleu de méthylène peut servir à colorer des bactéries pour les visualiser au microscope. Quand il entre dans le cytoplasme d’une cellule vivante, le bleu de méthylène est réduit car c’est un environnement réducteur : les cellules vivantes paraissent incolores. En revanche, des cellules mortes sont colorées en bleu car le bleu de méthylène y reste sous sa forme oxydé.
D’après www.futura-sciences.com
L’objectif de cet exercice est d’étudier une propriété du bleu de méthylène puis d’effectuer un contrôle de qualité, par dosage spectrophotométrique, d’une préparation microscopique utilisée dans le domaine de la santé.
Partie 1 : Propriétés oxydantes du bleu de méthylène
Un extrait de protocole est donné ci-dessous :
« Dans un erlenmeyer contenant une solution aqueuse de glucose, on ajoute une solution de bleu de méthylène BM+(aq). Le mélange, initialement bleu, devient progressivement incolore ».
Couples oxydant-réducteur mis en jeu :
- BM+(aq) / BMH(aq)
- RCOOH(aq) / RCHO(aq)
- le glucose est noté RCHO(aq).
- la forme oxydée du bleu de méthylène, noté BM+, est la seule espèce colorée en solution aqueuse.
1.1. Donner la définition d’un oxydant.
Oxydant : espèce capable de capter un ou plusieurs électrons.
1.2. Donner la définition d’une réduction.
Réduction : transformation chimique durant laquelle l’oxydant gagne un ou plusieurs électrons.
1.3. Écrire les demi-équations électroniques relatives aux couples du bleu de méthylène BM+(aq) / BMH(aq) et du glucose RCOOH(aq) / RCHO(aq)
$BM_{(aq)}^+ / BMH_{(aq)} \ \ \ \ : BM_{(aq)}^+ + H^+ + 2 e^- = BMH_{(aq)}$
$RCOOH_{(aq)} / RCHO_{(aq)} \ \ : RCOOH_{(aq)} + 2 H^+ + 2 e^- = RCHO_{(aq)} + H_2O_{(l)}$
1.4. En déduire l’équation de la réaction modélisant la transformation décrite dans l’extrait du protocole.
« Dans un erlenmeyer contenant une solution aqueuse de glucose RCHO(aq), on ajoute une solution de bleu de méthylène BM+(aq). Le mélange, initialement bleu, devient progressivement incolore ».
$BM_{(aq)}^+ + H^+ + 2 e^- = BMH_{(aq)}$
$RCHO_{(aq)} + H_2O_{(l)} = RCOOH_{(aq)} + 2 H^+ + 2 e^-$
$BM_{(aq)}^+ + H^+ + RCHO_{(aq)} + H_2O_{(l)} \rightarrow BMH_{(aq)} + RCOOH_{(aq)} + 2 H^+$
En simplifiant les $H^+$ présents dans les réactifs et les produits :
$BM_{(aq)}^+ + RCHO_{(aq)} + H_2O_{(l)} \rightarrow BMH_{(aq)} + RCOOH_{(aq)} + H^+$
Partie 2 : Dosage d’une solution de bleu de méthylène
Le bleu de méthylène est un colorant pour préparation microscopique utilisé essentiellement pour colorer les noyaux des cellules afin d’apprécier le nombre de cellules mortes.
Un technicien de laboratoire souhaite déterminer avec précision la concentration du colorant dans une solution S dont l’étiquette porte l’indication suivante :
« Bleu de méthylène 3,2 mmol.L-1 »
On note CS la concentration en bleu de méthylène de la solution S. Cette concentration est déterminée par une méthode spectrophotométrie.
On mesure l’évolution de l’absorbance A d’une solution de bleu de méthylène pour différentes longueurs d’onde λ.
Données :
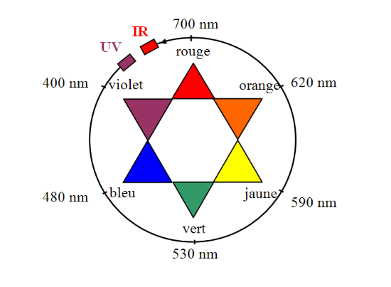
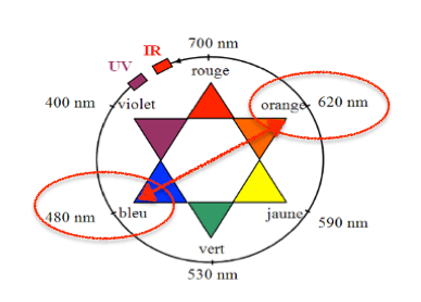
- Cercle chromatique
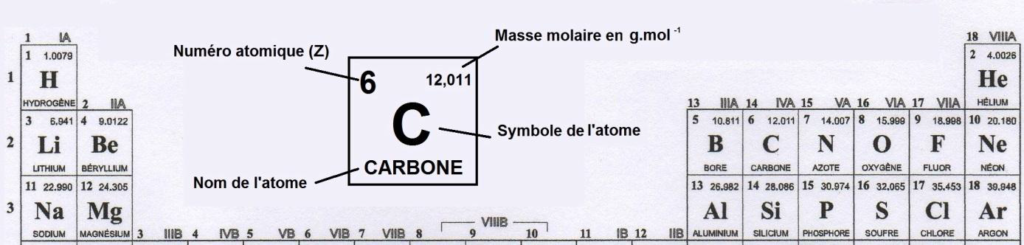
- Extrait du tableau périodique des éléments
- Spectre d’absorbance du bleu de méthylène
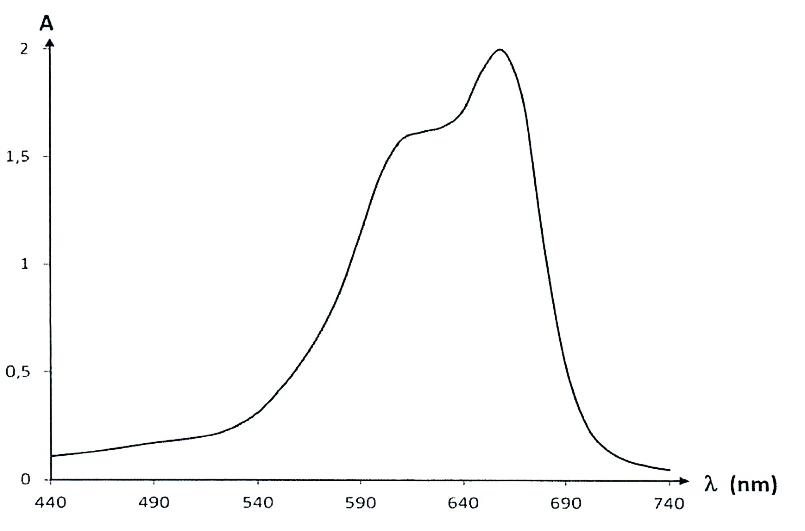
2.1. Commenter l’allure spectre d’absorption du bleu de méthylène et justifier la couleur de la solution de ce colorant.
Le bleu de méthylène absorbe principalement entre 590 nm et 680 nm.
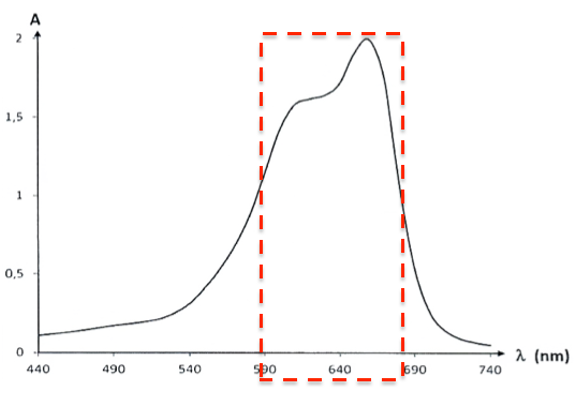
Sa couleur est la couleur complémentaire (couleur diamétralement opposée sur le cercle chromatique) : le bleu de méthylène est bleu.
Pour déterminer la concentration CS en bleu de méthylène de la solution S, on prépare une gamme de solutions notées S1 à S4, de volume 25,0 mL chacune, à partir d’une solution mère de concentration en masse égale à 5,0 mg.L-1.
L’absorbance des solutions a été mesurée à l’aide d’un spectrophotomètre préalablement réglé sur la valeur λmax du spectre d’absorption. Les résultats sont reproduits dans le tableau ci-dessous :
| Solution | S0 | S1 | S2 | S3 | S4 |
| Concentration en masse Ci (en mg.L-1) | 5,0 | 4,0 | 3,0 | 2,0 | 1,0 |
| Absorbance A | 0,610 | 0,480 | 0,374 | 0,243 | 0,126 |
2.2. Ecrire le protocole détaillé de la préparation de la solution S3 à partir de la solution mère S0, en précisant la verrerie nécessaire.
Lors d’une dilution la quantité de matière se conserve :
$n_3 = n_0$
Or
$n = C \times V$
Donc
$C_3 V_3 = C_0 V_0$
$V_0 = \frac{C_3 V_3}{C_0}$
$V_0 = \frac{2,0.10^{-3} \times 25,0.10^{-3}}{5,0.10^{-3}}$
$V_0 = 25,0.10^{-3} L = 10,0 \ mL$
Le volume fille est celui d’une fiole jaugée et le volume de la solution mère est prélevé avec une pipette jaugée.
Ainsi nous utiliserons la pipette jaugée de 10,0 mL ainsi que la fiole jaugée 25,0 mL.
Protocole :
- Verser la solution mère dans un bécher
- Prélever à l’aide d’une pipette jaugée V0=10,0 mL de la solution mère
- Introduire V0 dans une fiole jaugée 25,0 mL
- Ajouter de l’eau distillée jusqu’au trait de jauge
- Homogénéiser la solution
2.3. La loi de Beer Lambert est-elle vérifiée ? Justifier le par le calcul, sans réaliser de graphique.
1ère méthode :
On trace la courbe A=f(c)
On obtient une droite passant par l’origine : la loi de Beer Lambert est vérifiée.
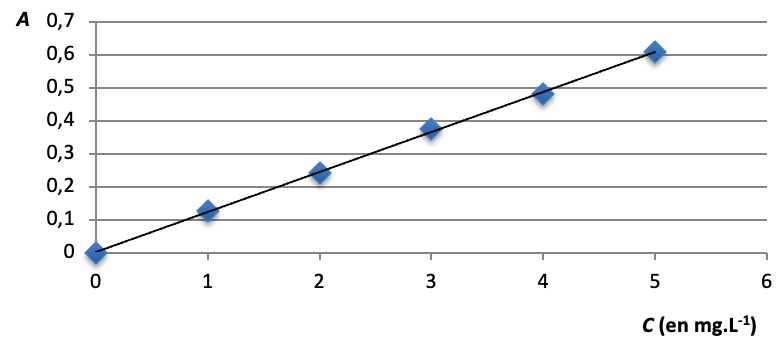
2nd méthode :
On calcule le rapport A/C pour chaque solution
| Solution | S0 | S1 | S2 | S3 | S4 |
| Concentration en masse Ci (en mg.L-1) | 5,0 | 4,0 | 3,0 | 2,0 | 1,0 |
| Absorbance A | 0,610 | 0,480 | 0,374 | 0,243 | 0,126 |
| Rapport A/C (L.mg-1) | 0,12 | 0,12 | 0,12 | 0,12 | 0,13 |
Le rapport A/C est constant, les deux valeurs sont proportionnelles : la loi de Beer Lambert est vérifiée.
2.4. En déduire une relation entre A l’absorbance de la solution et C la concentration en masse du bleu de méthylène, en précisant les unités des grandeurs.
$A = K C$
$A = 0,12 C$
Avec :
A sans unité
$K = 0,12$ L.mg$^{-1}$
$C$ en mg.L$^{-1}$
2.5. Une solution SD de bleu de méthylène a été obtenue en diluant 400 fois la solution S. La mesure de l’absorbance de la solution SD vaut AD = 0,328.
2.5.1. Déterminer la concentration CD de la solution SD.
$A = 0,12 C$
$C_D = \frac{A_D}{0,12}$
$C_D = \frac{0,328}{0,12}$
$C_D = 2,7 \ mg.L^{-1}$
2.5.2. En considérant une incertitude-type de mesure u(CS) égale à 0,2 mmol.L-1, la valeur CS obtenue expérimentalement est-elle en accord avec l’étiquetage de la solution S ? Justifier.
« Une solution $S_D$ de bleu de méthylène a été obtenue en diluant 400 fois la solution $S$ »
$C = 400 \times C_D$
$C = 400 \times 2,7.10^{-3}$
$C = 1,1 \ g.L^{-1}$
Le bleu de méthylène est une espèce chimique organique de formule brute $C_{16}H_{18}N_3SCl$.
$C = \frac{C_D}{M}$
$C = \frac{C_D}{(16 \times M_C + 18 \times M_H + 3 \times M_N + M_S + M_{Cl})}$
$C = \frac{1,1}{(16 \times 12,011 + 18 \times 1,0079 + 3 \times 14,007 + 32,065 + 35,453)}$
$C = 3,4.10^{-3} \ mol.L^{-1}$
$u(C_S)$ égale à $0,2$ mmol.L$^{-1}$
$3,4.10^{-3} – 0,2.10^{-3} < C < 3,4.10^{-3} + 0,2.10^{-3}$
$3,2.10^{-3} \ mol.L^{-1} < C < 3,6.10^{-3} \ mol.L^{-1}$
L’étiquette porte l’indication suivante : « Bleu de méthylène 3,2 mmol.L$^{-1}$ »
La valeur $C_S$ obtenue expérimentalement est en accord avec l’étiquetage de la solution $S$ car la valeur théorique est comprise dans l’intervalle des valeurs expérimentales.
