E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02730 , n°G1SPHCH02758 et n°G1SPHCH02781
Télécharger l’exercice en PDF :
Le vert malachite est une espèce chimique organique artificielle. Son nom évoque la malachite, qui est une roche dont la couleur bleu-vert est proche de celle de cette espèce chimique. Le vert malachite est utilisé comme indicateur coloré mais aussi dans le traitement d’infections bactériennes des poissons en pisciculture et en aquariophilie.

Cet exercice a pour objectif d’étudier :
- la synthèse du vert malachite ;
- certaines précautions d’utilisation du vert malachite en aquariophilie.
Données
Caractéristiques du vert malachite :
- formule brute : C23H25N2Cl ; masse molaire M = 364,0 g·mol–1
Table simplifiée en spectroscopie infrarouge :
| Liaison | Nombre d’onde (cm-1) | Intensité |
|---|---|---|
| O-H libre | 3650 - 3580 | Bande forte et fine |
| O-H liée (pont hydrogène) | 3100 -3500 | Bande forte et large |
| O-H (acide carboxylique) | 2500 - 3300 | Bande forte et large |
| Ctri-H (Ctri : carbone trivalent) | 3000 - 3100 | Bande moyenne |
| Ctet-H (Ctet : carbone tétravalent) | 2800 - 3000 | Bande forte |
| C-H de CHO (aldéhyde) | 2650 - 2900 | Bande moyenne, parfois 2 bandes |
| C=O (aldéhyde, cétone) | 1650 -1730 | Bande forte |
| C=O (acide carboxylique) | 1690 - 1760 | Bande forte |
| C=C | 1625 - 1685 | Bande moyenne |
| Ctet-H | 1415 - 1470 | Bande forte |
Liaison carbone-carbone d’un cycle benzénique : 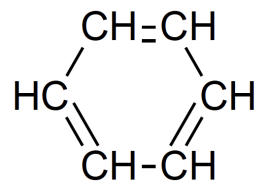 | 1450-1600 | Variable, 3 à 4 bandes |
1. Synthèse du vert malachite
La première étape de la synthèse du vert malachite au laboratoire consiste à chauffer à reflux pendant 10 minutes, le mélange suivant : 4,0 mL de benzaldéhyde, 4,0 mL de diméthylaniline, 3 g de chlorure de zinc et quelques grains de pierre ponce.
1.1. Choisir, parmi les montages suivants, celui qui permet de réaliser un chauffage à reflux.
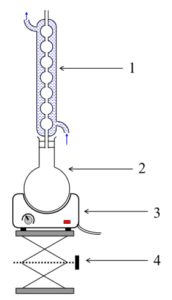 | 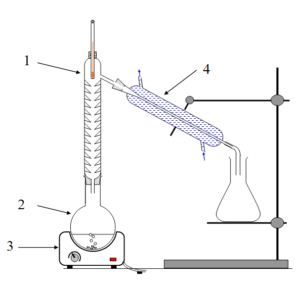 |  |
|---|---|---|
| A | B | C |
Schéma A
1.2. Légender le schéma du montage choisi à la question précédente, en reportant sur votre copie les numéros du schéma.
1 : Réfrigérant
2 : Ballon
3 : Chauffe ballon
4 : Support élévateur
Un des réactifs de la synthèse est le benzaldéhyde. Le benzaldéhyde est susceptible de s’oxyder à l’air en acide benzoïque lorsque le flacon est ouvert ; la transformation est représentée ci-dessous. Il convient donc de vérifier la pureté du benzaldéhyde avant de l’utiliser comme réactif.
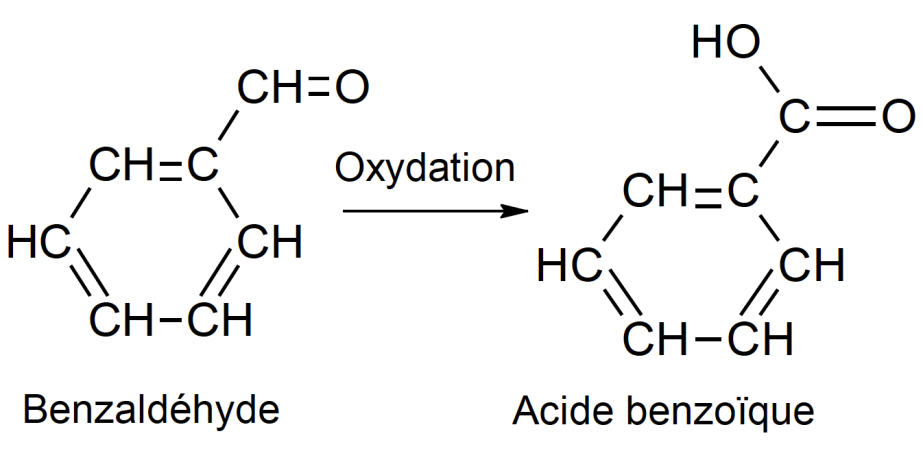
1.3. Reproduire sur votre copie les formules du benzaldéhyde et de l’acide benzoïque, puis pour chacune entourer le groupe caractéristique et l’associer à une famille de composés.
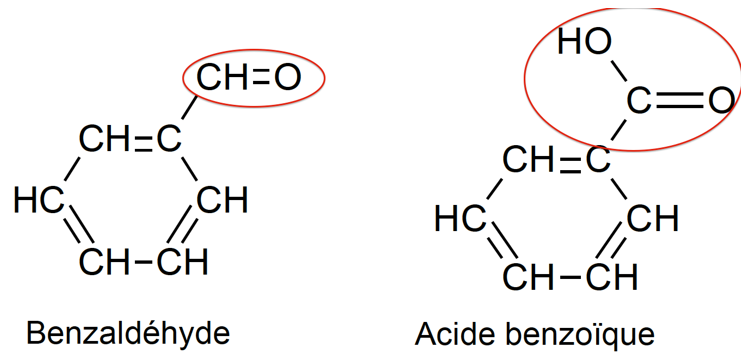
Benzaldéhyde : Famille aldéhyde
Acide benzoïque : Famille acide carboxylique
1.4. Après avoir défini une oxydation, justifier que le passage du benzaldéhyde à l’acide benzoïque est une oxydation.
Oxydation : perte d’électron
Benzaldéhyde : C7OH6
Acide benzoïque : C7O2H6
C7OH6 +H2O= C7O2H6+2H++2e–
Le passage du benzaldéhyde à l’acide benzoïque est une oxydation car il y a une perte d’électrons.
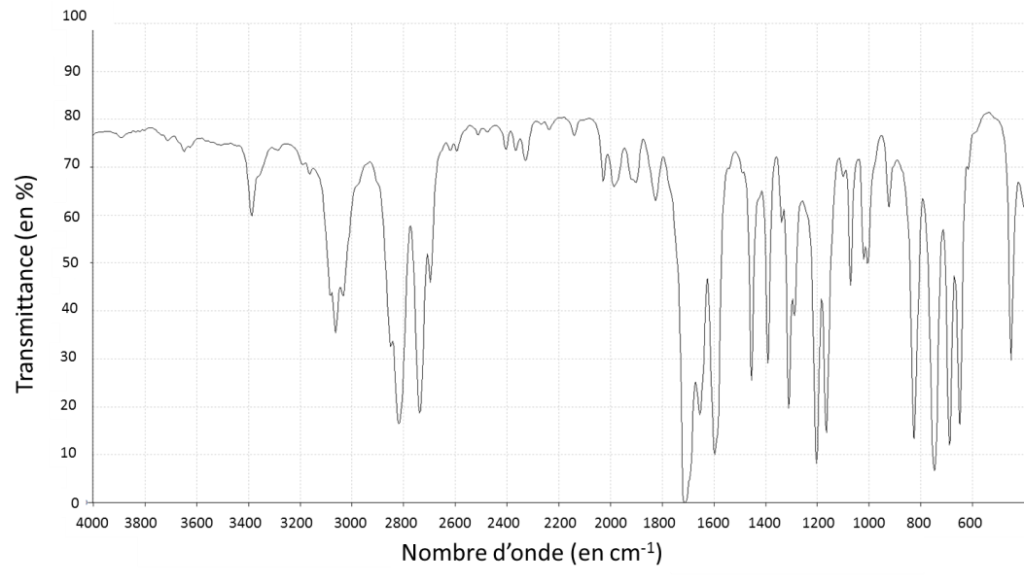
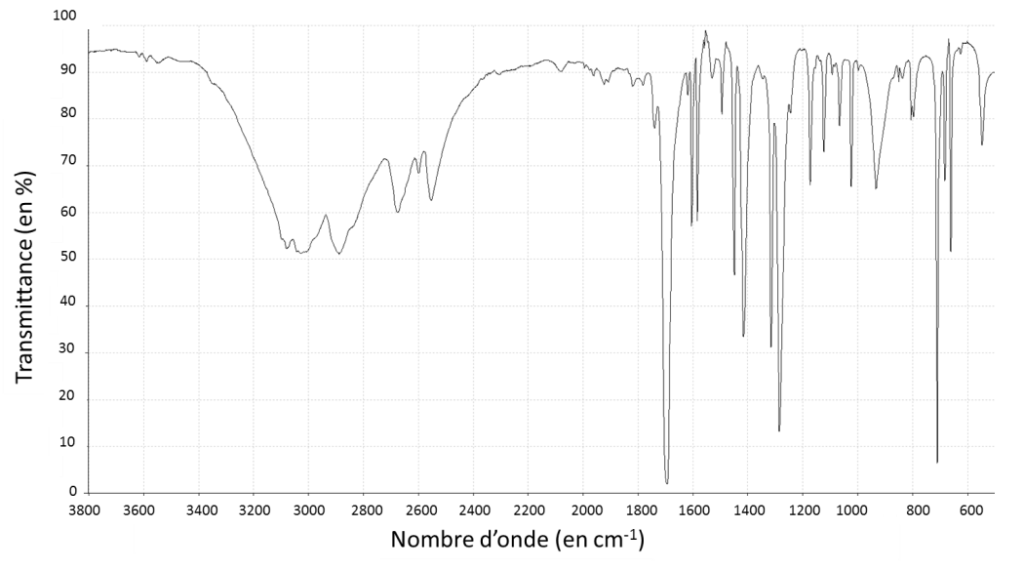
1.5. Associer à chacune des deux molécules (benzaldéhyde et acide benzoïque) l’un des spectres infrarouge reproduits ci-après en expliquant la démarche suivie.
Benzaldéhyde : Famille aldéhyde C=O Nombre d’onde 1650 -1730 – Bande forte
Acide benzoïque : Famille acide carboxylique C=O Nombre d’onde 1690 – 1760 Bande forte et O-H (acide carboxylique) Nombre d’onde 2500 – 3300 Bande forte et large
La différence entre les deux est la liaison O-H (acide carboxylique) avec un Nombre d’onde 2500 – 3300 Bande forte et large
Benzaldéhyde : Spectre 1
Acide benzoïque : Spectre 2
Pour vérifier la pureté du benzaldéhyde dans le flacon entamé, il est possible de mettre en œuvre une chromatographie sur couche mince (CCM).
1.6. Indiquer les dépôts qui pourraient être effectués sur la plaque de chromatographie pour effectuer cette analyse et l’allure du chromatogramme obtenu si le benzaldéhyde est pur ou s’il est partiellement oxydé.
| Cas A benzaldéhyde partiellement oxydé | Cas B benzaldéhyde pur |
 |  |
1 benzaldéhyde pur 2 Acide benzoïque pur 3 Produit | 1 benzaldéhyde pur 2 Acide benzoïque pur 3 Produit |
2. Utilisation du vert malachite en aquariophilie
Le vert malachite peut être utilisé comme traitement contre la maladie des « points blancs » contractée par les poissons dans les bassins d’eau douce, mais il est nécessaire d’éliminer le surplus de vert malachite à la fin du traitement en utilisant du charbon actif. Pour cela, une analyse de l’eau du bassin est réalisée pour déterminer la concentration restante en vert de malachite. Un extrait du cahier de laboratoire du technicien responsable du bassin est fourni ci-après.
2.1. Déterminer la valeur de la concentration en quantité de matière apportée de vert malachite, de la solution aqueuse fabriquée par le technicien dans l’étape 1.
$c=\frac{n}{V}$
Or $n=\frac{m}{M}$
Donc
$c=\frac{m}{M\times V}=\frac{1,8.10^{-3}}{364,0\times500.10^{-3}}=9,9.10^{-6}\ mol.L^{-1}$
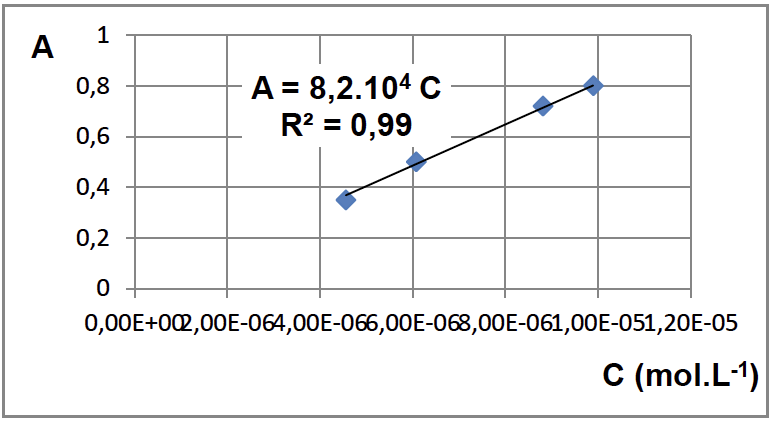
2.2. Déterminer si la modélisation effectuée à l’étape 3est en accord avec la loi de Beer-Lambert dont l’énoncé est attendu, ainsi que le nom des grandeurs et des unités.
A = 8,2.104 C
Donc A=KC c’est une droite qui passe par l’origine, c’est en accord avec la loi de Beer-Lambert
Avec :
- A l’absorbance
- 8,2.104 le coefficient directeur
- C la concentration molaire
Le volume du bassin est Vbassin = 1,2 × 104 L. On considère ici que 1,0 g de charbon actif peut piéger au maximum 10 mg de vert de malachite.
2.3. Déterminer le nombre de sacs de charbon actif de 500 g que doit utiliser le technicien pour éliminer le vert de malachite restant dans l’eau du bassin.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti.
Extrait du cahier de laboratoire du technicien
Étape 1 : J’ai préparé un volume V = 500 mL d’une solution aqueuse à partir d’une masse m = 1,8 mg de vert malachite solide. C’est la solution mère.
Étape 2 : J’ai réalisé le spectre de la solution mère pour pouvoir déterminer la longueur d’onde à choisir pour les mesures suivantes. J’ai obtenu :
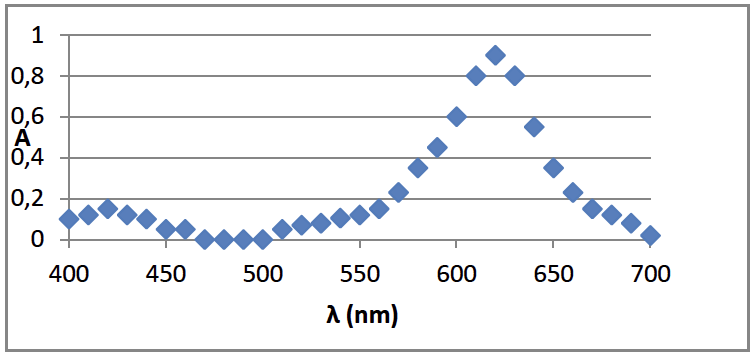
Je choisis la longueur d’onde de travail pour la suite : 625 nm.
Étape 3 : Par dilution de la solution mère j’ai préparé une gamme étalon de quatre solutions dont j’ai mesuré l’absorbance A. J’obtiens le graphe suivant :
Étape 4 : J’ai mesuré l’absorbance de l’eau du bassin à la même longueur d’onde que les mesures précédentes. J’ai trouvé Aeau-bassin = 0,67
$A_{eau-bassin} = 0,67$
Trouvons $C$ :
$C = \frac{A}{8,2.10^4}= \frac{0,67}{8,2.10^4}=8,2.10^{-6}\ mol.L^{-1}$
On considère ici que 1,0 g de charbon actif peut piéger au maximum 10 mg de vert de malachite.
Trouvons la masse de vert de malachite.
$n=\frac{m}{M}$
$m=n\times M$
Or
$c=\frac{n}{V}$ , donc $n=C\times V$
d’ou $m=C\times V\times M$
$m=8,2.10^{-6}\times1,2.10^4\times364,0=36\ g$
| charbon actif | 1,0 g | x |
| vert de malachite | 10 mg | 36 g |
$x=\frac{1,0\times36}{10.10^{-3}}=3600\ g$
Or 1 sac de charbon actif est de 500 g
| sac | 1 | x |
| masse | 500 g | 3600 g |
$x=\frac{1\times3600}{500}=7,2\ sacs$
