E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02724, n°G1SPHCH02729 et n°G1SPHCH02779
Télécharger l’exercice en PDF :
L’activité des établissements de santé et médico-sociaux génère divers types de déchets (déchets ménagers, déchets à risque infectieux ou radioactif, déchets issus de médicaments, etc) relevant ou non d’activités spécifiques liées aux soins. Ces établissements se sont intéressés dans un premier temps à la gestion des déchets solides, mais, depuis plusieurs années, la prise en charge des déchets liquides est devenue une préoccupation vis-à-vis de la prévention des risques et du développement durable.

La Bétadine est un antiseptique local très utilisé dans les établissements de santé et médico-sociaux qui se périme rapidement après son ouverture. Ce médicament est constitué d’une solution aqueuse de diiode, soluté toxique pour les organismes aquatiques.
Extrait de données figurant sur un flacon de Bétadine®

- Substance active : diiode
- Excipients : glycérol, macrogoléther laurique, phosphate disodique dihydraté, acide citrique monohydraté, hydroxyde de sodium, eau purifiée
- Densité : d = 1,01
Cet exercice s’intéresse à l’extraction du diiode pour envisager ensuite son rejet ou son recyclage.
Données :
Masse molaire du diiode: M = 254 g.mol–1
Chlore : numéro atomique : Z = 17 ; configuration électronique : (1s)2(2s)2(2p)6(3s)2(3p)5
Caractéristiques physico-chimiques de quelques solvants :
| eau | éthanol | cyclohexane | |
| Masse volumique (en kg.L-1) à la température de l’expérience | 1,0 | 0,80 | 0,78 |
| Solubilité du diiode | peu soluble | très soluble | soluble |
| Miscibilité avec l’eau | miscible | miscible | non miscible |
| Température d’ébullition (en °C) à P = 1 bar | 100 | 78 | 81 |
| Pictogrammes de sécurité |  |
Électronégativité de quelques atomes selon l’échelle de Pauling :
| Atome | H | O | C | I |
| Électronégativité | 2,2 | 3,4 | 2,5 | 2,7 |
1. Extraction liquide-liquide du diiode
1.1. Justifier, à l’aide de deux arguments, le choix du solvant à utiliser pour extraire le diiode contenu dans la solution de Bétadine®.
Pour faire une extraction par solvant :
Le solvant choisi doit être non miscible avec le solvant initial
La molécule à extraire doit être plus soluble dans le solvant choisi que dans le solvant initial
Le diode se trouve dans une solution aqueuse (l’eau est le solvant).
Nous choisissons le cyclohexane car :
il est non miscible à l’eau
le diode est soluble dans le cyclohexane alors qu’il est peu soluble dans l’eau.
1.2. Le schéma de Lewis de la molécule de diiode est le même que celui du dichlore. Représenter ce schéma de Lewis.
Chlore : numéro atomique : Z = 17 ; configuration électronique : (1s)2(2s)2(2p)6(3s)2(3p)5
Le chlore à 7 électrons de valence, il fait donc une liaison et possède 3 doublets non liants.
Dichlore :
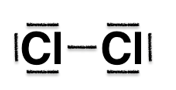
Le schéma de Lewis de la molécule de diiode est le même que celui du dichlore.
Diiode :

1.3. La molécule de diiode I2 est-elle polaire ? En déduire une propriété du solvant choisi précédemment.
La molécule de diiode I2 est apolaire car les deux atomes possèdent la même électronégativité.
Le solvant choisi (le cyclohexane) est donc apolaire.
1.4. On utilise 20 mL de ce solvant pour extraire le diiode de 10 mL de solution de Bétadine®. Quelle est la masse de solvant d’extraction utilisé ?
$\rho=\frac{m}{V}$
$m=\rho\times V$
$m=0,78.10^3\times20.10^{-3}=15,6\ g$
1.5. Schématiser les étapes du protocole expérimental d’extraction liquide-liquide simple du diiode de 10 mL de solution de Bétadine® en tenant compte des risques liés à l’utilisation du solvant choisi. Légender en précisant les contenus des différentes phases.
Le cyclohexane est moins dense que l’eau, il se trouve au-dessus.
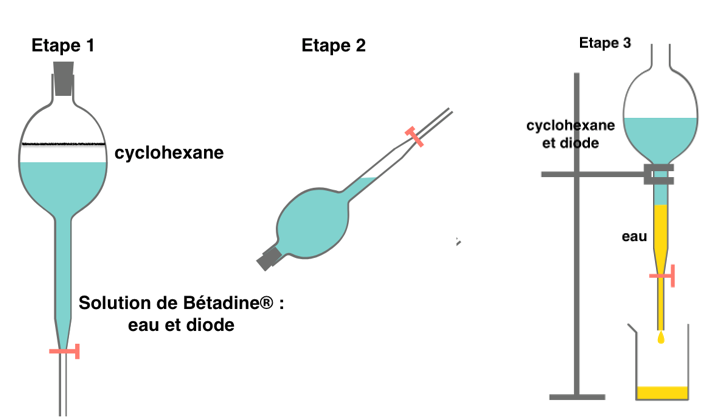
Le solvant choisi est cancérogène il faut donc procéder à l’extraction sous hotte aspirante.
Le solvant choisi est dangereux pour l’environnement, il faut donc ne rien jeter à levier.
2. Comparaison de deux protocoles d’extraction du diiode d’une solution aqueuse
On souhaite à présent comparer l’efficacité de deux méthodes d’extraction du diiode d’une solution aqueuse, dont le principe est décrit ci-dessous. Toutefois la solution aqueuse de diiode étant très concentrée, on la dilue 10 fois, on obtient alors une solution S’.
- Méthode 1 : extraction simple
On procède à une extraction simple en utilisant un volume VS = 20 mL de solvant pour 10 mL de solution de S’.
- Méthode 2 : extraction multiple
On procède à une première extraction en utilisant un volume VS1 = 10 mL de solvant pour 10 mL de solution de S’. On récupère la phase aqueuse dans un bécher et on réalise une nouvelle extraction avec à nouveau VS2 = 10 mL de solvant.
Données :
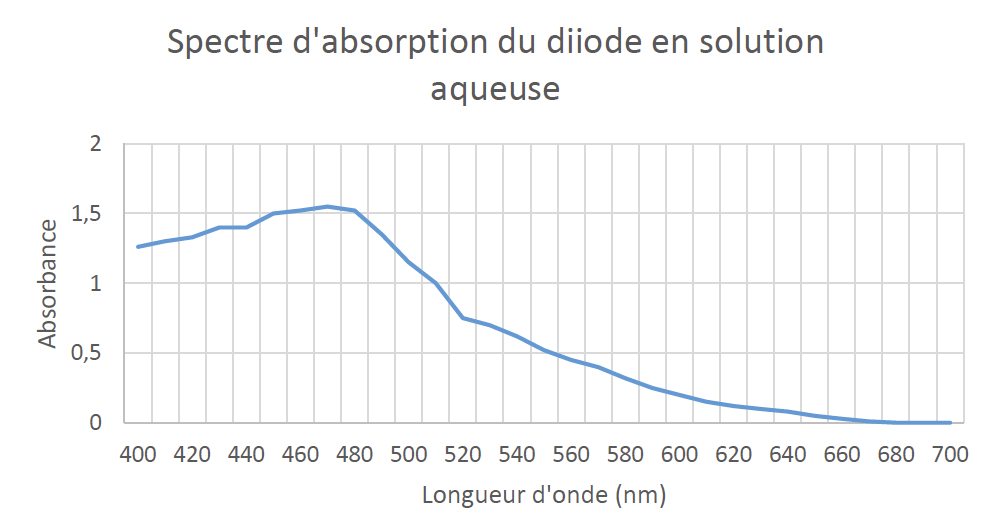
Spectre d’absorption du diiode :
Cercle chromatique :
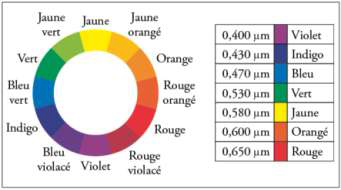
2.1. Déterminer la couleur de la solution aqueuse de diiode.
$\lambda_{max}=470\ nm$
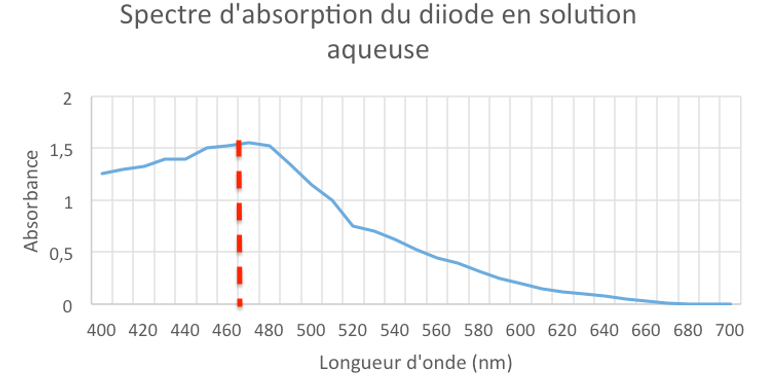
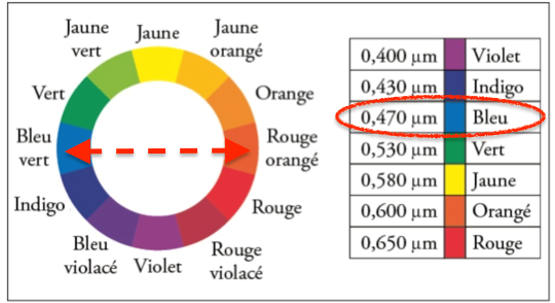
La couleur de la solution est la couleur complémentaire de la couleur absorbée. La couleur complémentaire est la couleur diamétralement opposée sur le cercle chromatique.
La solution de diode absorbe dans le bleu, elle est donc rouge orangé.
2.2. A quelle longueur d’onde faut-il régler le spectrophotomètre, pour mesurer l’absorbance des solutions de diiode ? Justifier.

Le spectrophotomètre est réglé, non pas sur la longueur d’onde trouvée précédemment mais à une longueur d’onde λ = 600 nm :ce choix exceptionnel permet de ne pas dépasserles limites de mesure du spectrophotomètre. On trace l’évolution de l’absorbance du diiode en solution aqueuse en fonction de sa concentration en quantité de matière ; le graphe représentant cette évolution est figure ci-après. Puis, on mesure les absorbances des phases aqueuse finales obtenues à l’issue des deux méthodes d’extraction.
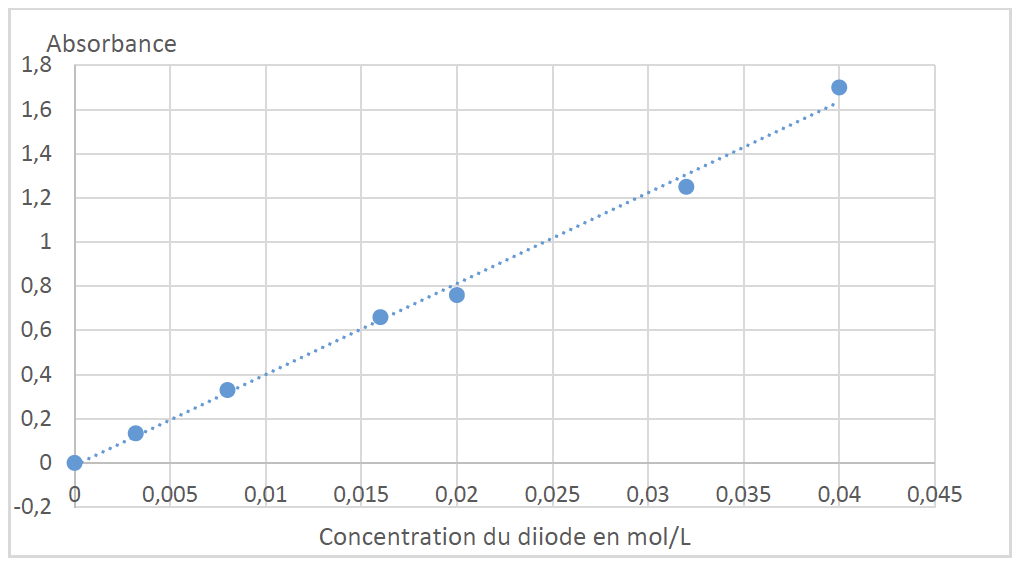
2.3. Quelle est la loi vérifiée à l’aide de la courbe représentant l’évolution de l’absorbance avec la concentration ?
$A=f(C)$ est une droite passant par l’origine. A et c sont proportionnel : $A=K\times C$
La loi de Beer-Lambert est vérifiée.
2.4. Quel type de dosage permet-elle d’envisager ?
Cette courbe permet d’envisager un dosage spectrophotométrique par étalonnage.
2.5. La mesure de l’absorbance de la phase aqueuse finale, obtenue à l’issue des deux méthodes d’extraction donne pour la méthode 1, A1 = 0,65 et pour la méthode 2, A2 = 0,50.
Comparer l’efficacité des deux méthodes d’extraction.
A1> A2 donc C1> C2. On dose ici la concentration de diiode restante dans la solution aqueuse après extraction.
Il reste plus de diiode avec la 1ere méthode.
Ainsi la méthode 2 est plus efficace.
2.6. La fiche de sécurité du diiode indique que la concentration maximale d’une solution aqueuse de diiode pour qu’elle soit sans effet sur l’environnement est de 11 mg/L. Peut-on rejeter la phase aqueuse à l’évier à l’issue d’une des deux méthodes d’extraction ? Commenter.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti.
La lecture graphique n’étant pas évidente, trouvons le coefficient directeur :
$k=\frac{A_B-A_A}{C_B-C_B}$
$k=\frac{1,6-0}{0,04-0}=40\ L.mol^{-1}$
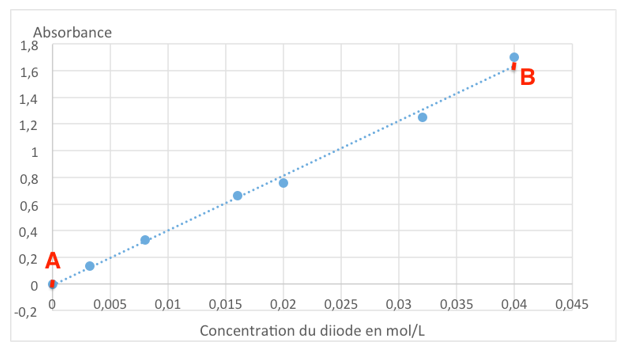
Calculons $C_1$ et $C_2$.
$A=K\times C$
$C=\frac{A}{K}$
$C_1=\frac{0,65}{40}=1,63.10^{-2}\ mol.L^{-1}$
$C_2=\frac{0,50}{40}=1,25.10^{-2}\ mol.L^{-1}$
Calculons $C_{m1}$ et $C_{m2}$ ; les concentrations massiques.
$C_m=C\times M_{I_2}$
$C_{m1}=C_1\times M_{I_2}=1,63.10^{-2}\times254=4,14\ g.L^{-1}$
$C_{m1}=C_1\times M_{I_2}=1,25.10^{-2}\times254=3,18\ g.L^{-1}$
Quel que soit la méthode employée, la concentration est supérieure à la concentration maximale de 11 mg/L d’une solution aqueuse de diiode pour qu’elle soit sans effet sur l’environnement.
Il ne faut donc pas rejeter la phase aqueuse à l’évier à l’issue de l’extraction.
