E3C2 – 10 points – Durée 1h – calculatrice autorisée
L’allantoïne est un composé chimique azoté, de formule brute C4H6N4O3, découvert par Louis-Nicolas Vauquelin. On le trouve en particulier dans l’urine de veau ou la bave d’escargot, cependant aujourd’hui, il est synthétisé à grande échelle à partir de l’acide glyoxylique C2H2O3 et de l’urée CH4N2O pour l’utiliser dans l’industrie cosmétique, car ce composé possède des propriétés adoucissantes et apaisantes. On le trouve principalement dans les produits de soins de la peau et les produits de maquillage, mais aussi dans les dentifrices, shampoings, crèmes à raser, rouges à lèvres, etc.
D’après https://fr.wikipedia.org/wiki/Allantoïne
L’objectif de l’exercice est d’étudier l’acide glyoxylique et l’urée, puis un protocole de synthèse de l’allantoïne au laboratoire.
Données
Données physiques de quelques espèces chimiques
| Espèce chimique | Masse molaire (g/mol) | Température de fusion (°C) | Solubilité dans l’eau |
| Urée | 60,0 | 134 | Très soluble : 1360 g/L à 20°C |
| Acide glyoxylique | 74,0 | 98 | Très soluble |
| Allantoïne | 158,1 | 238 | Peu soluble, 150 g/L si eau bouillante 5 g/L si eau très froide |
| Acide sulfurique | 98,1 | 734 | Très soluble |
Données de spectroscopie infrarouge
| Liaison | Nombre d’onde (cm-1) | Intensité |
| Liaison C – NH2 | 3100 – 3500 | Bande double forte |
| Liaison C – NH | 3100 – 3500 | Bande simple forte |
| Liaison O – H acide carboxylique | 2500-3200 | Bande forte à moyenne, large |
| Liaison C – H | 2800-3000 | Bande forte |
| Liaison C = O avec N voisin | 1660 – 1685 | Bande forte et fine |
| Liaison C = O aldéhyde et cétone | 1650-1730 | Bande forte et fine |
| Liaison C = O acide carboxylique | 1680-1710 | Bande forte et fine |
| Liaison C = C | 1640-1680 | Bande moyenne |
Masse volumique de la solution d’acide glyoxylique à 50 % en masse : ρ = 1,3 g.mL-1
Valeurs d’électronégativité de quelques atomes :
| χ(H) = 2,20 | χ(C) = 2,55 | χ(N) = 3,04 | χ(O) = 3,44 |
Numéros atomiques de quelques éléments :
| Z(H) = 1 | Z(C) = 6 | Z(N) = 7 | Z(O) = 8 |
1. À propos de l’acide glyoxylique.
L’acide glyoxylique est un solide, très utilisé dans l’industrie, de formule semi-développée :
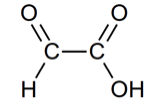
1.1. Recopier sur la copie la formule semi-développée de la molécule d’acide glyoxylique et identifier les groupes caractéristiques qui la composent.
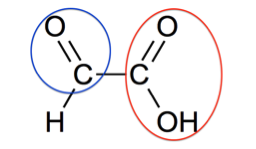
Groupe Carbonyle
Groupe Carboxyle
1.2. Représenter le schéma de Lewis de la molécule.
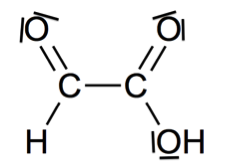
Chacun des atomes de carbone fait une liaison double et deux liaisons simples : géométrie triangulaire plane
1.3. Donner, en justifiant, la géométrie de cette molécule autour de l’un ou l’autre des atomes de carbone.
Chacun des atomes de carbone fait une liaison double et deux liaisons simples : géométrie triangulaire plane
2. A propos de l’ammoniac et urée
L’urée est un composé organique de formule chimique semi-développée : H2N – CO – NH2
L’urée naturelle fut découverte en 1773 par le pharmacien Hilaire Rouelle. Formée dans le foie, à partir de l’ammoniac, NH3, provenant de la dégradation d’acides aminés, l’urée naturelle est éliminée au niveau des reins par l’urine.
En 1828, le chimiste allemand Friedrich Wöhler réussit à synthétiser en laboratoire l’urée, molécule dite « organique » à l’époque, à partir d’ammoniac. On considérait avant cette synthèse que les molécules « organiques » ne pouvaient provenir que de constituants ou de dérivés d’organismes vivants habités par la « force vitale » (vis vitalis). Cette date, gravée dans l’histoire, est retenue comme étant celle fondatrice de la chimie organique.
D’après http://www.societechimiquedefrance.fr/uree.html
2.1. Donner la configuration électronique de l’azote N et de l’hydrogène H. En déduire la géométrie de la molécule d’ammoniac.
1H : 1s1
7N : 1s2 2s2 2p3
Pour respecter la règle de l’octet (8 électrons sur sa dernière couche), l’atome d’azote fait 3 liaisons et possède un doublet non liant.
Ainsi la géométrie de la molécule d’ammoniac sera pyramidale
2.2. Justifier le caractère polaire de la molécule d’ammoniac.
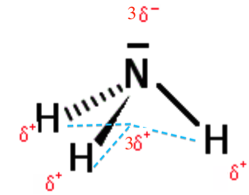
χN> χH Les liaisons NH sont polarisés.
Le barycentre (centre géométrique) des charges positives G+ est différent du barycentre des charges négatives G- du fait de la géométrie de la molécule.
La molécule est donc polaire
2.3. On s’intéresse au spectre Infrarouge de l’urée.
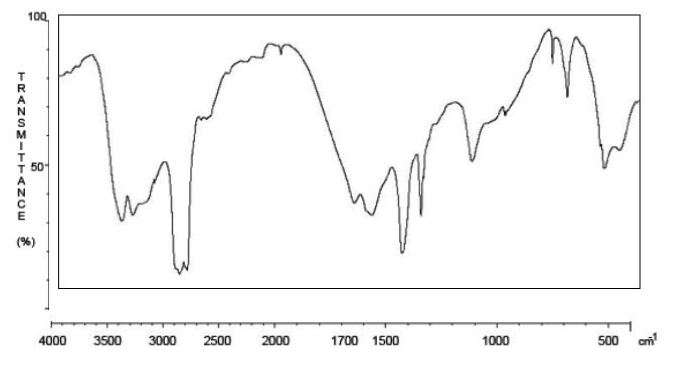
2.3.1. Nommer la grandeur qui figure en abscisse du spectre Infrarouge.
La grandeur qui figure en abscisse est le nombre d’onde σ
2.3.2. Que confirme la bande la plus à gauche du spectre ?
La bande la plus à gauche du spectre est comprise entre 3200 et 3500 cm-1, il s’agit d’une bande double forte.
D’après le tableau des données de spectroscopie infrarouge, la bande confirme une liaison C–NH2
2.3.3. Repérer la bande du spectre qui confirme la présence d’une liaison C = O. Peut-elle être attribuée sans ambiguïté à la liaison C=O de l’urée ? Justifier.
D’après le tableau des données de spectroscopie infrarouge, pour une liaison C = O avec N voisin σ est compris entre 1660 – 1685 cm-1 avec une bande forte et fine.
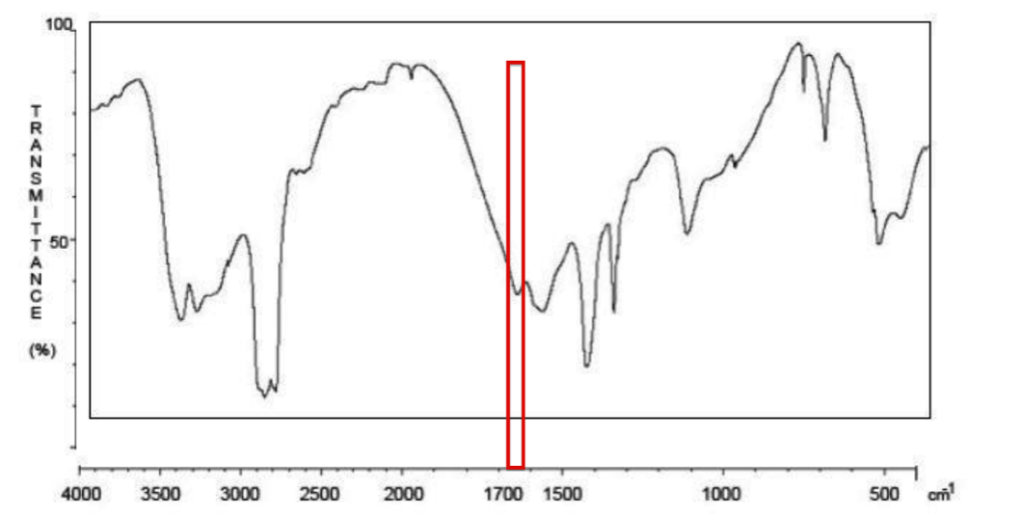
D’après le tableau des données de spectroscopie infrarouge, plusieurs liaisons peuvent être envisagées pour ce nombre d’onde.
| Liaison | Nombre d’onde (cm-1) | Intensité |
| Liaison C = O avec N voisin | 1660 – 1685 | Bande forte et fine |
| Liaison C = O aldéhyde et cétone | 1650-1730 | Bande forte et fine |
| Liaison C = O acide carboxylique | 1680-1710 | Bande forte et fine |
| Liaison C = C | 1640-1680 | Bande moyenne |
Il peut s’agir d’une autre liaison.
Ainsi cette bande du spectre ne peut être attribuée sans ambiguïté à la liaison C=O de l’urée.
3. Synthèse de l’allantoïne
Une voie de synthèse de l’allantoïne s’effectue à partir d’urée et d’acide glyoxylique et peut être modélisée par une réaction chimique d’équation suivante :
2CH4N2O(s) +C2H2O3(aq) → C4H6N4O3(s)+2H2O(l)
Le protocole expérimental d’une synthèse de l’allantoïne, réalisée au laboratoire, est décrit ci-après :
a. Placer un barreau aimanté dans un erlenmeyer de 100 mL puis, à l’aide d’un entonnoir à solide, verser 13,6 g d’urée et 10,0 mL de solution aqueuse d’acide glyoxylique à 50% en masse. Agiter jusqu’à l’obtention d’une solution limpide. Introduire lentement 1,5 mL d’acide sulfurique concentré, sous agitation magnétique. L’acide sulfurique a pour rôle d’accélérer la réaction. Adapter un réfrigérant ascendant.
b. Placer l’erlenmeyer dans un bain-marie. Maintenir l’agitation, le chauffage et l’ébullition de l’eau du bain-marie pendant 45 minutes. Le milieu réactionnel se trouble au bout de 15 à 20 minutes avec l’apparition d’un précipité blanchâtre.
c. Plonger ensuite le bécher dans de la glace pendant quelques minutes. Récupérer le solide à l’aide d’un dispositif de filtration sous vide de type Büchner.
d. Laver avec suffisamment d’eau glacée. Sécher à l’étuve le temps nécessaire.
e. Peser le solide obtenu.
3.1. Associer aux différentes étapes (a, b, c, d, e) mises en oeuvre les différentes étapes d’un protocole de synthèse : transformation ; séparation, purification, analyse.
a : transformation
b : transformation
c : séparation
d : purification
e : analyse
3.2. Préciser et expliquer l’apparition progressive du précipité blanchâtre.
Il s’agit de la synthèse de l’allantoïne. D’après les données, l’allantoïne est soluble dans l’eau bouillante (150 g/L). Ainsi l’allantoïne est présente dans le milieu réactionnel sous forme dissoute jusqu’à ce que sa concentration atteigne 150g/L. c’est pourquoi le précipité blanchâtre n’apparaît que progressivement et au bout d’un certain temps.
3.3. Justifier l’utilisation de la glace dans l’étape c.
D’après les données, la solubilité de l’allantoïne dans l’eau : 150 g/L si eau bouillante et 5 g/L si eau très froide. Ainsi sa solubilité dans l’eau diminue lorsque la température diminue.
L’utilisation de la glace permet de rendre solide l’allantoïne et permet sa séparation et récupération.
3.4.Justifier l’intérêt de laver à l’étape d du protocole, le solide obtenu avec suffisamment d’eau glacée.
Lors de la synthèse, l’allantoïne est formée. Cependant, il reste des réactifs dans le milieu réactionnel et l’acide sulfurique (catalyseur). Il faut donc purifier le produit en le lavant avec de l’eau glacée.
L’eau est glacée afin de minimiser la dissolution de l’allantoïne.
3.5. Déterminer le rendement de la synthèse ainsi effectuée, sachant que la masse d’allantoïne sèche obtenue vaut m = 8,60 g.
Déterminons les quantités de matière initiales des réactifs :
![]()
![]()
Pourcentage massique de l’acide glyoxylique
![]()
d’ou :
![]()
Ainsi
![Rendered by QuickLaTeX.com \[n_{acide\ glyoxylique}^i=\frac{P\times{m_{solution}}}{M_{acide\ glyoxylique}}\]](https://physik.fr/wp-content/ql-cache/quicklatex.com-e0e3867fc096e2ef88c0c6aa3eb973ca_l3.png)
La masse volumique est définie par :
![]()
d’ou :
![]()
Ainsi
![Rendered by QuickLaTeX.com \[n_{acide\ glyoxylique}^i=\frac{P\times{\rho_{solution}\times{V_{solution}}}}{M_{acide\ glyoxylique}}\]](https://physik.fr/wp-content/ql-cache/quicklatex.com-4c713b16b8877509cd9053c2799bba69_l3.png)
![Rendered by QuickLaTeX.com \[n_{acide\ glyoxylique}^i=\frac{\frac{50}{100}\times 1,3\times 10,0}{74,0}=8,8.10^{-2}mol\]](https://physik.fr/wp-content/ql-cache/quicklatex.com-ae387b86e2cb667899d1f75aa2de8e16_l3.png)
| 2CH4N2O(s) | +C2H2O3(aq) | → C4H6N4O3(s) | +2H2O(l) | ||
| Etat initial | x=0mol | 2,27.10-1 | 8,8.10-2 | 0 | Solvant |
| Etat intermédiaire | x | 2,27.10-1-2x | 8,8.10-2-x | x | Solvant |
| Etat final | x=xf | 2,27.10-1-2xf | 8,8.10-2-xf | xf | Solvant |
Calculons xmax :
![]()
![]()
![]()
![]()
![]()
![]()
Calculons la masse théorique d’allantoïne :
![]()
Calculons le rendement :
![]()
![]()
