ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH108
Télécharger l’exercice en PDF :
Depuis l’Antiquité déjà, Romains et Égyptiens utilisaient le dioxyde de soufre SO2 pour conserver les denrées alimentaires. Encore aujourd’hui la plupart des vignerons, y compris en agriculture biologique, utilisent le dioxyde de soufre comme antiseptique, antioxydant et régulateur de fermentation.
Depuis plusieurs années la tendance est à limiter l’utilisation de SO2 dans le processus de vinification car à trop forte concentration le dioxyde de soufre peut occasionner des maux de tête pour le consommateur.
L’objectif de cet exercice est d’étudier dans une première partie la structure de la molécule de dioxyde de soufre pour comprendre sa solubilité dans le vin puis dans une seconde partie d’étudier le titrage d’un vin blanc sec biologique.
Données :
- Couples oxydant / réducteur :
I2(aq) / I–(aq)
SO42-(aq) / SO2(aq)
- Couleurs des espèces chimiques :
I2(aq) : marron I–(aq) : incolore
SO42-(aq) : incolore SO2(aq) : incolore
En l’absence de diiode, l’empois d’amidon est incolore et en sa présence, il prend une coloration bleue noire.
- Masse molaire moléculaire du dioxyde de soufre M = 64,0 g·mol-1.
- Électronégativités de l’oxygène χ(O) = 3,4 ; du soufre χ(S) = 2,6 ; de l’hydrogène χ(H) = 2,2.
- Configuration électronique du carbone : 1s2 2s2 2p2.
- Configuration électronique de l’oxygène : 1s2 2s2 2p4.
Structure du dioxyde de soufre SO2 et solubilité dans le vin
Le schéma de Lewis de la molécule de dioxyde de soufre SO2 est représenté ci-dessous :
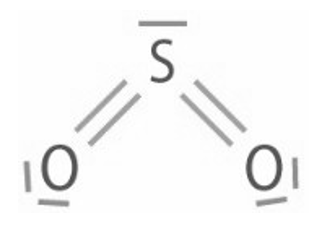
1. Etablir le schéma de Lewis de la molécule de dioxyde de carbone CO2.
- Z(C) = 6 : Configuration électronique du carbone : 1s2 2s2 2p2.
Électrons de valence du carbone : 2+2=4
Structure électronique du gaz noble le plus proche : 1s2 2s2 2p6
Électrons engagés dans une liaison covalente : 8−4=4
Doublets liants : 4
Électrons non engagés dans une liaison covalente : 4−4=0
Doublets non liants : 0/2=0
Le carbone à 4 liaisons covalentes et 0 doublets non liants.
• Z(O) = 8 Configuration électronique de l’oxygène : 1s2 2s2 2p4.
Électrons de valence de l’oxygène : 2+4=6
Structure électronique du gaz noble le plus proche : 1s2 2s2 2p6
Électrons engagés dans une liaison covalente : 8−6=2
Doublets liants : 2
Électrons non engagés dans une liaison covalente : 6−2=4
Doublets non liants : 4/2=2
L’oxygène à 2 liaisons covalentes et 2 doublets non liants.
Schéma de Lewis de la molécule de dioxyde de carbone CO2 :
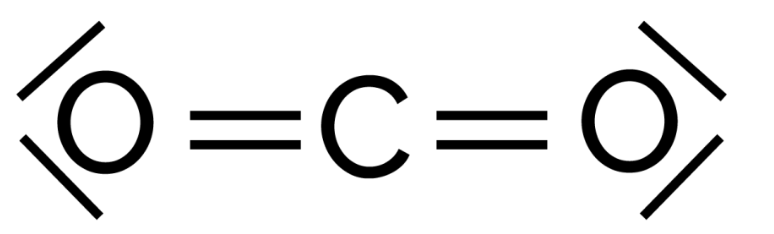
2. En comparant la représentation de Lewis de la molécule de dioxyde de carbone CO2 avec celle du dioxyde de soufre SO2, proposer une explication au fait que la molécule de dioxyde de soufre soit coudée.
Dans les deux molécules, l’atome centrale fait deux doubles liaisons avec deux atomes d’oxygène.
Cependant, la représentation de Lewis de la molécule du dioxyde de soufre SO2 montre que l’atome de soufre porte un doublet non liant contrairement à l’atome de carbone de la molécule de dioxyde de carbone CO2.
Les doublets liants de la molécule de dioxyde de carbone CO2 se repoussent au maximum. Ainsi la molécule de dioxyde de carbone CO2 est linéaire
La présence du doublet non liant sur la molécule du dioxyde de soufre SO2 repousse les doublets liants ce qui explique que la molécule de dioxyde de soufre soit coudée.
3. Déterminer le caractère polaire ou apolaire de la liaison S–O.
Calculons la différence d’électronégativité entre l’atome d’oxygène et l’atome de soufre :
\[ \Delta \chi = \chi(\text{O}) – \chi(\text{S}) \]
\[ \Delta \chi = 3{,}4 – 2{,}6 \]
\[ \Delta \chi = 0{,}8 \]
\[ \Delta \chi > 0{,}4 \] : la liaison S–O est polaire.
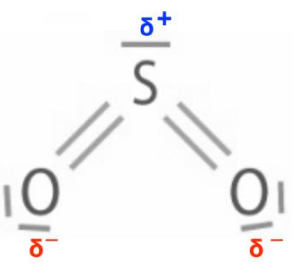
4.Déterminer le caractère polaire ou apolaire de la molécule SO2.
Les deux liaisons S—O sont polaires.
L’atome d’oxygène étant plus électronégatif, chaque atome d’oxygène porte une charge partielle δ–. L’atome de soufre porte une charge partielle δ+.
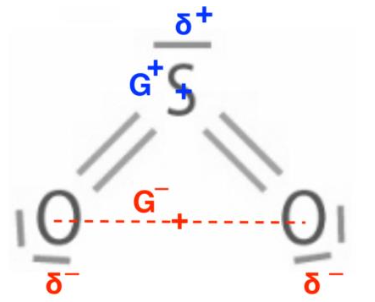
Le barycentre des charges positives G+ est situé sur l’atome de soufre S.
Le barycentre des charges négatives G– est situé entre les deux atomes d’oxygène O.
Le barycentre des charges positives G+ est différent du barycentre des charges négatives G– : la molécule de dioxyde de soufre SO2 est polaire.
5.Expliquer la solubilité du dioxyde de soufre dans le vin.
L’eau est une molécule polaire et la molécule de dioxyde de soufre SO2 est polaire.
Ces deux molécules ont de grandes affinités chimiques. Elles établissent entre elles des liaisons hydrogène.
C’est ce qui explique la solubilité du dioxyde de soufre dans le vin (constitué majoritairement d’eau).
Au cours de toute fermentation alcoolique, le dioxyde de soufre peut se retrouver combiné au composé représenté ci-contre, qui est produit au cours de toute fermentation alcoolique et présent dans tous les vins.
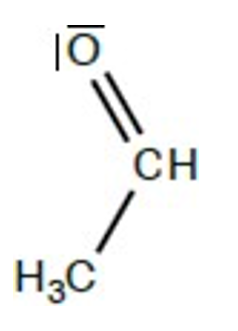
6.Recopier la formule semi-développée puis entourer le groupe caractéristique.
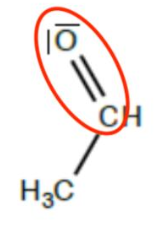
7.Nommer le groupe caractéristique et indiquer à quelle famille chimique appartient la molécule.
Groupe caractéristique : carbonyle
Famille chimique : aldéhyde
8.En déduire le nom de la molécule représentée, parmi les propositions suivantes :
A – Ethanol B – Ethanal C – Ethanone
D – Propanol E – Propanal F – Propanone
La molécule porte deux atomes de carbone : ethan
La molécule fait partie de la famille des aldéhydes : al
Nom de la molécule représentée : ethanal
Proposition B – Ethanal
Titrage du dioxyde de soufre SO2 dans un vin blanc sec bio
Le dioxyde de souffre existe dans le vin sous deux formes :
- forme libre SO2 ;
- forme combinée à la molécule d’éthanal.
Avant de procéder au titrage de la totalité du SO2 dans le vin, il est donc nécessaire de libérer le SO2 combiné. Cette étape s’effectue par ajout d’hydroxyde de sodium (Na+(aq) et HO–(aq)).
Le titrage du dioxyde de soufre (SO2) doit se faire en milieu acide à l’aide d’un ajout modéré d’acide sulfurique et il s’effectue selon la méthode de Ripper :
Le SO2(aq) est titré en milieu acide par une solution aqueuse de diiode I2(aq) de concentration connue. L’équation de la réaction support du titrage est :
SO2(aq) + I2(aq) + 2 H2O(l) → 2 I– (aq) + SO42- (aq) + 4 H+(aq)
L’empois d’amidon est utilisé comme indicateur coloré de fin de réaction et passe de l’incolore au bleu.
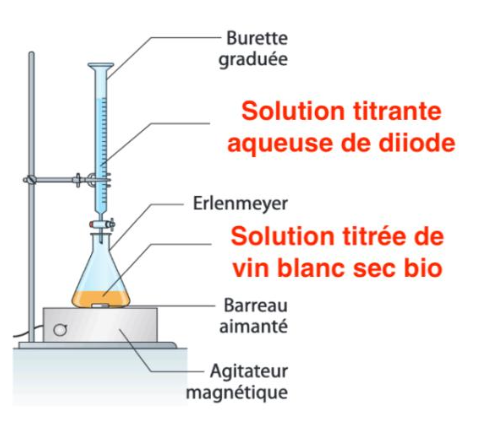
Le protocole expérimental suivi est le suivant :
- introduire dans un bécher 20 mL de vin blanc sec bio ;
- ajouter 20 mL d’une solution de soude (Na+(aq) et HO–(aq)) de concentration en quantité de matière c = 1,0 mol·L-1 ;
- agiter pendant 15 minutes ;
- ajouter 6 mL d’une solution d’acide sulfurique de concentration en quantité de matière égale à 1,0 mol·L-1 ;
- ajouter quelques gouttes d’empois d’amidon ;
- réaliser le titrage avec une solution aqueuse de diiode, I2(aq), de concentration en quantité de matière c1 = 2,0.10-3 mol·L-1.
La valeur du volume équivalent obtenu après le titrage du vin blanc sec bio étudié est Ve = 13,8 mL.
9.Indiquer si le protocole expérimental décrit ci-dessus permet d’effectuer le titrage de la totalité du dioxyde de soufre présent dans ce vin blanc sec bio.
D’après l’énoncé : « Avant de procéder au titrage de la totalité du SO2 dans le vin, il est donc nécessaire de libérer le SO2 combiné. Cette étape s’effectue par ajout d’hydroxyde de sodium (Na+(aq) et HO–(aq)). »
Le protocole expérimental suivi est le suivant :
– introduire dans un bécher 20 mL de vin blanc sec bio ;
– ajouter 20 mL d’une solution de soude (Na+(aq) et HO–(aq)) de concentration en quantité de matière c = 1,0 mol·L-1 ;
Ainsi, le protocole expérimental décrit ci-dessus permet d’effectuer le titrage de la totalité du dioxyde de soufre présent dans ce vin blanc sec bio car on ajoute de d’hydroxyde de sodium (Na+(aq) et HO–(aq)) au vin.
10.Schématiser le montage utilisé afin de réaliser ce titrage. Nommer et flécher la verrerie et les espèces chimiques présentes sur le schéma.
11.Démontrer que l’équation support de titrage est bien :
SO2(aq) + I2(aq) + 2 H2O(l) → 2 I– (aq) + SO42- (aq) + 4 H+(aq)
Le \(\text{SO}_2\) (\(\text{aq}\)) est titré en milieu acide par une solution aqueuse de diiode \(\text{I}_2\) (\(\text{aq}\)) de concentration connue. L’équation de la réaction support du titrage est :
\[ \text{SO}_2 (\text{aq}) + 2 \text{H}_2 \text{O} (\text{l}) = \text{SO}_4^{2-} (\text{aq}) + 4 \text{H}^+ (\text{aq}) + 2 \text{e}^- \]
\[ \text{I}_2 (\text{aq}) = 2 \text{I}^- (\text{aq}) + 2 \text{e}^- \]
En combinant ces deux équations, on obtient :
\[ \text{SO}_2 (\text{aq}) + 2 \text{H}_2 \text{O} (\text{l}) + \text{I}_2 (\text{aq}) = \text{SO}_4^{2-} (\text{aq}) + 4 \text{H}^+ (\text{aq}) + 2 \text{I}^- (\text{aq}) \]
On remet dans l’ordre de l’énoncé :
\[ \text{SO}_2 (\text{aq}) + \text{I}_2 (\text{aq}) + 2 \text{H}_2 \text{O} (\text{l}) = 2 \text{I}^- (\text{aq}) + \text{SO}_4^{2-} (\text{aq}) + 4 \text{H}^+ (\text{aq}) \]
12.Préciser le changement de couleur qui permet de repérer l’équivalence.
Le dioxyde de soufre est incolore et le diiode est marron. Cependant, en présence d’amidon il devient bleu.
Avant l’équivalence, le diiode est le réactif limitant et le dioxyde de soufre le réactif en excès. Le mélange est de la couleur du réactif en excès : il est incolore.
Après l’équivalence, le diiode est le réactif en excès et le dioxyde de soufre le réactif limitant. Le mélange est de la couleur du réactif en excès : il est bleu (présence d’amidon).
Ainsi, à l’équivalence on observe un changement de couleur de l’incolore au bleu.
13.Déterminer la relation, à l’équivalence, entre les quantités de matières de dioxyde de souffre présents initialement ni(SO2), et le diiode versé à l’équivalence nE(I2). Vérifier que la valeur de la quantité de diiode versée à l’équivalence vaut : nE(I2) = 2,8.10–5 mol.
\[ \text{SO}_2 (\text{aq}) + \text{I}_2 (\text{aq}) + 2 \text{H}_2 \text{O} (\text{l}) = 2 \text{I}^- (\text{aq}) + \text{SO}_4^{2-} (\text{aq}) + 4 \text{H}^+ (\text{aq}) \]
À l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques :
\[ \frac{n_{i(\text{SO}_2)}} {1} = \frac{n_{E(\text{I}_2)}} {1} \]
\[ n_{i(\text{SO}_2)} = n_{E(\text{I}_2)} \]
D’autre part :
\[ n_{E(\text{I}_2)} = c_1 V_E \]
\[ n_{E(\text{I}_2)} = 2{,}0 \times 10^{-3} \times 13{,}8 \times 10^{-3} \]
\[ n_{E(\text{I}_2)} = 2{,}8 \times 10^{-5} \, \text{mol} \]
14.Déterminer la valeur de la concentration massique en SO2 du vin blanc sec bio titré. Ecrire le résultat de mesure avec le nombre adapté de chiffres significatifs sachant que l’incertitude- type sur la concentration massique en dioxyde de soufre est : um = 5.10-3 g·L-1.
\[ n_{i(\text{SO}_2)} = n_{E(\text{I}_2)} \quad (\text{question 13}) \]
\[ c_{(\text{SO}_2)} V_{\text{vin}} = n_{E(\text{I}_2)} \]
\[ c_{(\text{SO}_2)} = \frac{n_{E(\text{I}_2)}}{V_{\text{vin}}} \]
\[ c_{(\text{SO}_2)} = \frac{2{,}8 \times 10^{-5}}{20 \times 10^{-3}} \]
\[ c_{(\text{SO}_2)} = 1{,}4 \times 10^{-3} \, \text{mol} \cdot \text{L}^{-1} \]
Calculons la concentration massique :
\[ c_{m(\text{SO}_2)} = c_{(\text{SO}_2)} \times M_{(\text{SO}_2)} \]
\[ c_{m(\text{SO}_2)} = 1{,}4 \times 10^{-3} \times 64{,}0 \]
\[ c_{m(\text{SO}_2)} = 9{,}0 \times 10^{-2} \, \text{g} \cdot \text{L}^{-1} \]
Sachant que l’incertitude-type sur la concentration massique en dioxyde de soufre est : \(u_m = 5 \times 10^{-3} \, \text{g} \cdot \text{L}^{-1}\).
\[ c_{m(\text{SO}_2)} = 9{,}0 \times 10^{-2} \pm 5 \times 10^{-3} \, \text{g} \cdot \text{L}^{-1} \]
\[ c_{m(\text{SO}_2)} = (9{,}0 \pm 0{,}5) \times 10^{-2} \, \text{g} \cdot \text{L}^{-1} \]
Selon le règlement Européen depuis 2012 sur le VIN BIO N°203/2012 (1er août 2012), pour un vin blanc sec bio la teneur maximale en SO2 total autorisée est de 150 mg·L-1 alors que pour un vin blanc sec non bio la teneur maximale en SO2 autorisée est de 200 mg·L-1.
Source : journal officiel de l’union Européenne
Consulté le 05/10/20
15. Conclure si ce vin blanc sec bio étudié respecte la norme du label bio.
\[ c_{m(\text{SO}_2)} = (9{,}0 \pm 0{,}5) \times 10^{-2} \, \text{g} \cdot \text{L}^{-1} \]
\[ c_{m(\text{SO}_2)} = (90 \pm 5) \times 10^{-3} \, \text{g} \cdot \text{L}^{-1} \]
\[ c_{m(\text{SO}_2)} = (90 \pm 5) \, \text{mg} \cdot \text{L}^{-1} \]
\[ 85 \, \text{mg} \cdot \text{L}^{-1} < c_{m(\text{SO}_2)} < 95 \, \text{mg} \cdot \text{L}^{-1} \]
Selon le règlement Européen depuis 2012 sur le VIN BIO N°203/2012 (1er août 2012), pour un vin blanc sec bio la teneur maximale en SO2 total autorisée est de 150 mg·L-1.
La teneur de ce vin blanc sec bio est inférieure à la limite imposée par le règlement Européen. Ainsi, ce vin blanc sec bio étudié respecte la norme du label bio.
