E3C2 – 10 points – Durée 1h – calculatrice autorisée
Les principales dépenses d’énergie au sein d’une maison française se répartissent entre quatre grands postes dont le plus important est le chauffage. La production d’eau chaude sanitaire est aussi un poste important.
Le but de l’exercice est d’étudier les dépenses énergétiques liées à ces deux postes (chauffage et production d’eau chaude sanitaire) dans une maison comportant deux étages.
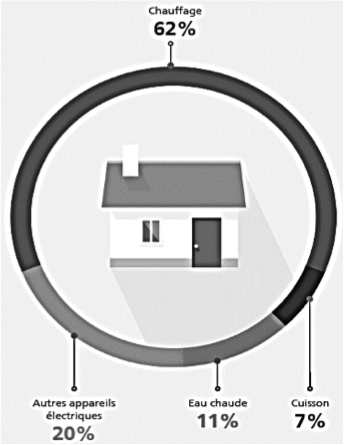
Principales dépenses d’énergie au sein d’une maison française
Source https://travaux.edf.fr/
1. Chauffage de la maison
La maison est équipée d’un chauffage central à partir d’une chaudière fonctionnant au gaz naturel. Afin de réaliser des économies d’énergie, le choix a été fait d’installer une chaudière à condensation. Le principe de fonctionnement d’une chaudière à condensation est illustré sur ci-dessous.
Dans le brûleur (1), la combustion du gaz naturel permet de transférer de l’énergie à l’eau du circuit de chauffage (2). Cette eau, après avoir alimenté les radiateurs (3), circule dans un serpentin (4) mis en contact avec les produits de la combustion du gaz naturel (5). Ces produits se condensent au contact de l’eau froide et les condensats produits dans la chaudière (6) sont ensuite rejetés à l’égout. La condensation étant un phénomène exothermique, de l’énergie thermique est ainsi fournie à l’eau du circuit de chauffage.
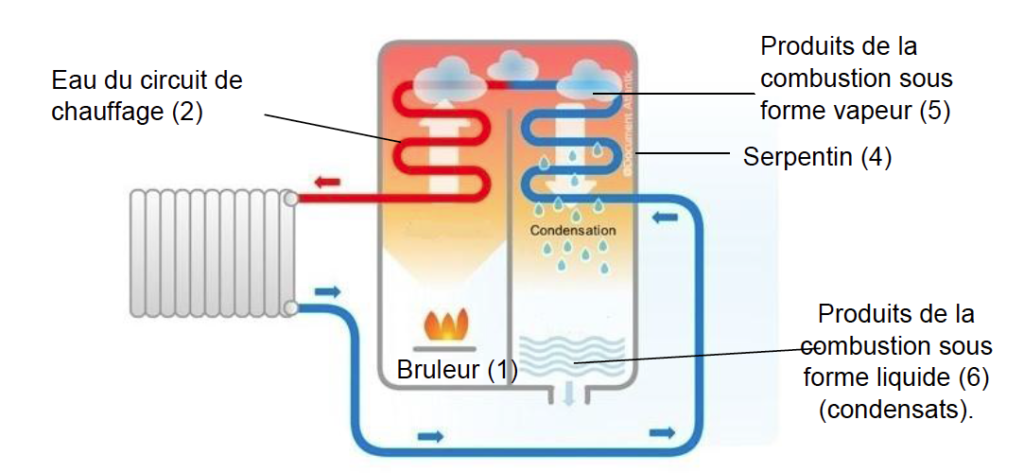
Principe de fonctionnement d’une chaudière à condensation.
D’après https://ma-maison-eco-confort.atlantic.fr/
Données :
- le « gaz naturel » est principalement constitué de méthane ;
- énergies molaires des liaisons en kJ·mol-1
| liaison | C-H | C=O (dans CO2) | O=O | O-H |
| énergie de liaison (kJ·mol-1) | 411 | 795 | 494 | 459 |
- masses molaires atomiques en g·mol-1 : H : 1,0 g·mol-1 ; C : 12,0 g·mol-1 ; O : 16,0 g·mol-1
- numéros atomiques : H : 1 C : 6 O : 8 ;
- la valeur de l’énergie libérée par la condensation d’un gramme d’eau est : 2,3 kJ ;
- masse volumique de l’eau liquide : ρ = 1,0 kg·L-1.
1.1. Écrire l’équation de la réaction modélisant la combustion du gaz naturel dans le dioxygène. La formule du méthane est CH4 et les produits de combustion sont le dioxyde de carbone et l’eau.
CH4+2O2→CO2+2H2O
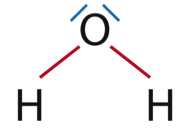
1.2. Établir le schéma de Lewis des molécules de dioxyde de carbone et d’eau.
1H : 1s1 donc 1 électron de valence
8O : 1s2 2s2 2p4 donc 6 électrons de valence
6C : 1s2 2s2 2p2 donc 4 électrons de valence
H : 1 liaison
O : 2 liaisons et 2 doublets non liants
C : 4 liaisons
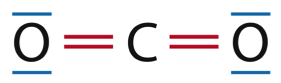
1.3. À partir du tableau donnant les valeurs des énergies de liaison, calculer celle de l’énergie molaire de réaction de la combustion du gaz naturel dans le dioxygène et justifier du caractère exothermique de la transformation. En déduire que le pouvoir calorifique du méthane est d’environ 50 kJ·g-1.
Er = 4 EC-H + 2 EO=O − 4 EO-H − 2 EC=O
Er = 4 × 411 + 2 × 494 − 4 × 459 − 2 × 795
Er = − 794 kJ.mol−1 (exothermique car Er négatif)
Calculons la masse d’une mole de méthane :
m=n×M=1,0×(12,0+4×1,0)=16g
Pouvoir calorifique
![]()
1.4. Calculer l’énergie thermique libérée au cours de la combustion de 100 g de méthane. Montrer qu’au cours de cette combustion il se forme 225 g de vapeur d’eau.
![]()
![]()
Calculons les quantités de matière des réactifs :
![]()
![]()
![]()
| Equation | CH4 | + 2O2 | → CO2 | + 2H2O | |
| Etat initial | x=0mol | 6,25 | excès | 0 | 0 |
| Etat intermédiaire | x | 6,25-x | excès | x | 2x |
| Etat final | x=xf | 6,25- xf | excès | xf | 2xf |
Calculons xmax :
6,25- xmax =0
xmax =6,25 mol
![]()
![]()
![]()
1.5. On fait l’hypothèse que toute la vapeur d’eau formée lors de la combustion se condense et que seule l’énergie libérée lors de la condensation de l’eau est récupérée. Calculer la valeur de l’énergie associée à la condensation de la vapeur d’eau formée pour 100 g de méthane puis montrer que l’utilisation de cette énergie permet de réaliser un gain maximal d’environ 10 % en énergie.
La valeur de l’énergie libérée par la condensation d’un gramme d’eau est : 2,3 kJ ;
Pour 225 g d’eau (combustion de 100 g de méthane): E=225×2,3=518kJ
L’énergie thermique libérée au cours de la combustion (question 1.4) : Er=5,0.103kJ
Calculons le pourcentage :
![]()
2. Eau chaude sanitaire
Dans ce logement l’eau chaude sanitaire est fournie par chauffe-eau qui fonctionne à l’électricité. Le principe est simple : une résistance électrique placée dans le cumulus chauffe l’eau jusqu’à une température définie appelée température de consigne.
Les caractéristiques techniques du chauffe-eau indiquées par le constructeur sont en partie reproduites :
| Capacité | Tension de fonctionnement | Puissance | Temps de chauffe(1) |
| 150 L | 230 V | 1800 W | 5 h 15 |
(1) Le temps de chauffe est indiqué pour une eau dont la température initiale est de 15 °C et la température finale de 65 °C.
Données :
- L’énergie thermique E nécessaire pour élever la température d’une masse m d’eau liquide de ΔT est donnée par la relation E = m·ceau·ΔT où ceau est la capacité thermique massique de l’eau (ceau = 4,18×103J·kg-1·K-1) ;
- masse volumique de l’eau ρ = 1,00 kg·L-1 ;
- ϴ(°C) = T(K) – 273 ; 1,0 J = 3,6kWh ;1 bar = 105 Pa.
2.1. Nommer le phénomène physique qui permet le chauffage de l’eau dans le cumulus. Déterminer la valeur de la résistance chauffante du cumulus.
Une résistance électrique placée dans le cumulus chauffe l’eau : c’est l’effet joule.
D’après la loi d’ohm : U=R.I Donc
![]()
Or : P=U.I d’ou
![]()
d’ou
![Rendered by QuickLaTeX.com \[R=\frac{U}{P/U}=\frac{U^2}{P}=\frac{230^2}{1800}=29\Omega\]](https://physik.fr/wp-content/ql-cache/quicklatex.com-bcdfc93aa191ac065f191edfa4aa11a8_l3.png)
2.2. À l’aide des caractéristiques techniques du constructeur et des données, calculer la valeur de l’énergie thermique nécessaire à l’élévation de la température de la totalité de l’eau du cumulus.
E = m·ceau·ΔT
or
![]()
d’ou m= ρ×V
Donc :
E = ρ×V×ceau×ΔT
E = 1,0×150×4,18×103×(65-15)=3,1.107J
2.3. Utiliser la puissance du chauffe-eau pour en déduire la durée nécessaire à cette élévation de température. Comparer à la valeur indiquée par le constructeur et proposer une explication à une éventuelle différence.
![]()
![]()
![]()
D’après la notice le temps de chauffe est 5 h 15
Cette différence peux s’expliquer par :
- Une eau à une température initiale plus basse que 15°C
- Des pertes énergétiques dues à une mauvaise isolation du chauffe eau
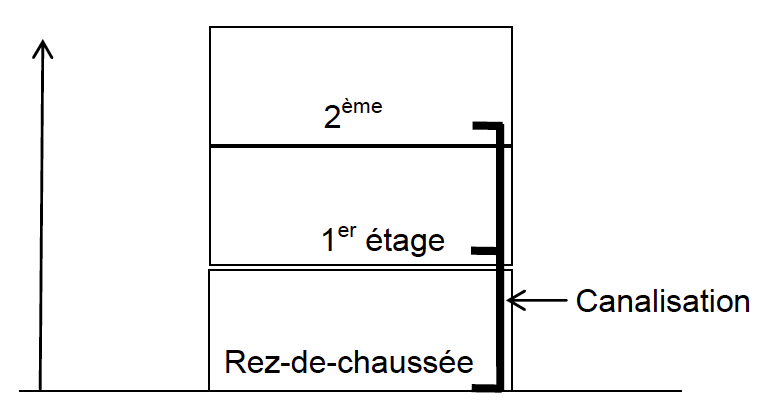
Le cumulus est installé au rez-de-chaussée d’une maison de deux étages (schéma ci-contre). Le graphe ci-dessous indique la pression minimale de l’eau en sortie du cumulus en fonction de l’altitude z du point de distribution de l’eau chaude. Pour un fonctionnement correct l’eau doit arriver au point de distribution avec une pression minimale de 2,50 bar.
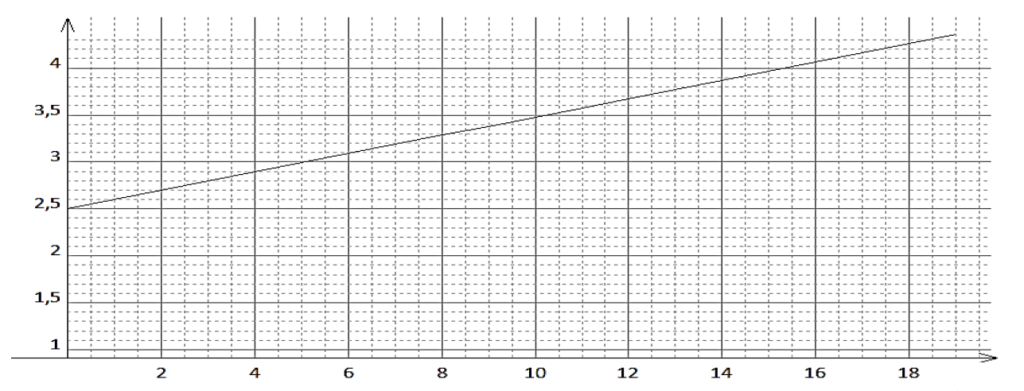
Pression de l’eau en sortie de cumulus en fonction de l’altitude de la distribution
2.4. Commenter l’allure du graphe puis l’utiliser pour estimer la pression minimale de l’eau en sortie du cumulus nécessaire à la distribution d’eau chaude dans une maison de deux étages.
Nous avons une fonction affine :
La pression minimale de l’eau en sortie du cumulus est croissante en fonction de l’altitude z.
Un étage mesure environs 3m soit 6m pour 2 étages.
Par lecture graphique pour Z=6m, P=3,1 bar
La pression minimale de l’eau en sortie du cumulus doit être de 3,1 bar
