ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH105
Télécharger l’exercice en PDF :
Lorsque du pétrole se déverse dans le milieu marin, les autorités n’ont comme options pour minimiser l’impact sur l’environnement des « marées noires » que de le récupérer, de le disperser ou de le brûler.
La récupération du pétrole n’est pas aisée à cause des conditions généralement houleuses en mer, et ne se pratique que très rarement. La dispersion en revanche tient ses promesses grâce au travail des chimistes en particulier. Le brûlage du pétrole sur zone est peu pratiqué, car pour être efficace le pétrole doit contenir suffisamment de constituants légers et inflammables.
Cela génère, de plus, de graves incidences sur l’environnement à cause des gaz et des suies qu’une telle combustion libère.
Données :
- Échelle d’électronégativité de Pauling de quelques éléments chimiques :
| H 2,1 | He 0 | ||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | Ne 0 |
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | Ar 0 |
On considère qu’une liaison est polarisée quand la différence d’électronégativité entre les deux atomes liés est supérieure à 0,4.
- Numéros atomiques : carbone Z(C) = 6 ; hydrogène Z(H) = 1 ; oxygène Z(O) = 8 ; chlore Z(Cl) = 17
- Informations diverses à 25 °C :
| Éthanol | M = 46 g·mol-1 ; ρ = 0,79 g·cm-3 |
| n-octane | M = 114 g·mol-1 ; ρ = 0,70 g·cm-3 |
| Eau de mer | ρ = 1,029 g·cm-3 |
| CO2 | M = 44 g·mol-1 |
- Un individu émet en moyenne environ 30 kg de CO2 par jour. Les origines de ces émissions sont les déplacements, le chauffage, l’eau chaude, l’électricité consommée.
Nous allons étudier le naufrage d’un navire dont le carburant, le n-octane par simplification, s’est étalé à la surface de l’eau formant des nappes d’hydrocarbures à la dérive. Le littoral est donc menacé par une « marée noire ».
Miscible ou non miscible ?
1. Établir le schéma de Lewis de la molécule d’eau H2O.
• Z(O) = 8 : Configuration électronique de l’oxygène : 1s2 2s2 2p4.
Électrons de valence de l’oxygène : 2+4=6
Structure électronique du gaz noble le plus proche : 1s2 2s2 2p6
Électrons engagés dans une liaison covalente : 8−6=2
Doublets liants : 2
Électrons non engagés dans une liaison covalente : 6−2=4
Doublets non liants : 4/2=2
L’oxygène à 2 liaisons covalentes et 2 doublets non liants.
- Z(H) = 1 : Configuration électronique de l’hydrogène : 1s1.
Électrons de valence de l’hydrogène : 1=1
Structure électronique du gaz noble le plus proche : 1s2
Électrons engagés dans une liaison covalente : 2−1=1
Doublets liants : 1
Électrons non engagés dans une liaison covalente : 1−1=0
Doublets non liants : 0/2=0
L’hydrogène à 1 liaison covalentes et 0 doublets non liants.
Schéma de Lewis de la molécule d’eau H2O :
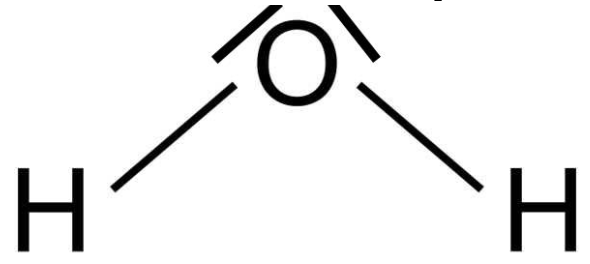
2. Déterminer le caractère polaire ou apolaire de la molécule d’eau.
Calculons la différence d’électronégativité entre l’atome d’oxygène et l’atome d’hydrogène :
\[ \Delta \chi = \chi(\text{O}) – \chi(\text{H}) \]
\[ \Delta \chi = 3{,}5 – 2{,}1 \]
\[ \Delta \chi = 1{,}4 \]
$ \Delta \chi > 0{,}4 $ : la liaison O—H est polaire.
Les deux liaisons O—H sont polaires.
L’atome d’oxygène étant plus électronégatif, chaque atome d’oxygène porte une charge partielle δ–. L’atome d’hydrogène porte une charge partielle δ+.
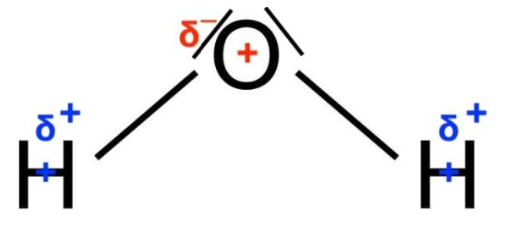
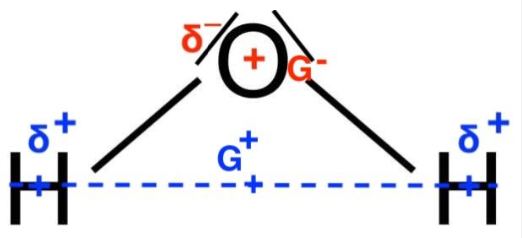
Le barycentre des charges positives G+ est situé sur l’atome de d’oxygène O.
Le barycentre des charges négatives G– est situé entre les deux atomes d’hydrogène H. Le barycentre des charges positives G+ est différent du barycentre des charges négatives G– : la molécule d’eau H2O est polaire
Le n-octane appartient à la famille des alcanes. Il est constitué de 8 atomes de carbone et de 18 d’hydrogène liés par de simples liaisons covalentes.
3. Déterminer le caractère polaire ou apolaire de la molécule de n-octane.
Calculons la différence d’électronégativité entre l’atome de carbone et l’atome d’hydrogène :
\[ \Delta \chi = \chi(\text{C}) – \chi(\text{H}) \]
\[ \Delta \chi = 2{,}5 – 2{,}1 \]
\[ \Delta \chi = 0{,}4 \]
$ 0 \leq \Delta \chi \leq 0{,}4 $ : la liaison C—H n’est polaire.
Le n-octane étant constitué de carbone et d’hydrogène uniquement, qui forment des liaisons non polarisées : la molécule de n-octane est apolaire.
4. Justifier que le carburant du navire qui se répand dans la mer forme une nappe d’hydrocarbure en surface.
L’eau est polaire et la molécule de n-octane est apolaire. Les deux molécules ne sont pas miscibles.
De plus ρn-octane < ρeau de mer : la molécule de n-octane se trouve au-dessus de l’eau de mer.

C’est ce qui explique le carburant du navire qui se répand dans la mer forme une nappe d’hydrocarbure en surface.
Dispersion d’une nappe d’hydrocarbures
La dispersion d’une nappe d’hydrocarbures consiste à épandre un dispersant, c’est-à-dire un produit tensioactif composé de molécules amphiphiles. Ces molécules ont la capacité de séparer la nappe d’hydrocarbures en une multitude de gouttelettes de pétrole en les entourant, chacune formant ainsi des micelles, comme représentées ci-dessous :
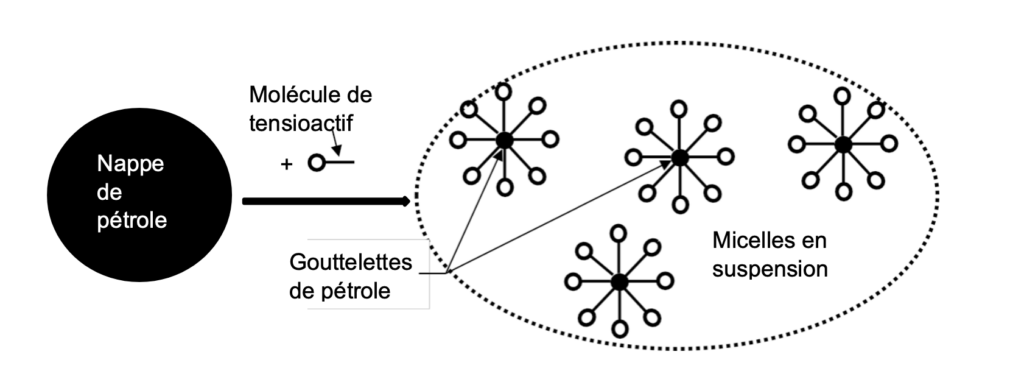
D’après Dossier n°73 / Octobre – Décembre 2011 / © Pour la Science
5. Définir ce qu’est une molécule amphiphile.
Une molécule amphiphile ou tensioactif est une molécule avec une longue chaine carbonée hydrophobe (lipophile) apolaire (insoluble dans l’eau et soluble dans les graisses) et une partie hydrophile (lipophobe) polaire (soluble à l’eau dans l’eau et insoluble dans les graisses).
6. Expliquer, en quelques mots, la formation des micelles et la dispersion possible des micelles en suspension.
Lorsqu’une molécule amphiphile rencontre une nappe d’hydrocarbures, la partie lipophile entre en contact avec l’hydrocarbure, la tête du tensioactif reste en contact avec l’eau.
Les molécules amphiphiles s’agrègent spontanément autour du pétrole pour former des structures sphériques appelées micelles.
Dans ces micelles, les queues hydrophobes se regroupent au centre, éloignées de l’eau, tandis que les têtes hydrophiles forment la surface extérieure, en contact avec l’eau.
La surface hydrophile des micelles permet une interaction avec les molécules d’eau, ce qui stabilise les micelles dans la solution aqueuse et empêche leur agrégation en structures plus grandes. Cela permet aux micelles de rester dispersées.
On considère un produit tensioactif composé d’une molécule amphiphile dont la formule semi- développée est :
CH3 – (CH2)8 – COOH
7. Identifier la famille fonctionnelle à laquelle appartient cette molécule.
– COOH : famille des acides carboxyliques.
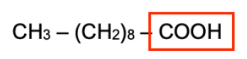
8. Expliquer le caractère amphiphile de cette molécule.
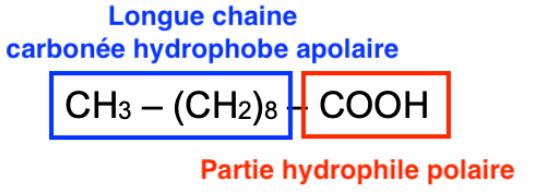
CH3 – (CH2)8 – COOH
La liaison C—H n’est polaire (voir question 3). CH3 – (CH2)8 est une longue chaine carbonée hydrophobe (lipophile) apolaire.
La liaison O—H est polaire (voir question 2).– COOH est une partie hydrophile (lipophobe) polaire.
Ainsi, cette molécule a un caractère amphiphile.
Le brûlage d’une nappe d’hydrocarbures et ses conséquences.
Le volume de n-octane déversé par un navire est de V = 2,9 x 106 L. La combustion envisagée de la nappe d’hydrocarbures constituée de n-octane ne sera pas une combustion complète. Outre le dioxyde de carbone et l’eau formés, la combustion libèrera aussi du carbone.
9. Écrire l’équation de la réaction modélisant la combustion incomplète du n-octane.
D’après l’énoncé : Le n-octane appartient à la famille des alcanes. Il est constitué de 8 atomes de carbone et de 18 d’hydrogène liés par de simples liaisons covalentes.
n-octane : \(\text{C}_8\text{H}_{18}\)
Équation de la réaction modélisant la combustion incomplète du n-octane (outre le dioxyde de carbone et l’eau formés, la combustion libère aussi du carbone) :
\[ \text{C}_8\text{H}_{18} (\text{l}) + \text{O}_2 (\text{g}) \rightarrow \text{CO}_2 (\text{g}) + \text{H}_2\text{O} (\text{g}) + \text{C} \]
Remarque : dans une combustion incomplète, du monoxyde de carbone CO est normalement aussi produit.
Équilibrons l’équation :
\[ \text{C}_8\text{H}_{18} (\text{l}) + \frac{21}{2} \text{O}_2 (\text{g}) \rightarrow 7 \text{CO}_2 (\text{g}) + 9 \text{H}_2\text{O} (\text{g}) + \text{C} \]
Remarque : il n’y a pas qu’une seule façon d’équilibrer cette équation.
10. En vous appuyant sur un calcul, discuter de l’opportunité d’utiliser cette méthode, au regard de son impact environnemental lié au dégagement de dioxyde de carbone.
Basons-nous sur l’équation trouvée à la question précédente.
Calculons la quantité de n-octane déversé :
\[ n_{\text{n-octane}} = \frac{m_{\text{n-octane}}}{M_{\text{n-octane}}} \]
Or,
\[ \rho_{\text{n-octane}} = \frac{m_{\text{n-octane}}}{V_{\text{n-octane}}} \]
\[ m_{\text{n-octane}} = \rho_{\text{n-octane}} \times V_{\text{n-octane}} \]
D’où,
\[ n_{\text{n-octane}} = \frac{\rho_{\text{n-octane}} \times V_{\text{n-octane}}}{M_{\text{n-octane}}} \]
\[ n_{\text{n-octane}} = \frac{0{,}70 \times 2{,}9 \times 10^6 \times 10^3}{114} \]
\[ n_{\text{n-octane}} = 1{,}8 \times 10^7 \, \text{mol} \]
| Équation | $ \text{C}_8\text{H}_{18} (\text{l}) + \frac{21}{2} \text{O}_2 (\text{g}) \rightarrow 7 \text{CO}_2 (\text{g}) + 9 \text{H}_2\text{O} (\text{g}) + \text{C}$ | |||||
| État | Avancement | |||||
| État initial | x=0 | $ 1{,}8 \times 10^7 $ | Excès | $ 0 $ | $ 0 $ | $ 0 $ |
| État intermédiaire | x | $ 1{,}8 \times 10^7 – x $ | Excès | $ 7 x $ | $ 9 x $ | $ x $ |
| État final | xf | $ 1{,}8 \times 10^7 – x_f $ | Excès | $ 7 x_f = n_{\text{CO}_2}^{\text{émis}} $ | $ 9 x_f $ | $ x_f $ |
La réaction est totale, le dioxygène de l’air est en excès. À la fin de la réaction, il ne reste plus de n-octane :
\[ 1{,}8 \times 10^7 – x_f = 0 \]
\[ -x_f = -1{,}8 \times 10^7 \]
\[ x_f = 1{,}8 \times 10^7 \, \text{mol} \]
La quantité de CO2 émis :
\[ 7 x_f = n_{\text{CO}_2}^{\text{émis}} \]
\[ n_{\text{CO}_2}^{\text{émis}} = 7 x_f \]
\[ n_{\text{CO}_2}^{\text{émis}} = 7 \times 1{,}8 \times 10^7 \]
\[ n_{\text{CO}_2}^{\text{émis}} = 1{,}3 \times 10^8 \, \text{mol} \]
Masse de CO2 émise :
\[ n_{\text{CO}_2} = \frac{m_{\text{CO}_2}}{M_{\text{CO}_2}} \]
\[ m_{\text{CO}_2} = n_{\text{CO}_2} \times M_{\text{CO}_2} \]
\[ m_{\text{CO}_2} = 1{,}3 \times 10^8 \times 44 \]
\[ m_{\text{CO}_2} = 5{,}7 \times 10^9 \, \text{g} \]
\[ m_{\text{CO}_2} = 5{,}7 \times 10^6 \times 10^3 \, \text{g} \]
\[ m_{\text{CO}_2} = 5{,}7 \times 10^6 \, \text{kg} \]
\[ m_{\text{CO}_2} = 5{,}7 \text{ millions de kg} \]
Cette méthode, libère par combustion 5,7 millions de kg de dioxyde de carbone. L’impact environnemental lié au dégagement de dioxyde de carbone est néfaste car c’est un gaz à effet de serre et la quantité libérée est très grande.
Il est préférable de ne pas utiliser cette méthode, au regard de son impact environnemental.
