Enseignement scientifique Terminale
Durée 1h – 10 points – Thème « Science, climat et société »
L’activité humaine a des conséquences sur la composition de l’atmosphère, notamment parce qu’elle conditionne les émissions de CO2.
Nous nous proposons ici d’étudier une évolution récente de l’atmosphère durant les premiers mois de la crise sanitaire de la Covid 19 et les mesures qui l’ont accompagnées.
Document 1 : émissions globales de CO2 en mégatonnes par jour d’origine fossile
Le document présente l’évolution du total des émissions journalières dues à l’utilisation de combustibles fossiles, à l’échelle de la Terre, au cours du temps. Les parties grisées représentent la marge d’erreur.
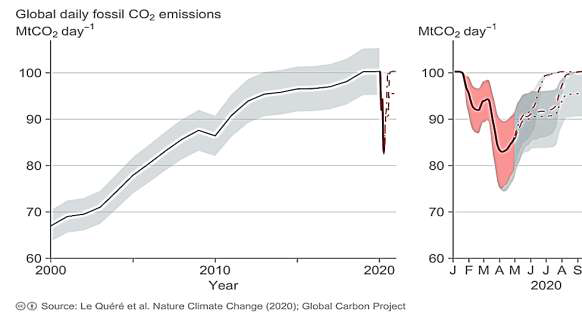
1- En s’appuyant sur l’analyse du document 1, préciser comment ont évolué les émissions de CO2 de 2000 à 2020, à l’échelle globale de la Terre et proposer une hypothèse quant aux causes des variations constatées pendant les premiers mois de l’année 2020.
A l’échelle globale de la Terre, les émissions de CO2 de 2000 à 2020 ont augmentés.
Les premiers mois de l’année 2020, les émissions de CO2 ont diminués. Ont peux faire l’hypothèse que le confinement (moins de transport, baisse de l’activité industrielle) du au Covid-19 est à l’origine de cette diminution.
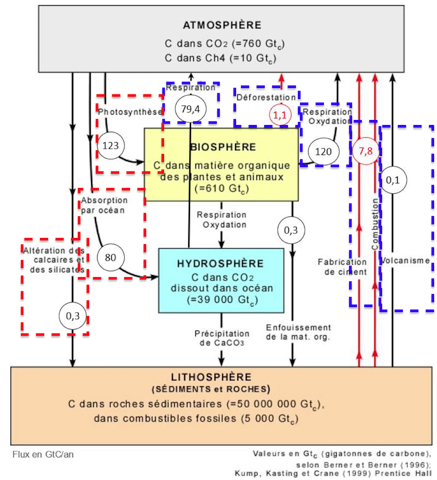
Document 2 : cycle et flux de carbone (en Gt / an)
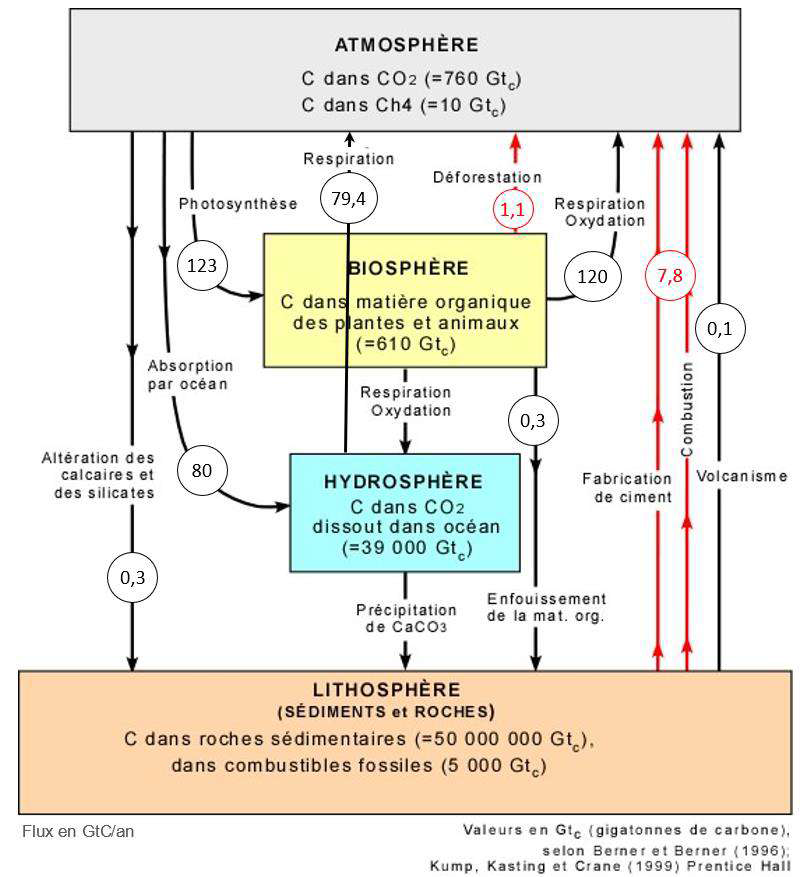
2. À l’aide de vos connaissances personnelles et en s’appuyant sur le document 2, identifier les deux réservoirs de carbone les plus importants et préciser les flux de carbone entre ces deux réservoirs.
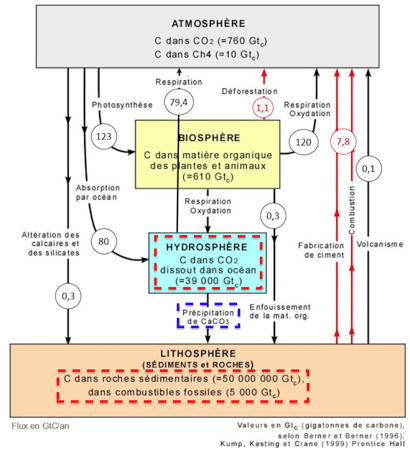
Les deux réservoirs de carbone les plus importants sont la lithosphère et l’hydrosphère.
Les flux de carbone entre ces deux réservoirs sont constitués par les précipitations de CaCO3.
3. En s’appuyant sur le document 2, identifier les flux de nature anthropique sur ce cycle.
Flux de nature anthropique (Fait par un être humain) sur ce cycle :
- Fabrication du ciment
- Combustions
- Déforestation
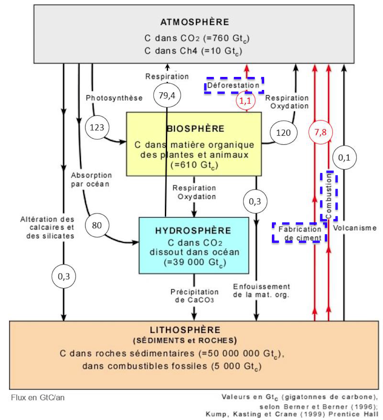
4. En effectuant un bilan à partir de données du document 2, montrer que la quantité de carbone augmente avec le temps dans l’atmosphère.
Bilan de la quantité de carbone l’atmosphère :
Flux entrant : respiration 79,4 + déforestation 1,1+respiration oxydation 120+ fabrication du ciment et combustion 7,8+ volcanisme 0,1 = 208,4 Gtc.
Flux sortant : photosynthèse 123 + absorption par océan 80 + altercation des calcaires et silicates 0,3 = 203,3 Gtc.
Différence entre Flux entrant et Flux sortant : 208,4-203,3=5,1Gtc.
Il y a une augmentation de 5,1Gtc de carbone dans l’atmosphère.
Ainsi, la quantité de carbone augmente avec le temps dans l’atmosphère.
5. Expliquer pourquoi on qualifie un combustible fossile de ressource non renouvelable.
Une ressource non renouvelable ou épuisable lorsque sa vitesse de destruction est supérieure à sa vitesse de création.
Un combustible fossile met des millions d’années à se former et seulement quelques centaines d’années pour épuiser les ressources.
C’est pourquoi on qualifie un combustible fossile de ressource non renouvelable.
6. Sachant qu’une mole d’essence produit huit moles de CO2, prouver par le calcul qu’un kilogramme d’essence produit une masse de CO2 d’environ 3,1 kg, en utilisant les données suivantes.
En première approche, l’équation de la réaction de combustion de l’essence peut être assimilée à celle de la combustion de l’octane (C8H18) :
2 C8H18 (ℓ) + 25 O2 (g) → 16 CO2 (g) + 18 H2O (g)
Données : Une mole d’octane C8H18 a une masse de 114,0 g. Une mole de CO2 a une masse de 44,0 g.
Calculons le nombre de moles dans un kilogramme d’essence
Données : Une mole d’octane C8H18 a une masse de 114,0 g.
| 1 mole d’octane | 114,0 g |
| x moles d’essence | 1 Kg = 1000 g |
![]()
x=8,77 moles d’essence
Sachant qu’une mole d’essence produit huit moles de CO2, Calculons le nombre de moles de CO2 produit par un kilogramme d’essence.
| 1 mole d’octane | 8 moles de CO2 |
| 8,77 moles d’essence | y moles de CO2 |
![]()
y=70,16 moles de CO2
Calculons la masse de CO2 produite par un kilogramme d’essence :
Données : Une mole de CO2 a une masse de 44,0 g.
| 1 mole de CO2 | 44,0 g |
| 70,16 moles de CO2 |
![]()
m = 3087 g de CO2
m≈3,1 Kg de CO2
Ainsi, un kilogramme d’essence produit une masse de CO2 d’environ 3,1 kg.
7. En déduire la masse de CO2 produite pour une quantité de 2,8.109 kg d’essence correspondant à la consommation mondiale journalière sans crise sanitaire.
| 1 kg d’essence | 3,1 Kg de CO2 |
| 2,8.109 kg d’essence | x |
![]()
x=8,69.109 Kg.
Une quantité de 2,8.109 kg d’essence correspondant à la consommation mondiale journalière sans crise sanitaire produit une masse de CO2 de 8,69.109 Kg.
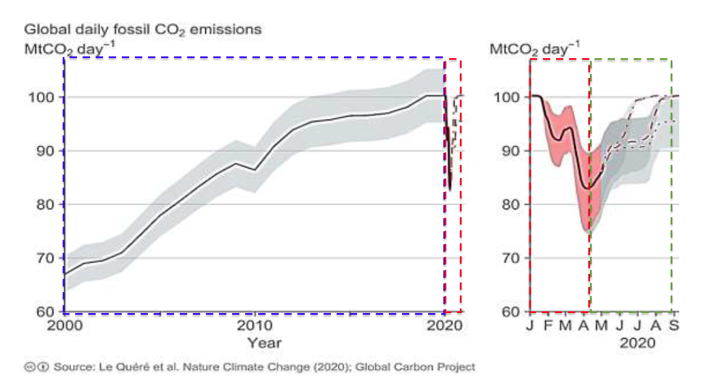
8. a- Comparer la valeur des émissions de CO2 calculée à la question 7 à la valeur lue sur le graphique du document 1 pour le mois d’avril 2020.
Graphiquement pour le mois d’avril 2020 la masse à la consommation mondiale journalière sans crise sanitaire produit une masse de CO2 de 83.109 Kg
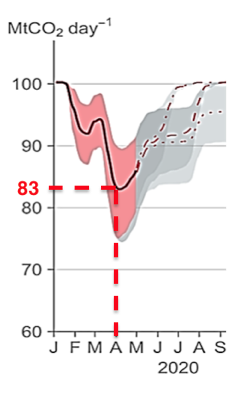
La masse lue sur le graphique est enivrons 10 fois supérieure à celle calculée à la question 7.
8. b- Formuler des hypothèses pour expliquer la différence constatée.
La différence constatée peut s’expliquer par les hypothèses suivantes :
- A la question 7 on calcul la production de CO2 produite à cause de la consommation d’essence. Graphiquement, il s’agit de la production de CO2 due à la consommation de toutes les énergies fossiles (pas que l’essence).
- La production mondiale de est due aussi à d’autres ressources que l’essence comme le gaz, charbon, pétrole…
