E3C2 – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02747 , n°G1SPHCH02757 et n°G1SPHCH02766
Télécharger l’exercice en PDF :
Les esters sont des espèces chimiques qui ont souvent une odeur agréable (rose, jasmin, lavande…). Ils sont parfois à l’origine d’arômes naturels fruités et sont très fréquemment synthétisés pour être utilisés comme arômes alimentaires.
L’un des enjeux est désormais de produire les espèces chimiques en respectant les critères de la chimie verte, notamment en utilisant moins de solvants, des réactifs et solvants peu toxiques, en produisant moins de déchets et en économisant l’énergie.
Les synthèses réalisées sous micro-ondes répondent aux critères de la chimie verte et sont de plus en plus utilisées à l’échelle du laboratoire, mais également à l’échelle industrielle.
Cet exercice propose d’étudier quelques esters présents dans les arômes alimentaires et de comparer les rendements d’une estérification effectuée selon deux protocoles, l’un effectué avec un chauffage usuel et l’autre sous micro-ondes.
Esters présents dans des arômes alimentaires.
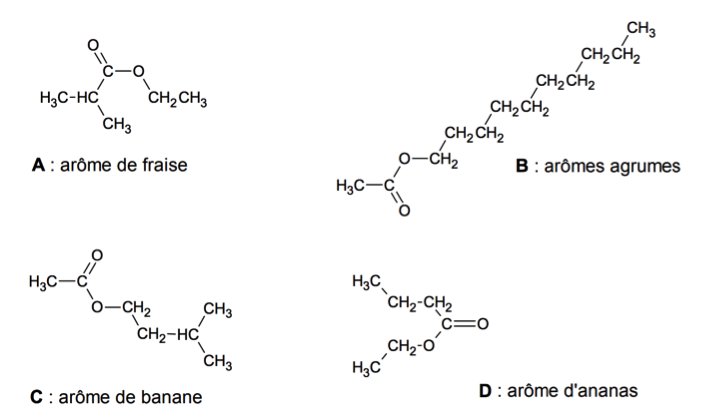
1. L’arôme de fraise
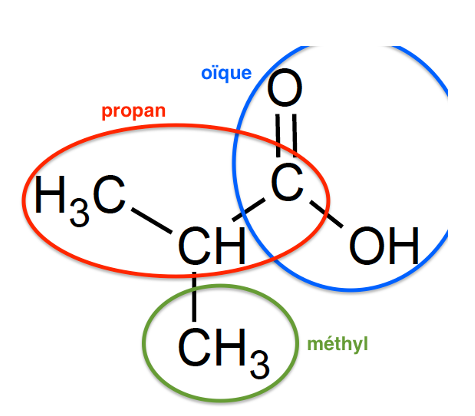
L’acide méthylpropanoïque est l’un des réactifs utilisés pour la synthèse de l’ester A, il est présent parmi les trois composés oxygénés E, F et G dont les formules semi-développées sont données ci-dessous.
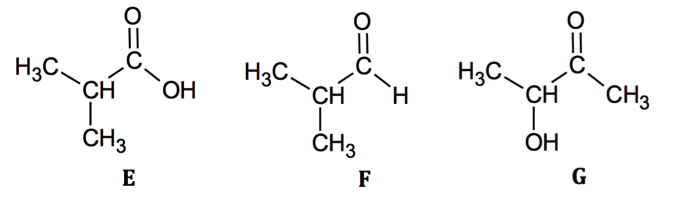
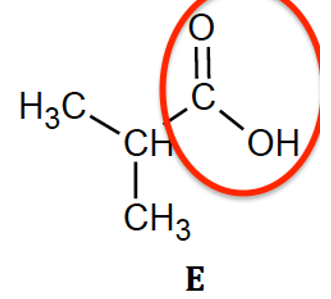
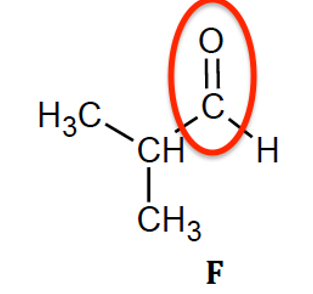
1.1. Recopier les formules des molécules de ces trois composés, puis entourer et nommer les familles de composés associées.
Acides carboxyliques
Aldéhydes
Cétone
Alcools
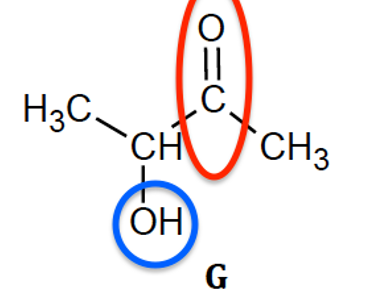
1.2. Identifier l’acide méthylpropanoïque parmi les trois composés E, F et G. Justifier son nom.
méthylpropanoïque : molécule E
méthylpropanoïque :
oïque : Famille des acides carboxyliques -COOH
méthyl : ramification –CH3
propan : chaine carbonée composée de 3 atomes de carbone
2. L’arôme d’agrumes
Le composé H, dont une formule est représentée ci-après, est un des réactifs utilisés pour synthétiser l’ester B à l’arôme d’agrumes.
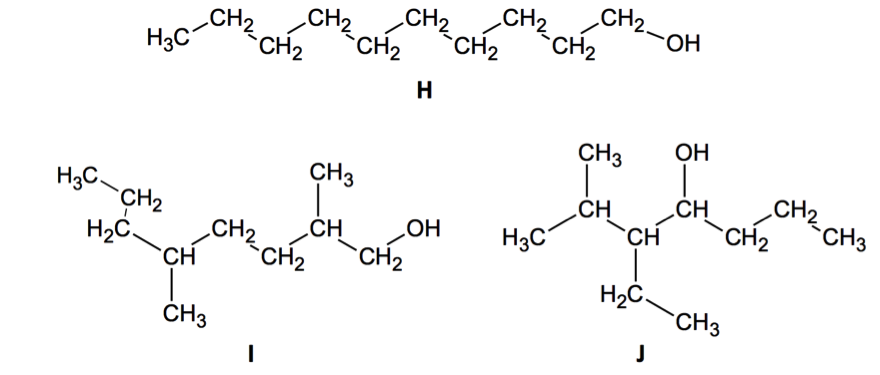
2.1. Les composés H, I et J sont-ils des isomères ? Justifier.
Formule brute de H : C10H22O
Formule brute de I : C10H22O
Formule brute de J : C10H22O
Les composés H, I et J ont la même formule brute et des formules développées différentes : ils sont isomères.
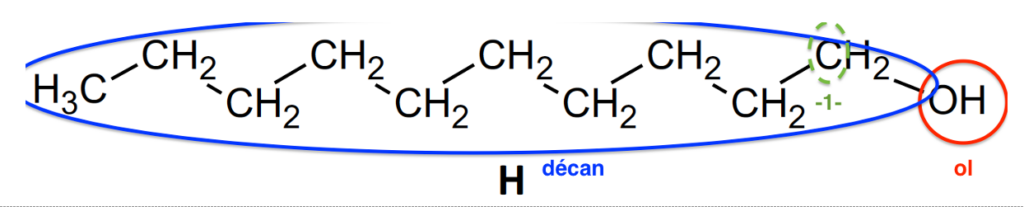
2.2. Le composé H est appelé décan-1-ol. Justifier son nom.
décan-1-ol :
décan : chaine carbonée composée de 10 atomes de carbone
ol : Famille des alcools -OH
-1- : le groupe hydroxyle (-OH) est positionné sur le 1er atome de carbone
2.3. Représenter, sur votre copie, la formule topologique du composé I, puis entourer sa chaîne carbonée la plus longue et nommer le(s) groupe(s) substitués(s) sur cette chaine et caractéristique(s) éventuel(s).
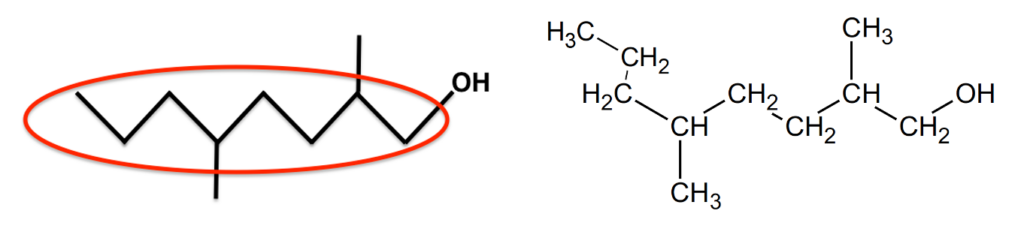
Les groupes substitués sur cette chaine : deux groupes méthyles CH3.
Le groupe caractéristique : un groupe caractéristique hydroxyle OH.
3. Synthèse d’un ester à l’arôme d’ananas : comparaison des rendements obtenus par deux protocoles différents
L’équation de la réaction modélisant la synthèse de l’ester D de formule brute C6H12O2 présent dans l’arôme d’ananas est :
C4H8O2(l) +C2H6O(l) ⇆ C6H12O2(l) +H2O(l)
Données
Caractéristiques physiques de quelques composés
| Éthanol | Acide butanoïque | Ester D | |
| Solubilité dans l’eau | forte | forte | faible |
| Température d’ébullition (°C) | 79 | 164 | 121 |
| Masse volumique (g.cm-3) | 0,79 | 0,96 | 0,88 |
| Masse molaire (g.mol-1) | 46 | 88 | 116 |
Il est possible de réaliser la synthèse de l’ester D selon deux protocoles.
Protocole n°1 : synthèse par chauffage à reflux
Ce protocole permet d’obtenir un rendement maximal de 67% si les deux réactifs sont introduits en quantités de matière égales. Pour l’augmenter, il est possible entre autres, d’introduire l’un des réactifs en excès. C’est le choix fait dans le protocole qui suit.
- Introduire dans un ballon, 40,0 mL d’éthanol, 40,0 mL d’acide butanoïque et 1,0 mL d’acide sulfurique concentré.
- Chauffer à reflux pendant 30 min.
- Refroidir jusqu’à température ambiante puis verser le contenu du ballon dans un bécher contenant 100 mL d’eau salée.
- Transvaser le mélange dans une ampoule à décanter.
- Isoler et laver la phase organique. On obtient une masse de 35,7 g d’ester.
Protocole n°2 : synthèse sous micro-ondes
Pour ce protocole, on choisit délibérément de mélanger les deux réactifs en quantités de matière égales.
- Introduire dans un bécher, 25,4 mL d’éthanol (soit 4,36 x 10-1 mol), 40 mL d’acide butanoïque (soit 4,36 x 10-1 mol) et 1 mL d’acide sulfurique concentré.
- Placer le bécher dans le four à micro-ondes et irradier la solution par de courtes périodes à 1000 W.
- Transvaser le mélange dans une ampoule à décanter.
- Isoler et laver la phase organique. On obtient une masse de 47,5 g d’ester.
3.1. Étude du protocole n°1
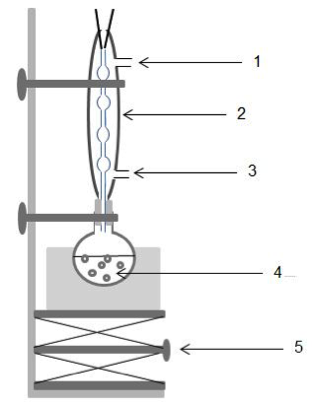
3.1.1. Légender le schéma du dispositif de chauffage à reflux en attribuant à chaque chiffre (1, 2, 3, 4, 5), l’indication la plus pertinente. Et décrire le rôle de chacun de ces éléments.
1 : Sortie d’eau
2 : Réfrigérant
3 : Entrée d’eau
4 : Mélange réactionnel
5 : Support élévateur

Le mélange réactionnel (4) est introduit dans un chauffe ballon pour accélérer la réaction. En cas de problème de chauffe avec le ballon, le support élévateur (5) permet de descendre le chauffe ballon et donc de le séparer du ballon afin de l’éloigner de la source de chaleur.
Lorsque le mélange réactionnel chauffe, des vapeurs se forment e s’échappent du ballon. Afin de ne pas perdre de la matière, un réfrigérant (2) est monté sur le ballon. Les vapeurs arrivant dans le réfrigérant se condensent et retombent dans le ballon.
Pour que le refroidissement soit le plus efficace possible, il faut que l’entrée d’eau froide se fasse par le bas (3) et que la sortie se fasse par le haut (1).
3.1.2. Expliquer l’intérêt de verser, après les 30 min de chauffage, le mélange réactionnel refroidi dans de l’eau salée.
Une fois la réaction terminée, il faut séparer l’ester du mélange. L’ester est faiblement soluble dans l’eau. En mettant de l’eau salée, la solubilité de l’ester diminue. Ainsi l’opération de séparation est facilitée.
3.2. Détermination du rendement obtenu en suivant le protocole n°1
3.2.1. Déterminer le réactif limitant lors de la mise en œuvre du protocole n°1.
$$C_4H_8O_{2(l)} + C_2H_6O_{(l)} \rightleftharpoons C_6H_{12}O_{2(l)} + H_2O_{(l)}$$
$$n=\frac{m}{M}$$
Or
$$\rho=\frac{m}{V}$$
$$m=\rho\times V$$
d’ou
$$n=\frac{\rho\times V}{M}$$
$$n_{éthanol}=\frac{\rho_{éthanol}\times V_{éthanol}}{M_{éthanol}}=\frac{0,79\times 40,0}{46}=0,69\ \text{mol}$$
$$n_{acide\ butanoïque}=\frac{\rho_{acide\ butanoïque}\times V_{acide\ butanoïque}}{M_{acide\ butanoïque}}=\frac{0,96\times 40,0}{88}=0,44\ \text{mol}$$
Les coefficients stœchiométriques sont égaux à 1, nacide butanoïque <néthanol, l’acide butanoïque est le réactif limitant.
3.2.2. En déduire le rendement de la synthèse. Commenter.
$$\eta=\frac{n_{ester}^{Experimental}}{n_{ester}^{Théorique}}$$
Avec :
$$n_{ester}^{Experimental}=\frac{m_{ester}}{M_{ester}}$$
$$n_{ester}^{Théorique}=x_{max}=n_{acide\ butanoïque}$$
D’ou
$$\eta=\frac{m_{ester}}{M_{ester}\times n_{acide\ butanoïque}}$$
$$\eta=\frac{35,7}{116\times 0,44}=0,70=70%$$
Commenter : d’après le texte « Ce protocole permet d’obtenir un rendement maximal de 67% si les deux réactifs sont introduits en quantités de matière égales ». Ici le rendement est supérieur. Cette différence peut s’expliquer par le fait que les deux réactifs ne sont pas introduits en quantités de matière égales.
3.3. Calculer le rendement de la synthèse obtenu à partir du protocole n°2. Proposer, en quelques lignes, une analyse comparative critique des deux protocoles.
Les deux réactifs en quantités de matière égales : $4,36\times 10^{-1}\ \text{mol}$
Calculons le rendement :
$$\eta=\frac{n_{ester}^{Experimental}}{n_{ester}^{Théorique}}$$
Avec :
$$n_{ester}^{Experimental}=\frac{m_{ester}}{M_{ester}}$$
$$n_{ester}^{Théorique}=x_{max}=4,36\times 10^{-1}\ \text{mol}$$
D’ou
$$\eta=\frac{m_{ester}}{M_{ester}\times x_{max}}$$
$$\eta=\frac{47,5}{116\times 4,36\times 10^{-1}}=0,939=93,9%$$
Le rendement est supérieur au protocole 1. Les quantités de réactifs utilisées sont plus faibles et la quantité de matière d’ester produite est plus grande.
Dans le protocole 1 il faut chauffer à reflux pendant 30 min alors que dans le protocole 2 on utilise un four à micro-ondes pendant de courtes périodes. Le protocole 2 consomme moins d’énergie.
En conclusion, le protocole 2 est préférable car le rendement est plus important et il est plus respectueux de la nature que le protocole 1.
