E3C2 – 10 points – Durée 1h – calculatrice autorisée
Paracelse, Cavendish, Lavoisier sont quelques-uns des scientifiques rattachés à l’histoire du dihydrogène, gaz inodore et incolore, découvert depuis plus de trois siècles. On le produisait à l’époque en faisant réagir de l’acide sulfurique ou de l’acide chlorhydrique sur différents métaux comme le fer, le zinc ou encore l’étain.
Les frères Montgolfier, Jacques Charles et Nicolas Robert qui avaient construit le premier ballon à air chaud, mirent au point le premier ballon à gaz, rempli de dihydrogène. Le 27 août 1783, ce ballon s’éleva dans les airs depuis le Champ-de-Mars à Paris. Plus tard, d’autres ballons ont été construits et équipés de moteurs, ouvrant au début du 20ème siècle, une nouvelle technique de navigation aérienne avec les dirigeables, comme ceux construit par la société allemande Zeppelin.

Cet exercice a pour objectif, l’étude d’une transformation chimique permettant de produire du dihydrogène, puis l’interprétation de l’accident survenu en 1937 à l’Hindenburg, un ballon dirigeable gonflé au dihydrogène.
1. Étude d’une transformation chimique permettant de produire du dihydrogène
Pour observer cette transformation, on réalise le montage représenté ci-contre. On introduit dans un erlenmeyer un morceau de ruban de magnésium Mg(s), de masse m= 40 mg, et un volume Va = 100mL d’acide chlorhydrique (H+(aq) + Cl– (aq)), solution aqueuse Sa de concentration en ions H+(aq) égale à Ca = 5,0×10–1 mol.L–1.
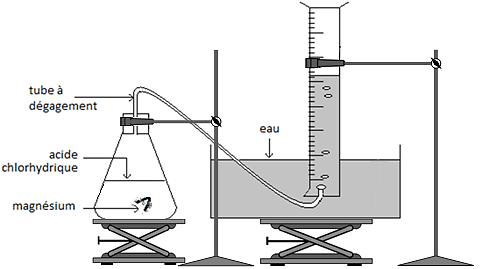
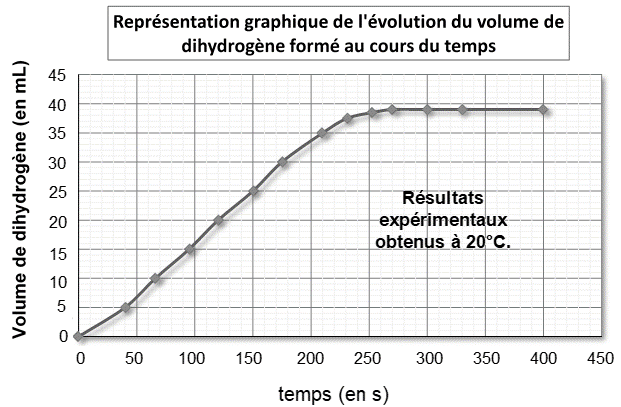
En réalisant l’expérience à 20 °C, on recueille, par déplacement d’eau, un gaz que l’on peut identifier à du dihydrogène dont on relève à intervalle de temps réguliers le volume dégagé et l’on obtient le graphique représenté ci-après.
L’équation de la réaction modélisant la transformation chimique s’écrit :
Mg(s) + 2 H+(aq) → Mg2+(aq) + H2(g)
Données
- Volume molaire des gaz dans les conditions de l’expérience :Vm = 24,0 L.mol-1.
- Couples oxydant-réducteur : Mg2+(aq) /Mg(s) et H+(aq)/H2 (g)
- Masse molaire atomique du magnésium : M(Mg) = 24,3 g.mol–1
- Pictogrammes de sécurité :
| Magnésium en ruban | Acide chlorhydrique | Dihydrogène |
|---|---|---|
 |  |  |
1.1. Quelle(s) précaution(s) faut-il prendre pour manipuler de l’acide chlorhydrique ?
1.2. Proposer un test pour montrer que le gaz formé au cours de cette transformation chimique est bien du dihydrogène.
1.3. Identifier parmi les réactifs, celui qui joue le rôle d’oxydant et celui qui joue le rôle de le réducteur.
1.4. Déterminer les quantités de matière initiales des réactifs.
1.5. Compléter le tableau d’avancement en annexe à rendre avec la copie et identifier le réactif limitant de cette transformation chimique.
1.6. Montrer qu’en fin de transformation une quantité nH2= 1,6.10–3 mol de dihydrogène pourrait être formé si la transformation est totale.
1.7. A partir des mesures expérimentales effectuées :
- déterminer quand la transformation peut être considérée comme terminée ;
- relever la valeur du volume Vexp H2 de dihydrogène obtenu à la fin de l’expérience.
1.8. Peut-on considérer que la transformation étudiée est une transformation totale ? Justifier.
2. Un accident de dirigeable gonflé au dihydrogène qui a marqué l’histoire
L’Hindenburg a été le 129ème dirigeable construit par la société allemande Zeppelin entre 1935 et 1936. Dirigeable le plus grand et le plus luxueux jamais construit, avec ses dimensions hors normes de plus de 240 m de long, il pouvait accueillir 124 personnes et comportait une salle à manger, un salon de lecture, un fumoir, des cuisines et plusieurs cabines. Disposant d’un volume de dihydrogène de près de 200 000 m3 et de 4 moteurs il affichait une vitesse de croisière de plus de 120 km.h-1. Le 6 mai 1937, lors de son 63ème voyage et après 77 heures de vol, il s’est écrasé à l’atterrissage à Lakehurst dans le New Jersey.

On explique aujourd’hui cet accident de la façon suivante : après trois jours de vol, le dirigeable chargé d’électricité statique et après avoir rencontré un orage aurait connu une défaillance technique engendrant une fuite de dihydrogène. Une décharge d’électricité statique créée lorsqu’une des amarres du dirigeable a touché le sol aurait amorcé la combustion du dihydrogène, réaction du dihydrogène avec le dioxygène de l’air.
Données
- Équation de la réaction modélisant la combustion du dihydrogène :
H2 (g) + 1/2 O2 (g) → H2O (l)
- Numéros atomiques : H (Z = 1) ; O (Z = 8)
- Énergies de liaison
| Liaison | H – H | O = O | O – H |
| Énergie de liaison (en kJ.mol-1) | DH – H = 436 | DO=O= 496 | DO – H = 463 |
- Volume molaire des gaz à 20°C : Vm = 24,0 L.mol-1
- Le TNT (trinitrotoluène) est un explosif. On compare souvent les énergies produites lors des explosions en équivalent TNT, l’explosion d’un gramme de TNT libérant une énergie de 4184 J.
2.1. Établir les schémas de Lewis des molécules H2, O2 et H2O.
2.2. Identifier la nature et le nombre de liaisons rompues et formées au cours de la combustion du dihydrogène.
2.3. Combien de tonnes de TNT produiraient une énergie équivalente lors de son explosion à celle produite par l’explosion du dihydrogène contenu dans l’Hindenburg ?
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti.
ANNEXE A RENDRE AVEC LA COPIE
Question 1.5 :
| Équation de la réaction | Mg(s) + | 2 H+(aq) | → Mg2+(aq) | H2(g) | |
| État du système | Avancement (mol) | n(Mg) | n(H+) | n(Mg2+) | n(H2) |
| État initial | 0 | ||||
| État en cours de transformation | x | ||||
| État final | xmax |
