E3C2 – 10 points – Durée 1h – calculatrice autorisée
Au début du mois de juin 2019, le projet de loi « mobilités » a été présenté et discuté à l’Assemblée nationale. Son ambition est d’améliorer concrètement les déplacements au quotidien pour tous les citoyens français et dans tous les territoires.
Sachant que les transports représentent 30 % des émissions de gaz à effet de serre, ils constituent le premier secteur émetteur et leur impact environnemental est donc majeur. Pour répondre aux enjeux, l’un des trois piliers de ce projet de loi s’intitule « Engager la transition vers une mobilité plus propre ».
d’après https://www.ecologique-solidaire.gouv.fr/
L’objectif de cet exercice est d’étudier deux solutions mises en œuvre aujourd’hui pour limiter l’impact écologique du transport routier.
Données
| Élément | H | O | C | N |
| Numéro atomique | 1 | 8 | 6 | 7 |
| Masse molaire atomique (en g.mol-1) | 1,0 | 16,0 | 12,0 | 14,0 |
| Configuration électronique | (1s)1 | (1s)2(2s)2(2p)4 | (1s)2(2s)2(2p)2 | (1s)2(2s)2(2p)3 |
| Électronégativité (échelle de Pauling) | 2,2 | 3,4 | 2,5 | 3,0 |
Masse volumique de l’éthanol : ρ(éthanol) = 789 g.L-1
Énergie molaire de liaison en phase gazeuse (en kJ.mol-1) :
| E(H – H) | E(C – H) | E(C – C) | E(C – O) | E(O – H) | E(O = O) | E(C = O) (dans CO2) |
| 436 | 415 | 346 | 358 | 463 | 497 | 804 |
- L’évolution du parc automobile français
Le projet de « loi mobilités » fixe la fin des moteurs à combustion en 2040. Cet objectif sans précédent annonce de profonds changements pour les constructeurs automobiles. Le document suivant retrace l’évolution de la répartition des immatriculations des véhicules légers vendus en France entre l’année 2015 et le milieu de l’année 2019.
| 2015 | 2016 | 2017 | 2018 | 2019 (janvier à juin) | |
| Essence | 38,56 % | 43,82 % | 47,58 % | 54,67 % | 58,82 % |
| Diesel | 57,22 % | 52,12 % | 47,29 % | 38,87 % | 34,26 % |
| Hybride (électrique + essence/diesel) | 3,21 % | 2,90 % | 3,86 % | 4,89 % | 4,96 % |
| Électrique | 0,90 % | 1,08 % | 1,18 % | 1,43 % | 1,80 % |
| Autre | 0,11 % | 0,08 % | 0,09 % | 0,14 % | 0,16 % |
d’après https://ccfa.fr/ Comité des Constructeurs Français d’Automobiles
1.1. Définir une réaction de combustion.
1.2. En exploitant les données du tableau précédent, expliquer pourquoi les constructeurs automobiles sont encore aujourd’hui dans l’obligation de développer des moyens pour limiter les polluants rejetés par les véhicules fonctionnant à partir d’une réaction de combustion.
2. Cas des moteurs fonctionnant à l’essence : le bioéthanol.
Face à la hausse des coûts des produits pétroliers et pour limiter l’impact écologique, l’usage de carburants obtenus à partir de végétaux cultivés ou de résidus de cultures vivrières(1) se développe. Ces carburants sont appelés « biocarburants » ou encore « agrocarburants ». Pour les véhicules à essence, il est possible d’ajouter de l’éthanol (« bioéthanol ») à l’essence usuelle ; depuis l’année 2010, les véhicules neufs peuvent rouler avec un carburant contenant jusqu’à 10 % d’éthanol et nommé 95-E10.
(1) cultures vivrières : se dit des cultures dont les produits sont destinés à l’alimentation humaine
2.1. Obtention du « bioéthanol »
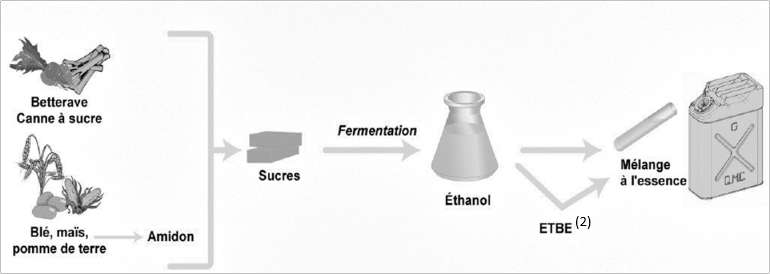
Les végétaux contiennent des sucres (comme le saccharose). L’hydrolyse du saccharose C12H22O11, réaction du saccharose avec de l’eau, donne du glucose et du fructose, composés chimiques de même formule brute C6H12O6. Ensuite, la fermentation du glucose permet d’obtenir de l’éthanol et du dioxyde de carbone.
2.1.1. Écrire l’équation de la réaction modélisant l’hydrolyse du saccharose et celle modélisant la fermentation du glucose.
2.1.2. Pour extraire l’éthanol du moût de fermentation, une distillation est nécessaire. Parmi les deux montages proposés en annexe à rendre avec la copie, identifier le montage à utiliser puis annoter-le.
2.2. Énergie molaire de la réaction de combustion de l’éthanol
La combustion de l’éthanol est modélisée par la réaction d’équation suivante :
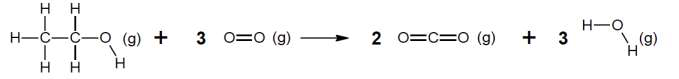
2.2.1. Compléter le tableau fourni en annexe à rendre avec la copie en dénombrant les liaisons rompues et formées au cours de la réaction de combustion de l’éthanol.
2.2.2. Exprimer, puis calculer l’énergie molaire de la réaction de combustion de l’éthanol en fonction des énergies molaires de liaison. Interpréter le signe de cette valeur.
2.2.3. Un litre d’essence ne contenant pas de bioéthanol libère une énergie équivalente à 35,5 MJ. Indiquer si l’ajout d’éthanol modifie le pouvoir calorifique du carburant.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
3. Cas des moteurs fonctionnant au diesel : les technologies DOC et SCR
En 2014, la norme Euro 6 (norme européenne) est entrée en vigueur. Sixième du nom, elle fixe d’une façon très précise le niveau de rejet de quatre polluants présents dans les gaz d’échappement des véhicules immatriculés dans les pays d’Europe de l’Ouest :
- NOx : les oxydes d’azote NO2 et NO ;
- HC : les hydrocarbures n’ayant pas été consommés dans la chambre de combustion ;
- CO : le monoxyde de carbone ;
- PM : les particules fines.
Pour répondre aux dernières exigences européennes, les constructeurs doivent équiper leurs véhicules de dispositifs pour traiter ces polluants avant qu’ils ne s’échappent dans l’atmosphère. Dans la suite du sujet, on s’intéressera à deux d’entre eux : le DOC (Diesel Oxydation Catalyst) et le SCR (Selective Catalyst Reduction).
Descriptif de traitement des gaz d’échappement :
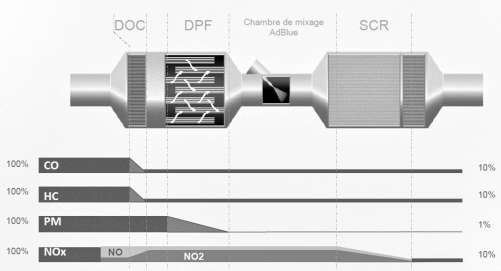
3.1. Le dispositif DOC
Les gaz d’échappement traversent une surface imprégnée de métaux précieux favorisant leur réaction à haute température avec le dioxygène de l’air.
D’après le document constructeur décrivant le traitement des gaz d’échappement, donner le polluant sur lequel le DOC est inactif.
3.2. Le dispositif SCR
Le principe de ce dispositif repose sur l’usage d’un additif de type Adblue®. L’additif est une solution incolore et biodégradable contenant 32,5 % d’urée, de formule brute CON2H4, et 67,5 % d’eau.
Le schéma de Lewis de la molécule d’urée est représenté ci-dessous :
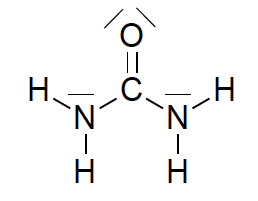
3.2.1. Dénombrer le nombre d’électrons de valence des atomes de carbone, d’oxygène, d’azote et d’hydrogène et justifier succinctement le schéma de Lewis de la molécule d’urée.
3.2.3. Choisir parmi les formes géométriques suivantes -pyramidale, tétraédrique ou triangulaire- celle formée par les trois atomes autour de l’atome de carbone central. Justifier.
Annexe à rendre avec la copie
Question 2.1.2.
| MONTAGE A | 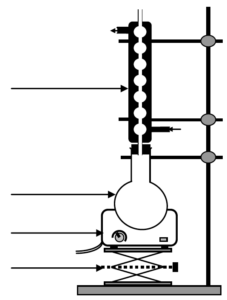 |
|---|---|
| MONTAGE B | 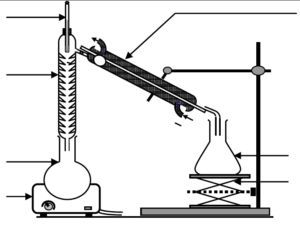 |
Question 2.2.1.
| Liaisons | C – H | C – O | O – H | C – C | O = O | C = O |
| Rompues | ||||||
| Formées |
