ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH117 et n°SPEPHCH122
Télécharger l’exercice en PDF :
Lorsque le lavage des mains avec de l’eau et du savon n’est pas possible, les produits hydro- alcooliques font partie des solutions les plus efficaces pour l’inactivation rapide d’un large éventail de micro-organismes qui peuvent être présents sur les mains. Les pharmaciens peuvent, sous certaines conditions particulières, fabriquer une solution hydro-alcoolique conforme aux directives de l’Organisation Mondiale de la Santé (OMS).
Quatre formules de solutions ou gels hydro-alcooliques ont été autorisées en juin 2020 par le ministère des solidarités et de la santé. Ces formules présentent une activité virucide dès lors qu’elles respectent la teneur minimale d’alcool recommandée par les autorités sanitaires. Les limites d’acceptabilité sont de +/- 5 % (% en volume) de la teneur en alcool.
L’une de ces formules est présentée ci-dessous :
Formule n°1 – Solution hydro-alcoolique à base d’éthanol de teneur en alcool égale à 80 % (% en volume – correspond au volume d’éthanol en mL contenu dans 100 mL de solution hydro- alcoolique) :
| Composants introduits dans la formule n°1 de la solution hydro-alcoolique | Quantité | Fonction |
| Ethanol à 96 % (en volume) | 833,3 mL | Substance active |
| Peroxyde d’hydrogène, solution à 3 % (contient 3 g de peroxyde d’hydrogène pour 100 mL de solution) | 41,7 mL | Inactivateur de spores |
| Glycérol | 14,5 mL | Humectant |
| Eau purifiée q. s. p. | 1000 mL | Solvant |
Données :
- Electronégativités de quelques atomes : carbone χ(C) = 2,55 ; hydrogène χ(H) = 2,20 ; oxygène χ(O) = 3,44.
- Masse molaire moléculaire du peroxyde d’hydrogène : M(H2O2) = 34,0 g·mol-1
- Une solution de peroxyde d’hydrogène à 3 % contient 3 g de peroxyde d’hydrogène pour 100 mL de solution
- Extrait d’une table spectroscopique IR :
| Type de liaison | Nombre d’onde σ (cm– 1) | Forme de la bande |
| Liaison C – H | 2900 – 3100 | Moyenne |
| Liaison C = C | 1620 – 1690 | Moyenne |
| Liaison O – H (alcool) | 3200 – 3600 | Intense et large |
| Liaison O – H (acide carboxylique) | 2500 – 3200 | Intense et très large |
| Liaison C = O (acide carboxylique) | 1700 – 1725 | Intense |
| Liaison C = O (aldéhyde et cétone) | 1700 – 1740 | Intense |
Le glycérol, un composant de la solution hydro-alcoolique
Le glycérol est un liquide visqueux, incolore et inodore, miscible dans les solvants polaires, comme l’eau et l’éthanol.
Dans la nomenclature officielle le nom du glycérol est le propan–1,2,3–triol et sa formule semi- développée est représentée ci-dessous :
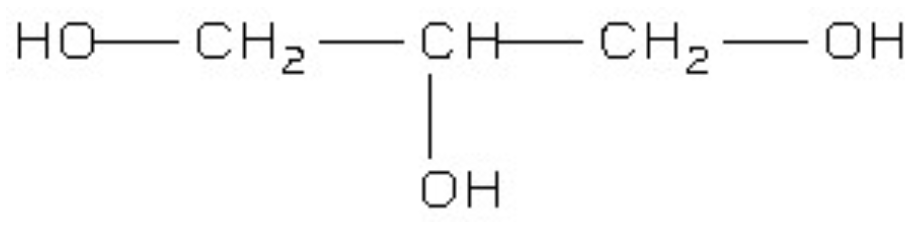
1. Indiquer si le glycérol est une molécule polaire ou apolaire. Justifier.
Calculons la différence d’électronégativité entre l’atome d’oxygène et l’atome d’hydrogène :
∆χ=χ(O)-χ(H)
∆χ=3,44-2,20
∆χ=1,24
∆χ>0,4 : la liaison O—H est polaire.
Calculons la différence d’électronégativité entre l’atome de carbone et l’atome d’hydrogène :
∆χ=χ(C)-χ(H)
∆χ=2,55-2,20
∆χ=0,35
0≤∆χ≤0,4 : la liaison C—H n’est polaire.
Calculons la différence d’électronégativité entre l’atome d’oxygène et l’atome de carbone :
∆χ=χ(O)-χ(C)
∆χ=3,44-2,55
∆χ=0,89
∆χ>0,4 : la liaison C—O est polaire.
Le glycérol à des liaisons O—H et C—O sui sont polaires. Le glycérol est une molécule polaire.
2. Recopier cette formule semi-développée. Entourer et nommer les groupes caractéristiques présents dans la molécule de glycérol.
Groupe caractéristique : hydroxyle
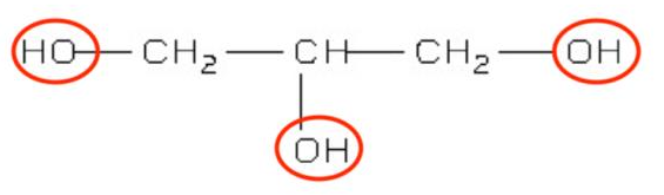
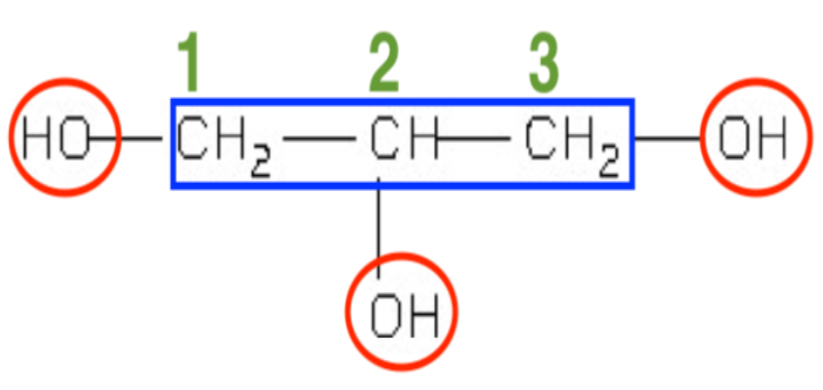
3. Justifier, à l’aide de sa formule semi-développée, le nom du glycérol dans la nomenclature officielle, le propan–1,2,3–triol.
La molécule porte trois atomes de carbone : propan
La molécule porte trois groupes hydroxyles de la famille des alcools : tri ol
Le premier groupe hydroxyle est porté par le premier atome de carbone : 1
Le deuxième groupe hydroxyle est porté par le deuxième atome de carbone : 2
Le troisième groupe hydroxyle est porté par le troisième atome de carbone : 3
Nom de la molécule représentée : propan –1,2,3– tri ol
4. Etablir le schéma de Lewis de la molécule de glycérol et de la molécule d’eau.
- Z(C) = 6 : Configuration électronique du carbone : 1s2 2s2 2p2.
Électrons de valence du carbone : 2+2=4
Structure électronique du gaz noble le plus proche : 1s2 2s2 2p6
Électrons engagés dans une liaison covalente : 8−4=4
Doublets liants : 4
Électrons non engagés dans une liaison covalente : 4−4=0
Doublets non liants : 0/2=0
Le carbone à 4 liaisons covalentes et 0 doublets non liants.
• Z(O) = 8 Configuration électronique de l’oxygène : 1s2 2s2 2p4.
Électrons de valence de l’oxygène : 2+4=6
Structure électronique du gaz noble le plus proche : 1s2 2s2 2p6
Électrons engagés dans une liaison covalente : 8−6=2
Doublets liants : 2
Électrons non engagés dans une liaison covalente : 6−2=4
Doublets non liants : 4/2=2
L’oxygène à 2 liaisons covalentes et 2 doublets non liants.
- Z(H) = 1 : Configuration électronique de l’hydrogène : 1s1.
Électrons de valence de l’hydrogène : 1=1
Structure électronique du gaz noble le plus proche : 1s2
Électrons engagés dans une liaison covalente : 2−1=1
Doublets liants : 1
Électrons non engagés dans une liaison covalente : 1−1=0
Doublets non liants : 0/2=0
L’hydrogène à 1 liaison covalentes et 0 doublets non liants.
Schéma de Lewis de la molécule de glycérol :
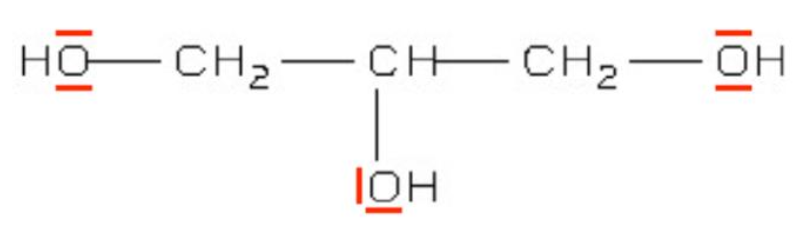
Schéma de Lewis de la molécule d’eau H2O. :
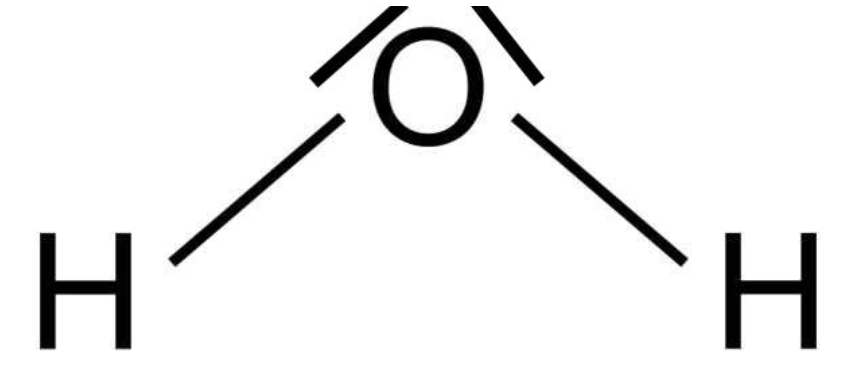
La très grande affinité du glycérol avec l’eau s’explique par l’existence de ponts hydrogène entre une molécule de glycérol et une molécule d’eau.
5. Justifier l’existence de ces ponts hydrogène et les représenter sur un schéma.
L’eau est une molécule polaire et la molécule de glycérol possède des atomes d’oxygène qui sont très électronégatifs.
Elles établissent entre elles des liaisons hydrogène.
Ces liaisons hydrogènes peuvent s’établir entre un atome d’hydrogène lié à un atome A et un atome B. Les atomes A et B pouvant être l’oxygène, le fluor ou l’azote (atomes de grande électronégativité).
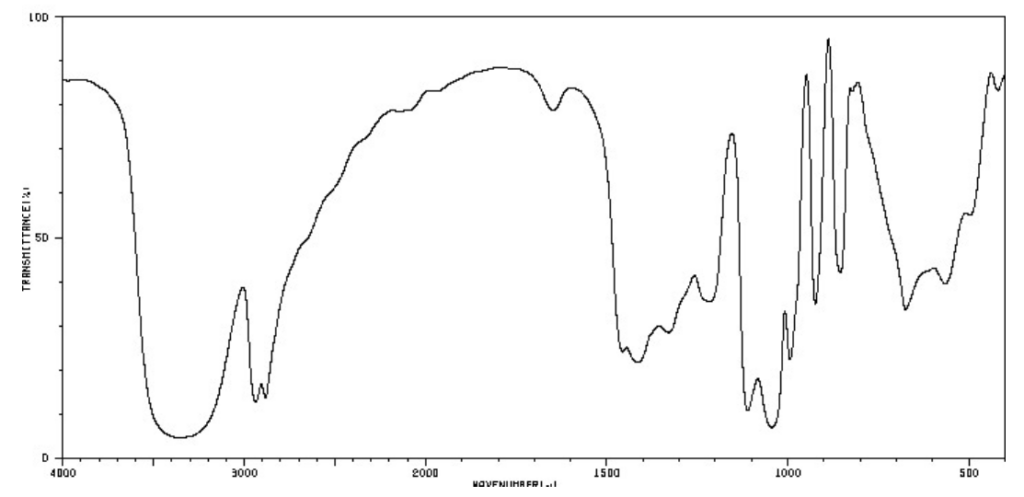
Deux spectres infra-rouge de deux espèces chimiques sont représentés ci-dessous :
Spectre n°1
Spectre n°2
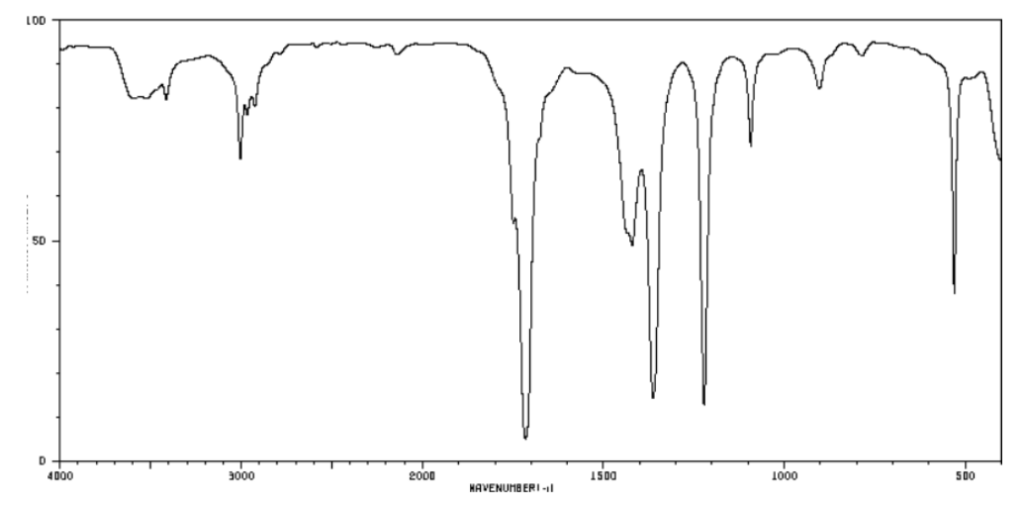
6. Indiquer le spectre IR qui correspond au glycérol. Justifier.
D’après la table spectroscopique IR pour la spectroscopie infrarouge, un alcool donne un spectre ayant :
Une bande Intense et large dont le nombre d’onde est compris entre 3200 et 3600 cm-1 pour la liaison O-H de l’alcool
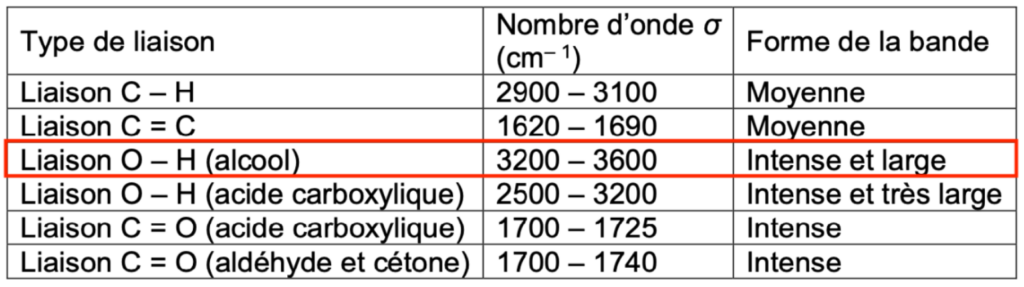
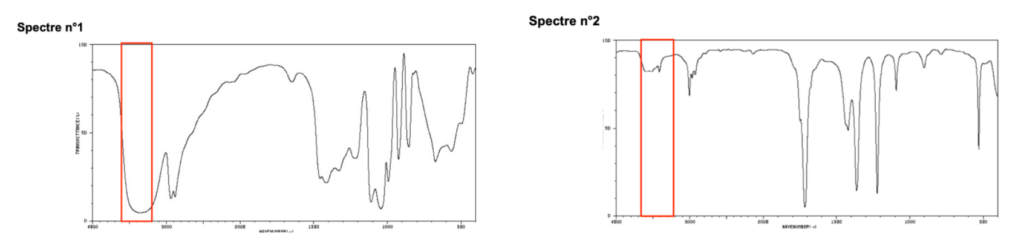
Cette bande caractéristique est présente dans le spectre 1 et n’est pas présente dans le spectre 2. Ainsi, le spectre IR qui correspond au glycérol est le spectre 1.
Contrôle qualité de la solution de peroxyde d’hydrogène utilisée lors de la préparation du gel hydroalcoolique.
L’eau oxygénée commerciale est une solution aqueuse de peroxyde d’hydrogène, H2O2(aq). A température ambiante, l’eau oxygénée peut se décomposer lentement. Après ouverture d’un flacon d’eau oxygénée, la teneur en peroxyde d’hydrogène peut ainsi diminuer légèrement et être en-dessous de celle annoncée par l’étiquette.
Un pharmacien dispose d’une solution commerciale d’eau oxygénée à 3 % en peroxyde d’hydrogène. Avant de préparer sa solution hydro-alcoolique, le pharmacien souhaite contrôler par titrage colorimétrique la concentration en peroxyde d’hydrogène dans l’eau oxygénée commerciale qu’il possède afin de vérifier qu’il n’est pas en-dessous de celle annoncée par l’étiquette. On appellera cette solution S0 et on notera C0 sa concentration en quantité de matière de peroxyde d’hydrogène.
Cette solution étant trop concentrée pour le titrage, il la dilue d’un facteur 20. On appellera cette nouvelle solution S1 et on notera C1 sa concentration en quantité de matière de peroxyde d’hydrogène.
Le pharmacien dispose de la verrerie suivante pour effectuer cette dilution :
- Eprouvettes graduées de 100 mL et 200 mL
- Pipettes graduées de 5,0 mL et 10,0 mL,
- Pipettes jaugées de 5,0 mL et 10,0 mL
- Fioles jaugées de 50,0 mL et 100,0 mL
7. Indiquer la verrerie que le pharmacien doit choisir dans cette liste afin de préparer la solution S1 le plus précisément possible. Justifier.
Il la dilue la solution d’un facteur 20 :
$$ F = \frac{V_1}{V_0} $$
$$ \frac{V_1}{V_0} = F $$
$$ V_1 = F \times V_0 $$
$$ V_1 = 20 \times V_0 $$
V1 est le volume de la fiole jaugée (volume de la solution fille) et V0 le volume de la pipette jaugée (volume de la solution mère).
Au vu du facteur de dilution, nous devons choisir une fiole jaugée qui a un volume 20 fois supérieur à celui d’une pipette jaugée.
Nous choisissons donc :
- Une pipette jaugée de volume V0=5,0 mL
- Une fiole jaugée de volume V1=100,0 mL.

Il titre un volume V1 = 5,0 mL de solution S1 par une solution acidifiée de permanganate de potassium (K+(aq) ; MnO4–(aq)) de concentration C2 = 1,0.10-2 mol·L-1. Le changement de teinte est obtenu pour un volume de solution titrante versée égal à VE = 9,5 mL.
Les couples oxydant-réducteur mis en jeu lors du titrage sont :
O2(g)/H2O2(aq) et MnO4–(aq)/Mn2+(aq).
8. Montrer que l’équation modélisant la réaction chimique support du titrage s’écrit :
5 H2O2(aq) + 2 MnO4–(aq) + 6 H+(aq) ⮕ 2 Mn2+(aq) + 5 O2(g) + 8 H2O(l)
D’après le sujet : une solution aqueuse de peroxyde d’hydrogène, H2O2(aq) est titré par une solution acidifiée de permanganate de potassium (K+(aq) + MnO4— (aq)) :
$\text{O}_2 (g)/\text{H}_2 \text{O}_2 (aq) \quad \text{∶ } \times 5 \quad \text{H}_2 \text{O}_2 (aq) = \text{O}_2 (g) + 2\text{H}^+ (aq) + 2e^-$
${MnO}_4^- (aq)/\text{Mn}^{2+} (aq) \quad \text{∶ } \times 2 \quad \text{MnO}_4^- (aq) + 8\text{H}^+ (aq) + 5e^- = \text{Mn}^{2+} (aq) + 4\text{H}_2 \text{O}(l)$
$2\text{MnO}_4^- (aq) + 16\text{H}^+ (aq) + 5\text{H}_2 \text{O}_2 (aq) \longrightarrow 2\text{Mn}^{2+} (aq) + 8\text{H}_2 \text{O}(l) + 5\text{O}_2 (g) + 10\text{H}^+ (aq)$
On simplifie de part et d’autre les ions H+ :
$2\text{MnO}_4^- (aq) + 6\text{H}^+ (aq) + 5\text{H}_2 \text{O}_2 (aq) \longrightarrow 2\text{Mn}^{2+} (aq) + 8\text{H}_2 \text{O}(l) + 5\text{O}_2 (g)$
Dans la même forme que le sujet :
$5\text{H}_2 \text{O}_2 (aq) + 2\text{MnO}_4^- (aq) + 6\text{H}^+ (aq) \longrightarrow 2\text{Mn}^{2+} (aq) + 5\text{O}_2 (g) + 8\text{H}_2 \text{O}(l)$
Les seules espèces chimiques colorées présentes dans le milieu réactionnel sont les ions permanganate MnO4–, de couleur violette.
9. Indiquer le changement de teinte observé lorsque l’équivalence du titrage est atteinte.
L’eau oxygénée est incolore et le permanganate de potassium est violet (question 1).
Avant l’équivalence, le permanganate de potassium est le réactif limitant et l’eau oxygénée le réactif en excès. Le mélange est de la couleur du réactif en excès : il est incolore.
Après l’équivalence, le permanganate de potassium est le réactif en excès et l’eau oxygénée le réactif limitant. Le mélange est de la couleur du réactif en excès : il est violet.
Ainsi, à l’équivalence on observe un changement de couleur de l’incolore au violet.
10. Démontrer, en explicitant la démarche, que la concentration C1 de la solution diluée d’eau oxygénée est proche de 0,0475 mol·L-1.
$5\text{H}_2 \text{O}_2 (aq) + 2\text{MnO}_4^- (aq) + 6\text{H}^+ (aq) \longrightarrow 2\text{Mn}^{2+} (aq) + 5\text{O}_2 (g) + 8\text{H}_2 \text{O}(l)$
À l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques :
$\frac{n(\text{H}_2 \text{O}_2)}{5} = \frac{n(\text{MnO}_4^-)_\text{vE}}{2}$
Ainsi :
$\frac{c_1 V_1}{5} = \frac{c_2 V_E}{2}$
$c_1 = \frac{5 \times c_2 V_E}{2 \times V_1}$
$c_1 = \frac{5 \times 1{,}0 \times 10^{-2} \times 9{,}5}{2 \times 5{,}0}$
$c_1 = 4{,}8 \times 10^{-2} \ \text{mol}\cdot\text{L}^{-1}$
Sans prendre en compte les chiffres significatifs :
$c_1 = 0{,}0475 \ \text{mol}\cdot\text{L}^{-1}$
11. Déterminer la valeur de la concentration C0 de la solution d’eau oxygénée commerciale et écrire le résultat de mesure avec un nombre adapté de chiffres significatifs sachant que l’incertitude-type associée à C0 est de 0,008 mol·L-1.
Il la dilue la solution d’un facteur 20 :
$F = \frac{C_0}{C_1}$
$\frac{C_0}{C_1} = F$
$C_0 = F \times C_1$
$C_0 = 20 \times 4{,}75 \times 10^{-2}$
$C_0 = 9{,}50 \times 10^{-1} \ \text{mol}\cdot\text{L}^{-1}$
Sachant que l’incertitude-type associée à $C_0$ est de $0{,}008 \ \text{mol}\cdot\text{L}^{-1}$ :
$C_0 = 9{,}50 \times 10^{-1} \pm 0{,}008 \ \text{mol}\cdot\text{L}^{-1}$
$C_0 = (9{,}50 \pm 0{,}08) \times 10^{-1} \ \text{mol}\cdot\text{L}^{-1}$
12. Indiquer si le pharmacien pourra utiliser cette solution d’eau oxygénée pour préparer la solution hydro-alcoolique sachant que sa teneur doit être égale ou supérieur à celle de 3 % indiquée sur l’étiquette.
D’après les données : Une solution de peroxyde d’hydrogène à 3 % contient 3 g de peroxyde d’hydrogène pour 100 mL de solution
Calculons la masse de peroxyde d’hydrogène pour 100 mL de solution :
\[ \mathrm{n = \frac{m}{M}}\]
\[ \mathrm{\frac{m}{M} = n}\]
\[ \mathrm{m = n \times M}\]
Or
$n = c \times V$
D’où
$m = c \times V \times M$
$m = 9{,}50 \times 10^{-1} \times 100 \times 10^{-3} \times 34{,}0$
$m = 3{,}23 \ \text{g}$
Cette solution de peroxyde d’hydrogène à 3 % contient 3,23 g de peroxyde d’hydrogène pour 100 mL de solution.
Ainsi, le pharmacien peut utiliser cette solution d’eau oxygénée pour préparer la solution hydro-alcoolique car sa teneur doit supérieur à celle de 3 % indiquée sur l’étiquette.
Un contrôle qualité de la solution hydro alcoolique finale – Le degré alcoolique
13. Montrer que la teneur en alcool de la solution hydro-alcoolique préparée selon la formulation n°1 présentée en introduction est bien de 80 % en volume.
Calculons le pourcentage volumique en alcool de la solution hydro-alcoolique préparée selon la formulation n°1 :
\[ \mathrm{P_{\text{éthanol,solution}} = \frac{V_{\text{éthanol pur}}}{V_{\text{solution}}} }\]
Or, pour l’éthanol à 96 % (en volume) :

\[ \mathrm{P_{\text{éthanol, dans l’éthanol à 96\%}} = \frac{V_{\text{éthanol pur}}}{V_{\text{éthanol à 96\%}}}}\]
\[ \mathrm{\frac{V_{\text{éthanol pur}}}{V_{\text{éthanol à 96\%}}} = P_{\text{éthanol, dans l’éthanol à 96\%}}}\]
\[ \mathrm{$V_{\text{éthanol pur}} = P_{\text{éthanol, dans l’éthanol à 96\%}} \times V_{\text{éthanol à 96\%}}}\]
D’où :
$P_{\text{éthanol, solution}} = \frac{P_{\text{éthanol, dans l’éthanol à 96\%}} \times V_{\text{éthanol à 96\%}}}{V_{\text{solution}}}$
$P_{\text{éthanol, solution}} = \frac{96/100 \times 833{,}3}{1000}$
$P_{\text{éthanol, solution}} = 0{,}80$
$P_{\text{éthanol, solution}} = 80 \%$
Ainsi, la teneur en alcool de la solution hydro-alcoolique préparée selon la formulation n°1 présentée en introduction est bien de 80 % en volume.
14. Le pharmacien plonge un alcoomètre dans la solution hydro-alcoolique qu’il vient de préparer. Il lit l’indication 82°, ce qui correspond à une teneur en alcool de 82 % en volume. Indiquer si cette solution est commercialisable. Justifier.
D’après le texte introductif : « Les limites d’acceptabilité sont de $\pm 5\%$ (% en volume) de la teneur en alcool. »
$P_{\text{éthanol, solution}} = 80\% \pm 5\%$
$75\% < P_{\text{éthanol, solution}} < 85\%$
Une teneur en alcool de 82 % en volume est comprise dans les limites d’acceptabilité : cette solution est donc commercialisable.
