ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH118 et n°SPEPHCH123
Télécharger l’exercice en PDF :
La gaulthérie couchée, composée à 99 % de salicylate de méthyle, est une plante bien connue des amérindiens qui l’utilisaient contre les douleurs et les fièvres. Aujourd’hui le salicylate de méthyle est synthétisé en laboratoire et se retrouve dans de nombreuses compositions de pommades, de crèmes ou de gels utilisés pour soigner des douleurs musculaires ou articulaires.

Plant de gaulthérie couchée
Synthèse du salicylate de méthyle
Il est possible de synthétiser le salicylate de méthyle au laboratoire, à partir de l’acide salicylique et du méthanol, modélisée par l’équation de la réaction suivante :
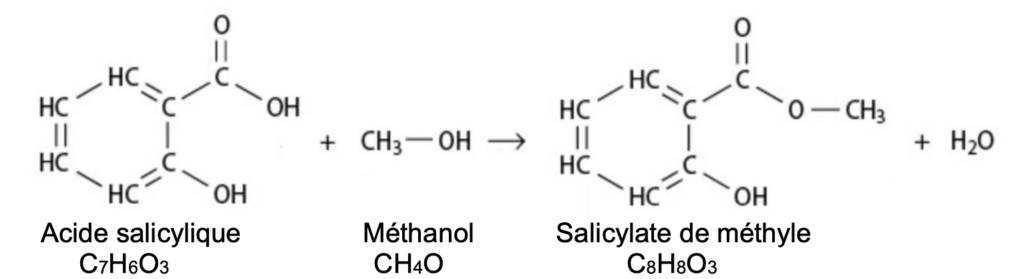
Le protocole de cette synthèse est décrit ci-après :
① Dans un ballon, introduire 8,7 g d’acide salicylique, 10 mL de méthanol, quelques gouttes d’acide sulfurique et un barreau aimanté.
② Chauffer à reflux pendant 2 heures.
③ Refroidir le mélange réactionnel à température ambiante et ajouter environ 100 mL d’eau.
④ Transvaser le mélanger dans une ampoule à décanter et ajouter 25 mL de cyclohexane. Séparer les phases.
⑤ Laver la phase organique avec une solution d’hydrogénocarbonate de sodium afin d’éliminer les acides restant dans la solution.
⑥ Séparer les constituants de la phase organique par distillation.
Données :
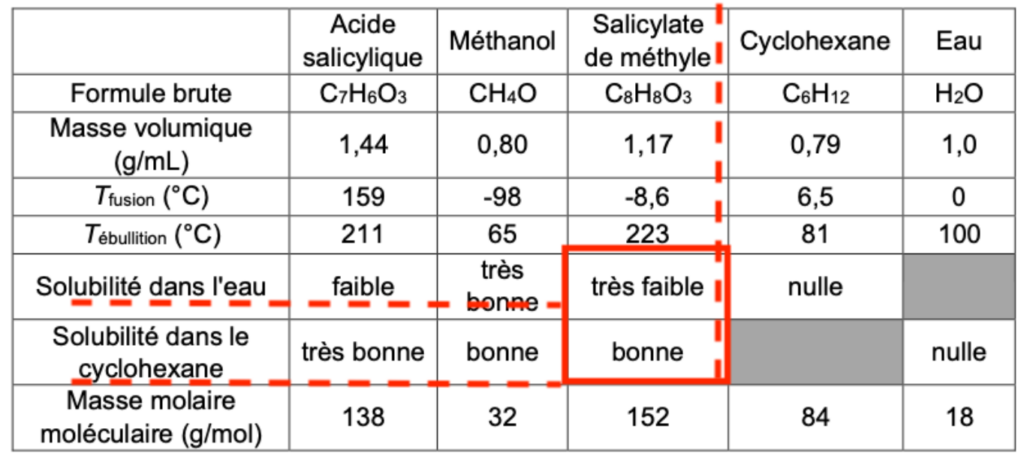
- Propriétés des espèces chimiques de la synthèse à température ambiante (20 °C)
| Acide salicylique | Méthanol | Salicylate de méthyle | Cyclohexane | Eau | |
| Formule brute | C7H6O3 | CH4O | C8H8O3 | C6H12 | H2O |
| Masse volumique (g/mL) | 1,44 | 0,80 | 1,17 | 0,79 | 1,0 |
| Tfusion (°C) | 159 | -98 | -8,6 | 6,5 | 0 |
| Tébullition (°C) | 211 | 65 | 223 | 81 | 100 |
| Solubilité dans l’eau | faible | très bonne | très faible | nulle | |
| Solubilité dans le cyclohexane | très bonne | bonne | bonne | nulle | |
| Masse molaire moléculaire (g/mol) | 138 | 32 | 152 | 84 | 18 |
- Données de spectroscopie infrarouge
| Liaison | C-C | C-O | C=O | C-H | O-H |
| Nombre d’onde (cm-1) | 1000-1250 | 1050-1450 | 1650-1800 | 2800-3000 | 3200-3700 |
1. Justifier le nom « méthanol » donné au réactif CH3OH de la synthèse.
CH3OH
La molécule porte un atome de carbone : methan
La molécule fait partie de la famille des alcools : ol
Nom de la molécule représentée : methanol
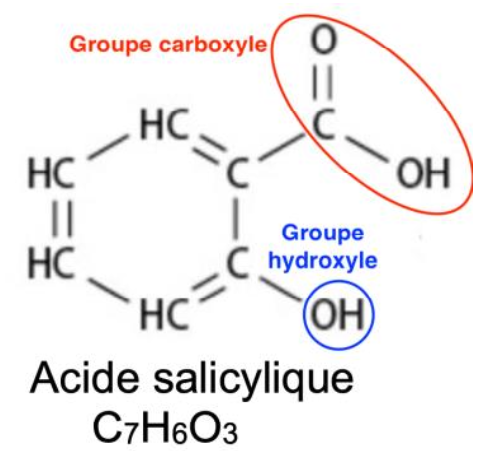
2. Nommer les groupes caractéristiques présents dans la molécule d’acide salicylique.
Groupes caractéristiques présents dans la molécule d’acide salicylique :
- Groupe carboxyle
- Groupe hydroxyle
3. Donner et justifier l’état physique des réactifs à température ambiante (20 °C).
Les réactifs sont l’acide salicylique et le méthanol.
| Acide salicylique | ||
| T< Tfuison=159°C | Tfuison=159°C < T < Tebulition=211°C | T > Tebulition=211°C |
| Solide | Liquide | Gaz |
À température ambiante (20 °C), la température est inférieure à la température de fusion, l’acide salicylique est à l’état solide.
| Méthanol | ||
| T< Tfuison= − 98°C | Tfuison=− 98°C < T < Tebulition=65°C | T > Tebulition=65°C |
| Solide | Liquide | Gaz |
À température ambiante (20 °C), la température est comprise entre la température de fusion et la température de d’ébullition, le méthanol est à l’état liquide.
4. Justifier l’utilisation du chauffage à reflux lors de cette synthèse.
Le chauffage à reflux permet d’accélérer la réaction sans perte de matière.
Le schéma ci-dessous représente l’ampoule à décanter utilisée dans l’étape 4 du protocole de synthèse.
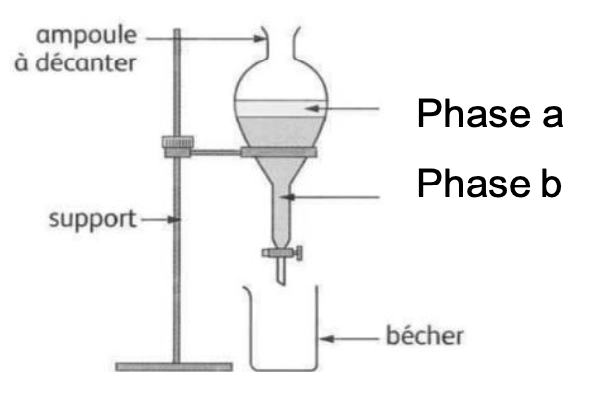
5. Identifier le solvant contenu dans la phase a et celui contenu dans la phase b. Indiquer dans quelle phase se trouve le salicylate de méthyle. Justifier.
Dans l’étape 3 on a ajouté de l’eau et dans l’étape 4 du cyclohexane.
ρcyclohexane <ρeau : le cyclohexane est moins dense que l’eau, il est au-dessus de l’eau dans la phase a. L’eau est dans la phase b.
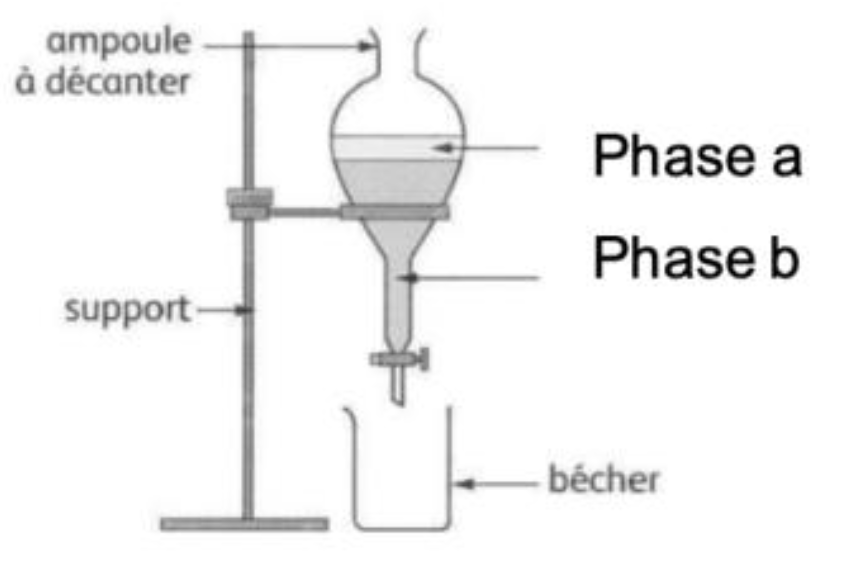
Le salicylate de méthyle est faiblement soluble dans l’eau et à une bonne solubilité dans le cyclohexane.
Ainsi, le salicylate de méthyle se trouve dans la phase organique (le cyclohexane).
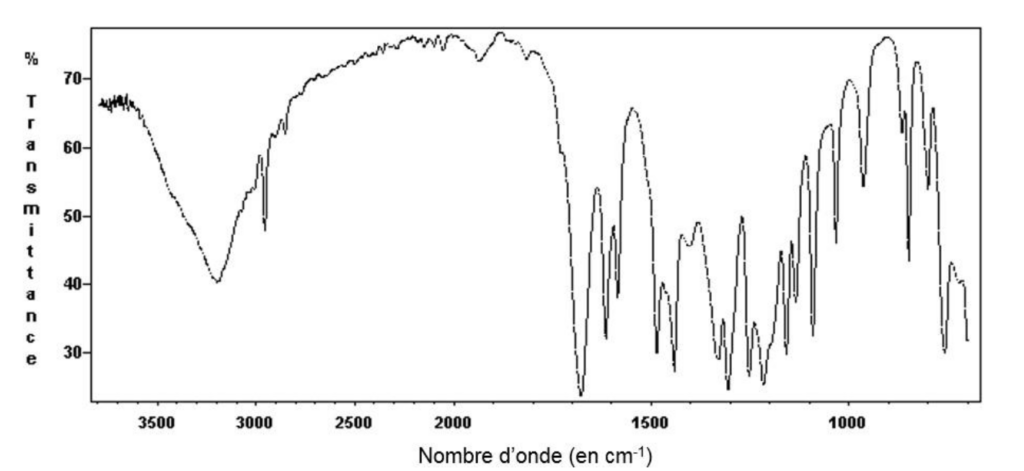
On réalise le spectre infrarouge du produit obtenu après purification, ci-dessous.
Source : www.fao.ord
6. Justifier que ce spectre permet d’identifier la formation de salicylate de méthyle au cours de cette synthèse.
D’après les données de spectroscopie infrarouge, les liaisons caractéristiques C-C ; C-O ; C=O ; C-H et O-H donne des bandes caractéristiques.


Les deux molécules possèdent les mêmes liaisons. Ainsi, ce spectre ne permet pas d’identifier la formation de salicylate de méthyle au cours de cette synthèse. (Je sais que ça va à l’encontre de la question).
Détermination du rendement
7. Déterminer les quantités de matière d’acide salicylique et de méthanol introduites initialement dans le milieu réactionnel.
\[ \mathrm{ n_{\text{acide salicylique}} = \frac{m_{\text{acide salicylique}}}{M_{\text{acide salicylique}}} }\]
\[ \mathrm{ n_{\text{acide salicylique}} = \frac{8{,}7}{138}}\]
\[ \mathrm{ n_{\text{acide salicylique}} = 6{,}3 \times 10^{-2} \, \text{mol}}\]
Calculons la quantité de méthanol introduit initialement dans le milieu réactionnel :
\[ \mathrm{ n_{\text{méthanol}} = \frac{m_{\text{méthanol}}}{M_{\text{méthanol}}}}\]
Or
\[ \mathrm{ \rho_{\text{méthanol}} = \frac{m_{\text{méthanol}}}{V_{\text{méthanol}}}}\]
\[ \mathrm{ \frac{m_{\text{méthanol}}}{V_{\text{méthanol}}} = \rho_{\text{méthanol}}}\]
\[ \mathrm{ m_{\text{méthanol}} = \rho_{\text{méthanol}} \times V_{\text{méthanol}}}\]
D’où :
\[ \mathrm{ n_{\text{méthanol}} = \frac{\rho_{\text{méthanol}} \times V_{\text{méthanol}}}{M_{\text{méthanol}}}}\]
\[ \mathrm{ n_{\text{méthanol}} = \frac{0{,}80 \times 10}{32}}\]
\[ \mathrm{ n_{\text{méthanol}} = 2{,}5 \times 10^{-1} \, \text{mol}}\]
8. Déterminer la quantité maximale de salicylate de méthyle qu’il est possible d’obtenir si la transformation est considérée comme totale.
| Équation | Acide salicylique + Méthanol → Salicylate de méthyle + Eau C7H6O3 + CH4O → C8H8O3 + H2O | ||||
| État | Avancement | ||||
| État initial | x=0 | 6,3×10-2 | 2,5×10-1 | 0 | 0 |
| État intermédiaire | x | 6,3×10-2-x | 2,5×10-1-x | x | x |
| État final | xf | 6,3×10-2-xf | 2,5×10-1-xf | xf | xf |
Calculons \( x_{\text{max}} \) :
\[ \mathrm{ 6{,}3 \times 10^{-2} – x_{\text{max1}} = 0 }\]
\[ \mathrm{ -x_{\text{max1}} = -6{,}3 \times 10^{-2} }\]
\[ \mathrm{ x_{\text{max1}} = 6{,}3 \times 10^{-2} \, \text{mol} }\]
\[ \mathrm{ 2{,}5 \times 10^{-1} – x_{\text{max2}} = 0 }\]
\[ \mathrm{ -x_{\text{max2}} = -2{,}5 \times 10^{-1} }\]
\[ \mathrm{ x_{\text{max2}} = 2{,}5 \times 10^{-1} \, \text{mol} }\]
\[ \mathrm{ \(x_{\text{max1}} < x_{\text{max2}}\) : donc \( x_{\text{max}} = x_{\text{max1}} = 6{,}3 \times 10^{-2} \, \text{mol} \) }\]
Déterminons la quantité maximale de salicylate de méthyle qu’il est possible d’obtenir si la transformation est considérée comme totale :
\[ \mathrm{ n_{\text{salicylate de méthyle}} = x_f }\]
\[ \mathrm{ n_{\text{salicylate de méthyle}}^{\text{max}} = x_{\text{max}} }\]
\[ \mathrm{ n_{\text{salicylate de méthyle}}^{\text{max}} = 6{,}3 \times 10^{-2} \, \text{mol} }\]
A la fin de la synthèse on récupère une masse de 6,1 g de salicylate de méthyle.
9. Déterminer le rendement de cette synthèse.
\[ \mathrm{n_{\text{salicylate de méthyle}}^{\text{max}} = \frac{m_{\text{salicylate de méthyle}}^{\text{max}}}{M_{\text{salicylate de méthyle}}}}\]
\[ \mathrm{\frac{m_{\text{salicylate de méthyle}}^{\text{max}}}{M_{\text{salicylate de méthyle}}} = n_{\text{salicylate de méthyle}}^{\text{max}}}\]
\[ \mathrm{m_{\text{salicylate de méthyle}}^{\text{max}} = n_{\text{salicylate de méthyle}}^{\text{max}} \times M_{\text{salicylate de méthyle}}}\]
\[ \mathrm{m_{\text{salicylate de méthyle}}^{\text{max}} = 6{,}3 \times 10^{-2} \times 152}\]
\[ \mathrm{m_{\text{salicylate de méthyle}}^{\text{max}} = 9{,}6 \, \text{g}}\]
Déterminons le rendement :
\[ \mathrm{\eta = \frac{m_{\text{salicylate de méthyle}}^{\text{expérimentale}}}{m_{\text{salicylate de méthyle}}^{\text{max}}}}\]
\[ \mathrm{\eta = \frac{6{,}1}{9{,}6}}\]
\[ \mathrm{\eta = 0{,}64}\]
\(\eta = 64\%\)
Le rendement de cette synthèse est de 64 %.
Dosage du salicylate de méthyle dans un gel anti douleurs
Les gels anti douleurs à base de salicylate de méthyle sont très largement répandus pour soulager temporairement des douleurs musculaires ou articulaires causées par des foulures, des entorses, de l’arthrite, des ecchymoses ou des maux de dos. Lors de l’application du gel anti douleurs, une partie du salicylate de méthyle va être absorbée par la peau et se retrouver dans l’organisme. Il a été reporté plusieurs cas d’intoxications sévères, voire mortelles, dues à une concentration trop importante de salicylate de méthyle dans l’organisme suite à l’utilisation excessive de ce gel. Il est donc très important de respecter les consignes d’utilisation.
Une étude de 2012 montre que pour éviter tout risque d’utilisation de ce gel anti-douleurs, il ne faudrait pas qu’ils soient dosés à plus de 2,4 % (2,4 g de salicylate de méthyle pour 100 g de gel). Les limitations de concentration du salicylate de méthyle varient d’un pays à l’autre. La Norvège est stricte ; elle limite à 1 % en masse de salicylate de méthyle dans les gels pour la peau.
Source : RISKPROFILE Methyl salicylate CAS N o.119-36–8
On se propose de déterminer la concentration en masse de salicylate de méthyle dans un gel anti douleurs vendu en France par dosage spectrophotométrique.
Donnée :
Spectre d’absorption du salicylate de méthyle dans du méthanol :
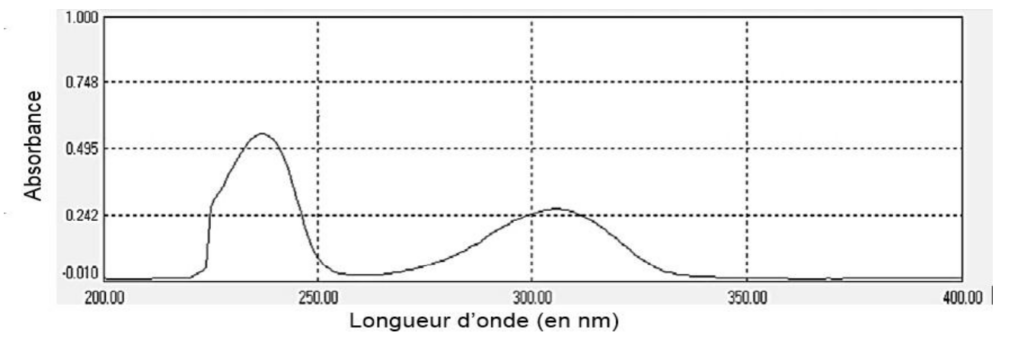
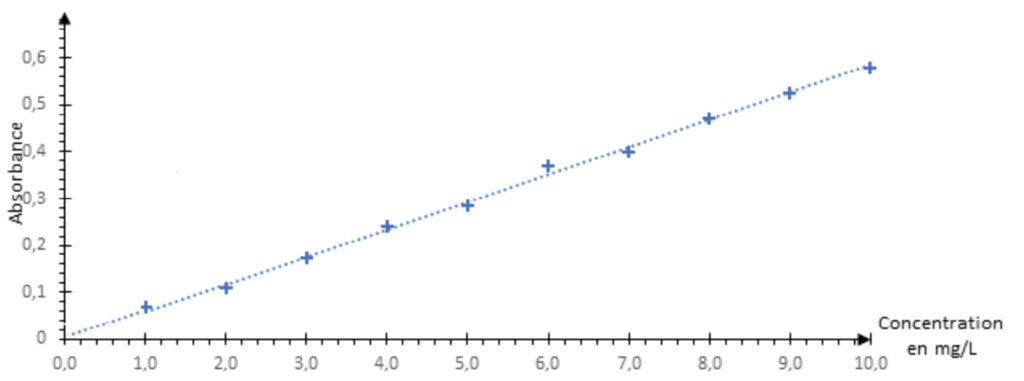
On dispose d’un ensemble de solutions de salicylate de méthyle dissout dans du méthanol de concentration en masse variant de 1,0 mg∙L-1 à 10,0 mg∙L-1. On mesure l’absorbance de ces solutions à la longueur d’onde λ = 237 nm.
On place les différents points de cette gamme d’étalonnage sur le graphique représentant l’absorbance en fonction de la concentration en masse de salicylate de méthyle ci-dessous et on modélise les résultats obtenus par une fonction affine représentée par la droite en pointillés.
Source : development of UV Spectrophotometric Method For Determination of Methyl Salicylate In Bulk And Semisolid Formulation Dhawal Dorwal
Pour préparer la solution S contenant du gel anti douleurs, on dissout 6,0 mg de gel anti douleurs dans du méthanol pour préparer 100 mL de solution. L’absorbance de cette solution est mesurée à la longueur d’onde λ = 237 nm et vaut Agel = 0,370.
10. Indiquer le nom du domaine électromagnétique dans lequel le spectre d’absorption a été réalisé.
L’absorbance de cette solution est mesurée à la longueur d’onde λ = 237 nm.
Le spectre d’absorption a été réalisé dans le domaine électromagnétique des ultraviolets.
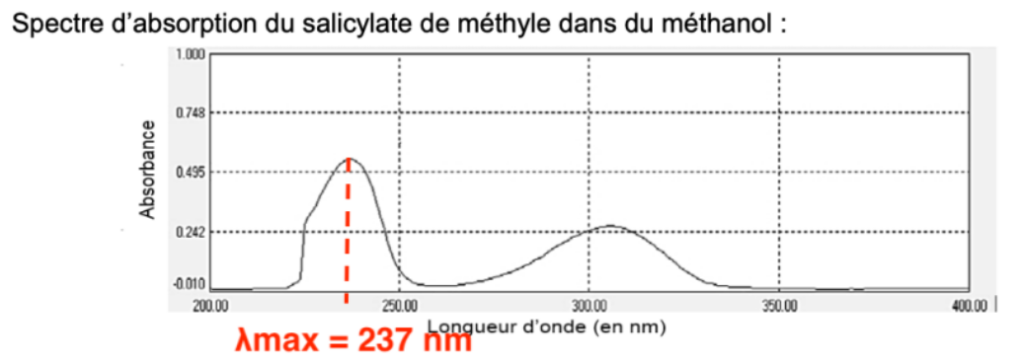
11. Justifier le choix de la longueur d’onde utilisée pour effectuer le dosage.
Graphiquement, λmax= 237 nm. C’est pourquoi cette de la longueur d’onde a été choisie pour effectuer le dosage.
12. Déterminer la concentration en masse de salicylate de méthyle dans la solution S contenant du gel anti douleurs.
On lit graphiquement la valeur de la concentration pour Agel = 0,370 :
$c_m=6,4 mg.L^{-1}$
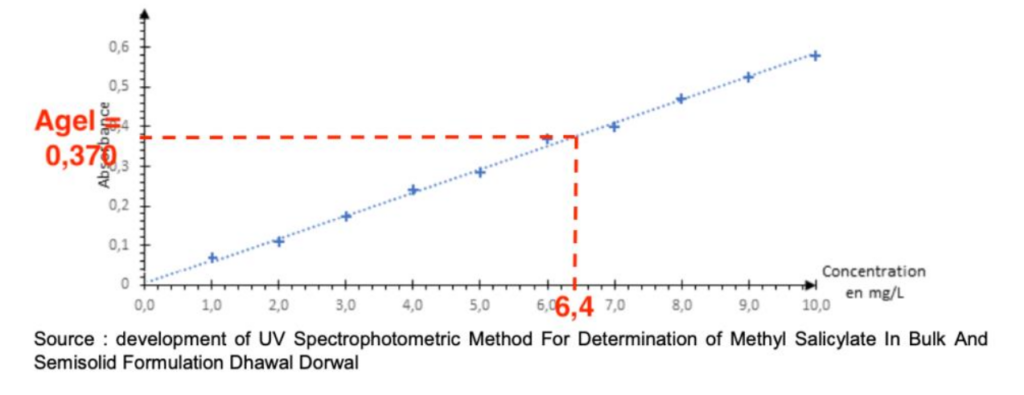
13. Déterminer si ce produit pourrait être vendu en Norvège.
L’élève est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
Les limitations de concentration du salicylate de méthyle varient d’un pays à l’autre. La Norvège est stricte ; elle limite à 1 % en masse de salicylate de méthyle dans les gels pour la peau.
Calculons la masse de salicylate de méthyle contenue dans les 6,0 mg de gel anti douleurs :
\[ \mathrm{ c_m = \frac{m_{\text{salicylate de méthyle}}}{V}}\]
\[ \mathrm{ \frac{m_{\text{salicylate de méthyle}}}{V} = c_m}\]
\[ \mathrm{ m_{\text{salicylate de méthyle}} = c_m \times V}\]
\[ \mathrm{ m_{\text{salicylate de méthyle}} = 6{,}4 \times 10^{-3} \times 100 \times 10^{-3}}\]
\[ \mathrm{ m_{\text{salicylate de méthyle}} = 6{,}4 \times 10^{-4} \, \text{g}}\]
Calculons le pourcentage en masse de salicylate de méthyle dans ce gel pour la peau :
\[ \mathrm{ P = \frac{m_{\text{salicylate de méthyle}}}{m_{\text{gel}}}}\]
\[ \mathrm{ P = \frac{6{,}4 \times 10^{-4}}{6{,}0 \times 10^{-3}}}\]
\[ \mathrm{ P = 0{,}10}\]
\(P = 10 \%\)
Le pourcentage en masse de salicylate de méthyle dans ce gel pour la peau est supérieur à la limite de 1 % imposée en Norvège : ce produit ne peut pas être vendu en Norvège.
