E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02768
Télécharger l’exercice en PDF :
Connue depuis plus de deux siècles pour son pouvoir à la fois désinfectant et blanchissant, l’eau de Javel reste encore aujourd’hui un produit d’utilisation courante en France. Chaque année, on compte environ 245 millions de litres commercialisés au niveau du grand public.

L’eau de Javel est une solution aqueuse contenant des ions hypochlorite CℓO−(aq). Son efficacité dépend de la concentration de ces ions qui présentent des propriétés oxydantes. Rencontrée sous différentes formes dans les usages domestiques, l’eau de Javel est très fréquemment vendue en flacon ou en berlingot de recharge affichant respectivement des degrés chlorométriques de 9° chl et de 36° chl.
Le but de cet exercice est d’expliciter certaines des indications données par un fabricant proposant deux types de conditionnement, flacon et berlingot, et d’étudier une méthode de dosage de l’eau de Javel.
| « JAVEL » en flacon | « JAVEL CONCENTRÉE » en berlingot |
|---|---|
| Eau de Javel prête à l’emploi. | Verser deux berlingots dans un flacon de 2 L vide et compléter avec de l’eau froide pour obtenir un volume de 2 L d’eau de Javel prête à l’emploi. |
| • À utiliser de préférence dans les trois ans suivant les indications figurant sur le haut de la bouteille. •À conserver au frais et à l’abri de la lumière et du soleil. • Ne pas réutiliser le flacon vide, sauf pour diluer de l’eau de Javel en berlingot. | • À diluer dans les trois mois qui suivent la date de fabrication (dans les deux mois et demi en période chaude). • À conserver au frais et à l’abri de la lumière et du soleil. • Ne pas utiliser de flacons alimentaires. |
Contient : sodium hypochlorite, sodium hydroxyde. | Contient : sodium hypochlorite, sodium hydroxyde. |
| FLACON DE 2 L CONCENTRATION : 9° chl | BERLINGOT DE 250 mL CONCENTRATION : 36° chl |
1. Degré chlorométrique d’une eau de Javel
Industriellement, l’eau de Javel est obtenue par barbotage de dichlore gazeux Cℓ2(g) dans une solution aqueuse d’hydroxyde de sodium (Na+(aq) + HO−(aq)). La transformation chimique ayant lieu peut être considérée comme totale et elle est modélisée par la réaction d’équation :
Cℓ2(g) + 2 HO−(aq) → Cℓ−(aq) + CℓO−(aq) + H2O(ℓ)
En France, l’eau de Javel est souvent caractérisée par son degré chlorométrique (° chl) qui correspond au volume, exprimé en litres, de dichlore gazeux nécessaire pour préparer un litre de solution d’eau de Javel. Ce volume est mesuré dans des conditions de température et de pression telles que le volume molaire des gaz est Vm = 22,4 L.mol−1.
1.1. Montrer que la concentration en quantité de matière des ions hypochlorite CℓO−(aq) d’une eau de Javel de titre chlorométrique 9° chl est de 0,4 mol.L−1.
» L’eau de Javel est souvent caractérisée par son degré chlorométrique (° chl) qui correspond au volume, exprimé en litres, de dichlore gazeux nécessaire pour préparer un litre de solution d’eau de Javel «
9° chl correspond donc à 9L de dichlore gazeux.
Calculons la concentration en quantité de matière des ions hypochlorite CℓO−(aq)
$$C_{ClO^-}=\frac{n_{ClO^-}}{V}$$
Or d’après l’équation de réaction : Cℓ2(g) + 2 HO−(aq) → Cℓ−(aq) + CℓO−(aq) + H2O(ℓ)
$$n{ClO^-}=n_{Cl_2}=\frac{V_{Cl_2}}{V_m}$$
D’ou
$$C_{ClO^-}=\frac{V_{Cl_2}}{V\times V_m}$$
$$C_{ClO^-}=\frac{9}{1\times 22,4}=0,4\ mol.L^{-1}$$
1.2. Justifier le protocole de dilution indiqué sur l’étiquette d’un berlingot de « JAVEL CONCENTRÉE » pour obtenir une eau de Javel prête à l’emploi.
Le but de cette dilution est de passer d’une concentration 36° chl à 9° chl
Le facteur de dilution est
$$F=\frac{36}{9}=4$$
Il faut donc diluer 4 fois. Ainsi le volume de la solution fille doit être 4 fois plus grand que celui de la solution mère :
$$V_f=4V_m=4\times 2\times 250{.10}^{-3}=2L$$
Il faut donc bien verser 2 berlingots de 250 mL et compléter avec de l’eau pour obtenir un volume de 2L.
2. Limite de conservation des eaux de Javel
L’ion hypochlorite CℓO−(aq) en solution aqueuse est fortement oxydant et capable d’oxyder l’eau elle-même. On peut modéliser cette transformation à partir des deux couples oxydant -réducteur suivants : CℓO−(aq) / Cℓ−(aq) et O2(g) / H2O(ℓ). Cette transformation, plus ou moins lente en fonction de certains paramètres, impose une limite de durée d’utilisation aux eaux de Javel.
2.1. Établir l’équation de la réaction d’oxydo-réduction modélisant l’oxydation de l’eau par les ions hypochlorite. Justifier le rôle oxydant de l’ion hypochlorite.
${\rm \operatorname{ClO}}{(aq)}^-/{\rm \operatorname{Cl}}{(aq)}^- :\ {\rm \operatorname{ClO}}{(aq)}^-+2\operatorname{H}^++{2\operatorname{e}}^-={\rm \operatorname{Cl}}{(aq)}^-+\operatorname{H}2\operatorname{O}{(l)}$
$ \times 2 \operatorname{O}{2(g)}/\operatorname{H}_2\operatorname{O}{(l)} : {2\operatorname{H}}_2\operatorname{O}{(l)}=\operatorname{O}{2(g)}+4\operatorname{H}^++{4\operatorname{e}}^-$
$${2\operatorname{ClO}}{(aq)}^-+4\operatorname{H}^++{2\operatorname{H}}_2\operatorname{O}{(l)}={2\operatorname{Cl}}{(aq)}^-+{2\operatorname{H}}2\operatorname{O}{(l)}+\operatorname{O}_{2(g)}+4\operatorname{H}^+$$
En simplifiant les $\operatorname{H}^+ et \operatorname{H}_2\operatorname{O}{(l)}$ présents dans les réactifs et les produits :
${2\operatorname{ClO}}{(aq)}^-={2\operatorname{Cl}}{(aq)}^-+\operatorname{O}_{2(g)}$
L’ion hypochlorite est un oxydant car il capte des électrons.
2.2. Indiquer comment évolue le degré chlorométrique d’une eau de Javel dans le temps. Justifier la réponse.
${\rm \operatorname{ClO}}{(aq)}^-$ est un réactif , la quantité de ${\rm \operatorname{ClO}}{(aq)}^- $ diminue donc au cours du temps, ainsi le degré chlorométrique diminue au cours du temps.
2.3. D’après les indications fournies par le fabricant, identifier trois facteurs qui influent sur la dégradation de l’eau de Javel.
| Indications fournies par le fabricant | Facteurs qui influent sur la dégradation de l’eau de Javel |
| En flacon : À utiliser de préférence dans les trois ans suivant les indications figurant sur le haut de la bouteille. | La différence entre les 2 est la concentration. Ainsi plus la concentration est grande, plus la dégradation est rapide |
| En berlingot : À diluer dans les trois mois qui suivent la date de fabrication (dans les deux mois et demi en période chaude). | |
| À conserver au frais et à l’abri de la lumière et du soleil. | La température et la lumière |
3. Titrage d’une eau de Javel prête à l’emploi
On se propose de contrôler expérimentalement la concentration en ions hypochlorite CℓO−(aq) présents dans une solution S d’eau de JAVEL achetée en flacon de 2 L.
Pour cela, on procède au titrage de la solution S par une méthode indirecte dont les étapes sont décrites ci-après.
Étape 1 :
La solution S étant trop concentrée pour être dosée directement, on effectue une dilution au dixième afin d’obtenir un volume de 50,0 mL de solution diluée notée S’.
Étape 2 :
Dans un erlenmeyer de 150 mL, on introduit dans l’ordre :
- un volume V’ = 10,0 mL de solution S’ ;
- 20 mL d’une solution aqueuse d’iodure de potassium (K+(aq) + I−(aq)) de concentration effective en ions iodure [I−(aq)] = 0,10 mol.L−1 ;
- quelques gouttes d’acide sulfurique concentré.
La transformation chimique ayant lieu lors de cette étape peut être modélisée par la réaction d’équation :
CℓO−(aq) + 2 I−(aq) + 2 H+(aq) → Cℓ−(aq) + I2(aq) + H2O(ℓ)
Les ions iodure I−(aq) étant apportés en excès dans le mélange, la totalité des ions hypochlorite CℓO−(aq) initialement présents sont consommés.
Étape 3 :
On réalise le titrage du diiode (aq) formé à l’issue de l’étape 2 par une solution aqueuse de thiosulfate de sodium (2 Na+(aq) + S2O32-(aq)) de concentration effective en ions thiosulfate [S2O32-(aq)] = 5,0 × 10−2 mol.L−1.
La réaction support du titrage a pour équation :
I2(aq) + 2 S2O32-(aq) → 2 I−(aq) + S4O62-(aq)
À l’approche de l’équivalence, on ajoute quelques gouttes de thiodène dans le mélange réactionnel.
Lors de ce titrage, le volume de solution aqueuse de thiosulfate de sodium versé pour atteindre l’équivalence est VE = 12,4 mL.
En solution aqueuse, le diiode (aq) est de couleur brune à forte concentration et jaune très pâle à faible concentration.
Une solution aqueuse de diiode devient bleu foncé en présence de thiodène.
Parmi l’ensemble des espèces mentionnées dans cet exercice, seul le diiode est coloré en solution aqueuse.
3.1. Indiquer les précautions à prendre lors de la manipulation des solutions S et S’.
| Pictogrammes | Précautions |
| Port de gant, blouse et lunette de protection | |
| Ne pas verser dans les canalisations |
3.2. On donne le schéma du dispositif expérimental mis en œuvre lors de l’étape 3. Indiquer sans recopier le schéma sur la copie, les termes à mettre en (a), (b), (c), (d) et (e) pour compléter la légende de ce schéma.
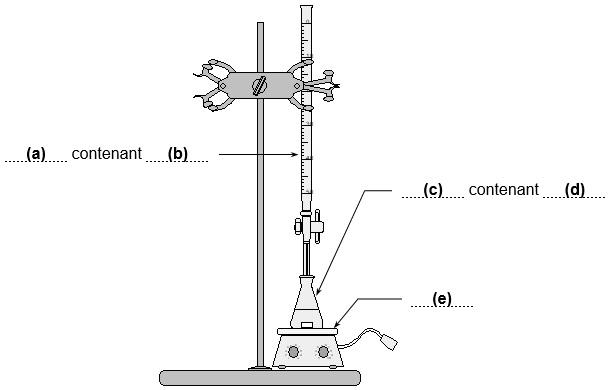
(a) : burette graduée
(b) : solution de thiosulfate de sodium de concentration $[\mathrm{\operatorname{S}}_\mathrm{2}\mathrm{\operatorname{O}}_\mathrm{3}^{\mathrm{2}-}(aq)] = 5,0 \times 10^{−2} mol.L^{−1}$
(c) : erlenmeyer
(d) : volume V’ = 10,0 mL de S’ ; 20 mL d’iodure de potassium [I–(aq)]=0,10 mol.L-1 ; quelques gouttes d’acide sulfurique ; thiodène
(e) : agitateur magnétique
3.3. Indiquer comment l’équivalence est repérée lors de ce titrage. Justifier la réponse.
Le diiode est bleu en présence du thiodène. Les autres espèces sont incolores.
A l’équivalence le diiode dosé sera complètement consommé. Ainsi la solution initialement bleue deviendra incolore.
3.4. Déduire du résultat de ce titrage la quantité de matière de diiode formé dans le mélange réactionnel à l’issue de l’étape 2 et titré par le thiosulfate.
La réaction support du titrage a pour équation :
$\mathrm{\operatorname{I}}_\mathrm{2}(aq) + 2 \mathrm{\operatorname{S}}_\mathrm{2}\mathrm{\operatorname{O}}_\mathrm{3}^{\mathrm{2}-}(aq) \rightarrow 2 I^−(aq) + \mathrm{\operatorname{S}}_\mathrm{4}\mathrm{\operatorname{O}}_\mathrm{6}^{\mathrm{2}-}(aq)$
A l’équivalence :
$$\frac{n_{I_2}^i}{1}=\frac{n_{\mathrm{\operatorname{S}}_\mathrm{2}\mathrm{\operatorname{O}}_\mathrm{3}^{\mathrm{2}-}}^{eq}}{2}$$
$$n_{I_2}^i=\frac{\left[\mathrm{\operatorname{S}}_\mathrm{2}\mathrm{\operatorname{O}}_\mathrm{3}^{\mathrm{2}-}\right]\times V_{eq}}{2}$$
$$n_{I_2}^i=\frac{5,0{.10}^{-2}\times 12,4{.10}^{-3}}{2}$$
$$n_{I_2}^i=3,1{.10}^{-4}mol$$
La quantité de matière de diiode formé dans le mélange réactionnel à l’issue de l’étape 2 et titré par le thiosulfate est $3,1{.10}^{-4}mol$.
3.5. Déterminer la concentration en quantité de matière des ions hypochlorite de la solution S et commenter le résultat.
Pour cette dernière question, le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti.
La quantité de matière de diiode formé dans le mélange réactionnel à l’issue de l’étape 2 et titré par le thiosulfate provient de cette réaction :
$$ClO^-(aq)\ +\ 2\ I^-(aq)\ +\ 2\ H^+(aq)\ \rightarrow\ Cl^-(aq)\ +\ I_2(aq)\ +\ H_2O(\ell)$$
D’après cette réaction :
$n’_{ClO^-}=n_{I_2}^{formé}$
$[ClO^-]’=\frac{n’_{ClO^-}}{V}$
$[ClO^-]’=\frac{n_{I_2}^{formé}}{V}$
$[ClO^-]’=\frac{3,1.10^{-4}}{10.10^{-3}}=3,1.10^{-2}\ \mathrm{mol.L^{-1}}$
Or « La solution S étant trop concentrée pour être dosée directement, on effectue une dilution au dixième afin d’obtenir un volume de 50,0 mL de solution diluée notée S’. »
$$\left[C\ell O^-\right]=10\times\left[C\ell O^-\right]^\prime$$
$$\left[C\ell O^-\right]=10\times 3,1.{10}^{-2}$$
$$\left[C\ell O^-\right]=3,1.{10}^{-1}mol.L^{-1}$$
Commenter le résultat :
D’après la question 1.1 : « la concentration en quantité de matière des ions hypochlorite CℓO−(aq) d’une eau de Javel de titre chlorométrique 9° chl est de 0,4 mol.L−1. »
Comparons la concentration trouvée et celle théorique :
$$\frac{\left[C\ell O^-\right]{th}-\left[C\ell O^-\right]{exp}}{\left[C\ell O^-\right]_{th}}=\frac{0,4-3,1.{10}^{-1}}{0,4}=0,23=23%$$
Il y a une différence de 23% ! La différence est très importante. On peut supposé que la javel titrée est une ancienne javel, c’est pourquoi la concentration en {\rm \operatorname{ClO}}_{(aq)}^- à diminué (voir question 2.2).
