E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02745 , n°G1SPHCH02755 , n°G1SPHCH02762 et n°G1SPHCH02773
Télécharger l’exercice en PDF :
La Bétadine® 10% est un antiseptique proposé sous forme de solution, utilisé en application locale pour le traitement des plaies et des brûlures superficielles. Ses propriétés antiseptiques sont dues à son principe actif : le diiode de formule I2. C’est aussi le diiode qui lui donne sa couleur jaune-orange.
Les molécules de diiode présentes dans la Bétadine® 10% sont liées à un polymère, la polyvidone et forment avec lui une espèce appelée polyvidone iodée.
Sur le flacon de Bétadine® 10% est indiqué : « polyvidone iodée : 10 g pour 100 mL ».

L’objectif de cet exercice est de vérifier cette indication et d’un des modes d’action bactéricide de la Bétadine® 10%.
Données
- Masse molaire atomique de l’iode : M(I) = 126,9 g·mol−1
- Masse molaire de la « polyvidone iodée » : M = 2362,8 g.mol-1.
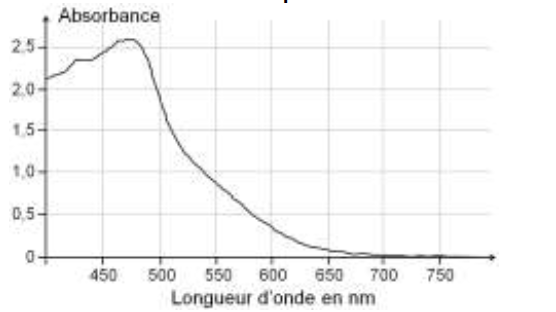
- Spectre d’absorption d’une solution aqueuse de diiode I2
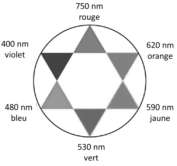
Cercle chromatique
1. Dosage du diiode contenu dans la Bétadine® par spectrophotométrie
Un volume de 250,0 mL de solution dite « mère » S0 est préparé par dissolution de diiode dans l’eau, pour obtenir une concentration en quantité de matière de diiode C0 = 2,00×10−2 mol·L−1.
1.1. Déterminer la masse de diiode solide qu’il faut dissoudre pour obtenir 250,0 mL de solution « mère » à la concentration souhaitée ?
$n_{I_2}=\frac{m_{I_2}}{M_{I_2}}$
$m_{I_2}=n_{I_2}\times M$
Or
$n_{I_2}=C\times V$
D’ou
$m_{I_2}=C\times V\times M_{I_2}$
$m_{I_2}=2,00.10^{-2}\times 250.10^{-3}\times 2\times 126,9$
$m_{I_2}=1,27\ g$
La préparation de la gamme de solutions permettant d’obtenir le graphe d’étalonnage, se fait par dilution à partir de la solution aqueuse de diiode S0 de concentration C0 = 2,00×10−2 mol·L−1.
| Nom de la solution | S1 | S2 | S3 | S4 | S5 | S6 | S7 |
| Concentration (en mmol·L−1) | 0,10 | 0,20 | 0,40 | 0,50 | 0,60 | 0,80 | 1,0 |
1.2. À partir de la liste des matériels et produits proposée ci-après, indiquer la verrerie nécessaire et le protocole pour préparer la solution S3. Justifier ce choix par un calcul.
- Pipettes jaugées de 5,0 ; 10,0 ; 15,0 ; 20,0 et 25,0 mL.
- Fioles jaugées de 50,0 ; 100,0 et 250,0 mL.
- Trois béchers.
- Solution « mère » de diiode S0
- Eau distillée.
Lors d’une dilution la quantité de matière se conserve :
$n_3=n_0$
Or
$n=C\times V$
Donc
$C_3V_3=C_0V_0$
$V_3=\frac{C_0V_0}{C_3}$
$V_3=\frac{2,00.10^{-2}\times V_0}{0,40.10^{-3}}$
$V_3=50\times V_0$
Pour réaliser la dilution il faut un volume fille V3 50 fois supérieur au volume prélevé de la solution mère V0.
Le volume fille est celui d’une fiole jaugée et le volume de la solution mère est prélevé avec une pipette jaugée.
Ainsi nous utiliserons la pipette jaugée de 5,0 ml ainsi que la fiole jaugée 250,0 ml.
Protocole :
- Verser la solution mère dans un bécher
- Prélever à l’aide d’une pipette jaugée V0=5,0 ml de la solution mère
- Introduire V0 dans une fiole jaugée 250,0 ml
- Ajouter de l’eau distillée jusqu’au trait de jauge
- Homogénéiser la solution
1.3. Choix de la longueur d’onde de travail
1.3.1. Dissous en solution aqueuse, le diiode donne à la solution une coloration jaune-orange. Expliquer cette coloration.
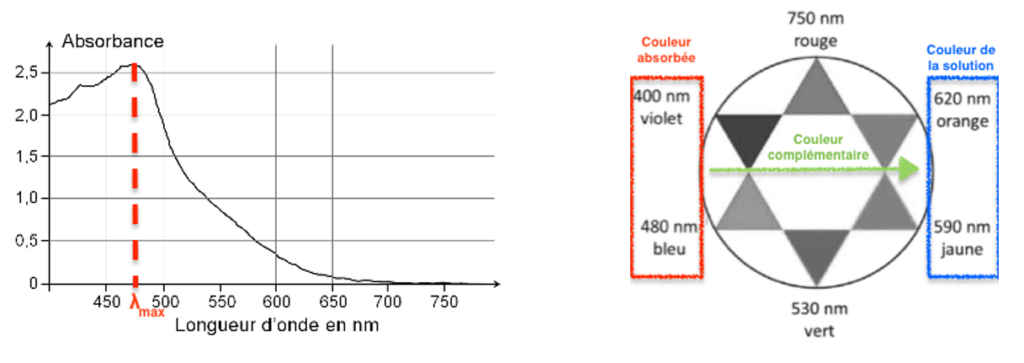
La solution de diiode se comporte comme un filtre. Elle absorbe sa couleur complémentaire ($\lambda_{max}=470\ nm$ bleu-violet) et laisse passer sa couleur (jaune-orange).
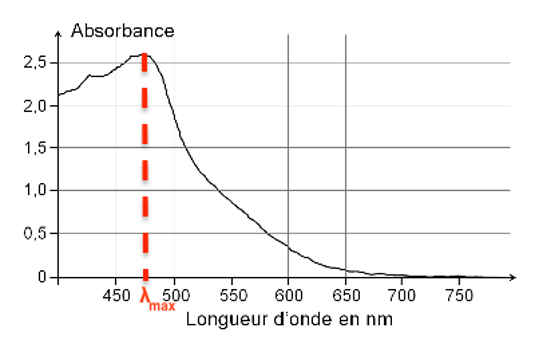
1.3.2. À quelle longueur d’onde faut-il régler le spectrophotomètre pour réaliser les mesures d’absorbance des solutions étalon ? Justifier.
Pour réaliser les mesures d’absorbance des solutions étalon, il faut choisir la longueur d’onde pour laquelle la solution absorbe le plus.
$\lambda_{max}=470\ nm$.
1.4. Utilisation de la loi de Beer-Lambert
La loi de Beer-Lambert énonce que pour une longueur d’onde donnée, l’absorbance A d’une solution est proportionnelle à sa concentration C, si celle-ci n’est pas trop élevée. À partir des mesures d’absorbance des différentes solutions étalon préparées, on obtient la courbe d’étalonnage suivante :
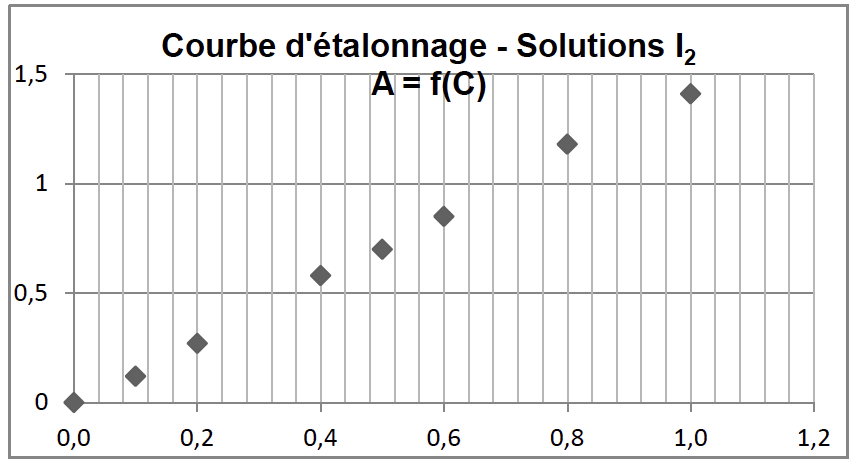
1.4.1. Montrer qu’il n’est pas possible, à partir de cette courbe, de déterminer la concentration de la solution commerciale pour confirmer l’indication fournie par le fabricant. Justifier.
Calculons la concentration attendue de la Bétadine :
$C_{Bétadine}=\frac{n_{polyvidone\ iodée}}{V}$
Or
$n_{polyvidone\ iodée}=\frac{m_{polyvidone\ iodée}}{M_{polyvidone\ iodée}}$
donc
$C_{Bétadine}=\frac{m_{polyvidone\ iodée}}{M_{polyvidone\ iodée}}\times V$
$C_{Bétadine}=\frac{10}{2362,8}\times 100.10^{-3}$
$C_{Bétadine}=4,2.10^{-2}\ mol.L^{-1}$
La courbe s’arrête pour une concentration $1,0\ mmol.L^{-1}$
Comparons la concentration attendue de la Bétadine et la plus grande concentration indiquée sur cette courbe :
$\frac{C_{Bétadine}}{C_{max}}=\frac{4,2.10^{-2}}{1,0.10^{-3}}=42$
La concentration attendue de la Bétadine est 42 fois supérieure à la plus grande concentration indiquée sur la courbe.
Or « l’absorbance A d’une solution est proportionnelle à sa concentration C, si celle-ci n’est pas trop élevée. »
Nous pouvons conclure qu’étant donné que la concentration de la Bétadine est trop élevée, il n’est pas possible, à partir de cette courbe, de déterminer la concentration de la solution commerciale pour confirmer l’indication fournie par le fabricant.
La solution commerciale de Bétadine® doit donc être diluée. La solution proposée est de la diluer 200 fois. Le spectrophotomètre indique une absorbance A de la solution diluée.
1.4.2. Prévoir la valeur de l’absorbance A, qui confirmerait l’indication portée sur le flacon de Bétadine® 10%. Justifier.
Traçons la courbe : c’est une droite passant par l’origine. A et C sont proportionnels : $A=KC$
Calculons le coefficient directeur K :
$K=\frac{A_B-A_A}{C_B-C_A}$
$K=\frac{1,50-0}{1,04.10^{-3}-0}$
$K=1,42.10^3\ L.mol^{-1}$
D’ou $A=1,42.10^3\times C$
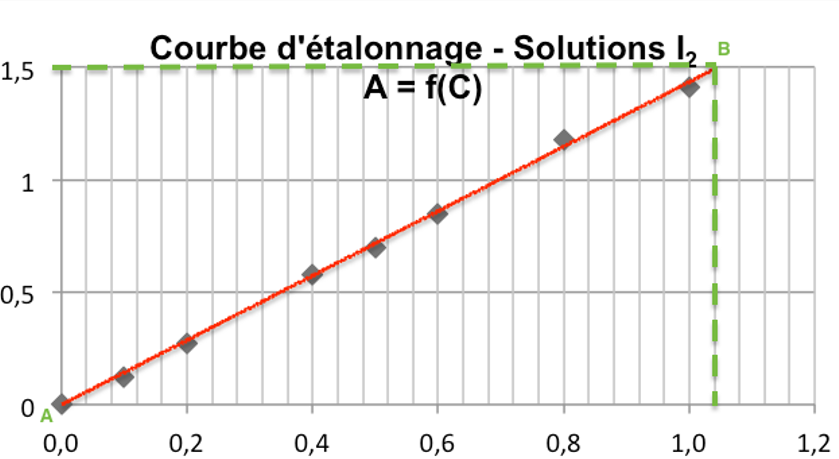
Pour la solution diluée 200 fois :
$A=1,42.10^3\times \frac{C_{Bétadine}}{200}$
$A=1,42.10^3\times \frac{4,2.10^{-2}}{200}$
$A=0,30$
2. Action bactéricide de la Bétadine®
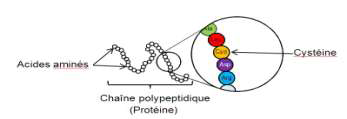
Une bactérie est un être unicellulaire dont la taille varie de 1 à 10 μm. Elle contient 70% d’eau. Rapporté à son poids sec, une bactérie est constituée à 55% de protéines […]. Les protéines sont des macromolécules biologiques présentes dans toutes les cellules vivantes. Elles sont constituées d‘enchaînements d’acides aminés liés entre eux par des liaisons peptidiques. Parmi les acides aminés présents dans ces enchaînements, certains sont susceptibles de réagir avec le diiode libéré progressivement par la polyvidone iodée. L’un d’entre eux est la cystéine, notée Cys sur l’illustration ci-dessous.
Les symboles Ala, Leu, Asp… sont relatifs à d’autres acides aminés, qui ne sont pas étudiés dans cet exercice.
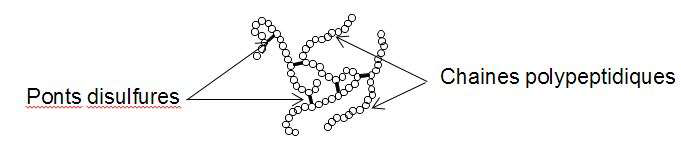
La réaction entre le diiode et la cystéine entraîne la formation de liaisons chimiques appelées « ponts disulfures » entre deux parties différentes d’une même protéine ou entre deux protéines différentes. Les protéines forment alors des agrégats qui entraînent la mort de la bactérie.
La cystéine forme un couple oxydant-réducteur avec la cystine. En notant la cystéine Cys–S–H et la cystine Cys–S–S–Cys, la demi-équation électronique du couple s’écrit :
2 Cys–S–H = Cys–S–S–Cys + 2 H+(aq)+ 2 e–
2.1. Nommer l’oxydant du couple oxydant-réducteur formé par la cystéine et la cystine ? Justifier.
$2\ Cys–S–H = Cys–S–S–Cys + 2\ H^+(aq) + 2\ e^-$
L’oxydant gagne des électrons, ici Cys–S–S–Cys la cystine
2.2. Écrire la demi-équation électronique du couple diiode/ion iodure noté I2(aq)/I−(aq).
$I_2(aq)/I^-(aq)$ : $I_{2(aq)}+2\ e^- = 2\ I^-_{(aq)}$
2.3. Écrire l’équation de la réaction d’oxydoréduction modélisant la transformation chimique entre le diiode I2 et la cystéine notée Cys–S–H.
$I_{2(aq)}+2\ e^- = 2\ I^-_{(aq)}$
$2\ Cys–S–H = Cys–S–S–Cys + 2\ H^+(aq) + 2\ e^-$
$I_{2(aq)}+2\ Cys–S–H \rightarrow 2\ I^-_{(aq)}+Cys–S–S–Cys + 2\ H^+(aq)$
2.4. L’action bactéricide de la Bétadine® présentée ici, est-elle la conséquence d’une oxydation ou d’une réduction des protéines ? Justifier.
La réaction entre le diiode et la cystéine entraîne la formation de liaisons chimiques appelées « ponts disulfures ».
La cystéine Cys–S–H (réducteur) se transforme en cystine Cys–S–S–Cys (oxydant).
Il s’agit donc d’une oxydation des protéines.
