ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH107 et n°SPEPHCH115
Télécharger l’exercice en PDF :
La vanilline est la substance aromatique que l’on trouve dans les gousses de vanille. Ce terme désigne aussi l’arôme de synthèse qui imite au plus près le goût de la vanille naturelle. C’est l’arôme le plus utilisé au monde dans des desserts et autres plats sucrés et en parfumerie.

Le but de cet exercice est d’étudier l’obtention de la vanilline par :
- extraction de la vanilline de la vanille naturelle
- extraction de la vanilline du sucre vanillé
- synthèse chimique de la vanilline
Extraction de la vanilline de la vanille naturelle
La vanille naturelle provient des gousses d’une variété d’orchidées. Les principaux cultivateurs sont à Madagascar et à l’île de la Réunion.
La vanilline est, parmi les multiples composants de l’arôme naturel de la vanille, le plus important et le plus caractéristique. Dans un 1 kg de gousses de vanille, il est possible d’extraire 20 g de vanilline et 1 kg de gousses de vanille revient à 200 €. Alors que la vanilline de synthèse revient à 15 € par kg.
1. Déterminer le coût d’1 kg de vanilline extraite de gousses de vanille.
Dans un 1 kg de gousses de vanille, il est possible d’extraire 20 g de vanilline et 1 kg de gousses de vanille revient à 200 €
| 20 g de vanilline extraite | 200 € |
| 1kg ( 1000 g ) de vanilline extraite | Cout |
\[ \mathrm{ \text{Cout} = \frac{1000 \times 200}{20}}\]
\[ \mathrm{ \text{Cout} = 10\ 000 \, \text{€}}\]
1 kg de vanilline extraite de gousses de vanille coûte 10 000 €.
2. Le comparer au coût de la vanilline de synthèse.
\[ \mathrm{ \text{Cout}_{\text{extrait}} / \text{Cout}_{\text{synthèse}} = \frac{10\ 000}{15} }\]
\[ \mathrm{ \text{Cout}_{\text{extrait}} / \text{Cout}_{\text{synthèse}} = 667 }\]
Le coût de la vanilline extraite est 667 fois plus grand que celui de la vanilline de synthèse.
Extraction de la vanilline du sucre vanillé
Données (à 25 °C) :
| Eau | Cyclohexane | Ether diéthylique | |
| Formules | H2O | C6H12 | C4H10O |
| Densité | 1,0 | 0,78 | 0,71 |
| Miscibilité dans l’eau | / | non | oui |
| Solubilité de la vanilline | – | + | ++ |
3. Indiquer le solvant à utiliser pour extraire la vanilline d’une solution de sucre vanillé dissout dans de l’eau.
Pour choisir un solvant extracteur il faut que :
Le solvant extracteur ne soit pas être miscible dans le solvant initial (l’eau) : seul le cyclohexane répond à ce critère.
La molécule à extraire y soit plus soluble : le cyclohexane ou l’ether diéthylique répondent à ce critère
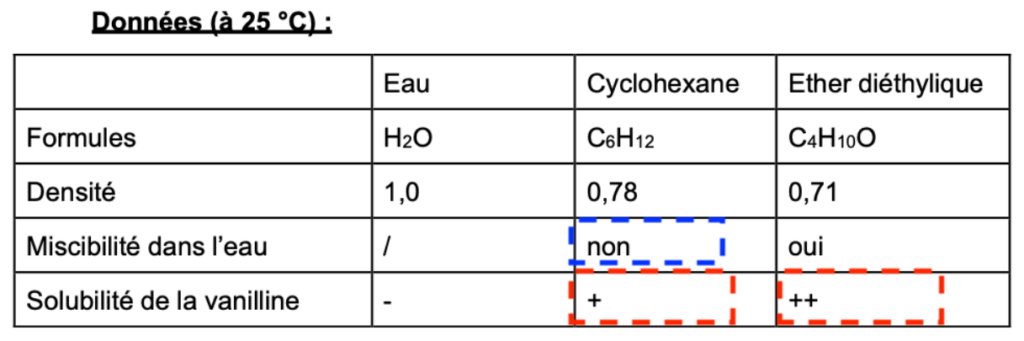
Ainsi, le solvant à utiliser pour extraire la vanilline d’une solution de sucre vanillé dissout dans de l’eau est le cyclohexane.
4. Schématiser et nommer l’instrument de verrerie utiliser pour réaliser l’extraction et indiquer la position des deux phases et indiquer la phase dans laquelle se trouve la vanilline en fin d’extraction.
dcyclohexane=0,78
deau=1,0
d_cyclohexane<d_eau : le cyclohexane est moins dense que l’eau, il est au-dessus de l’eau (avec la vanilline)
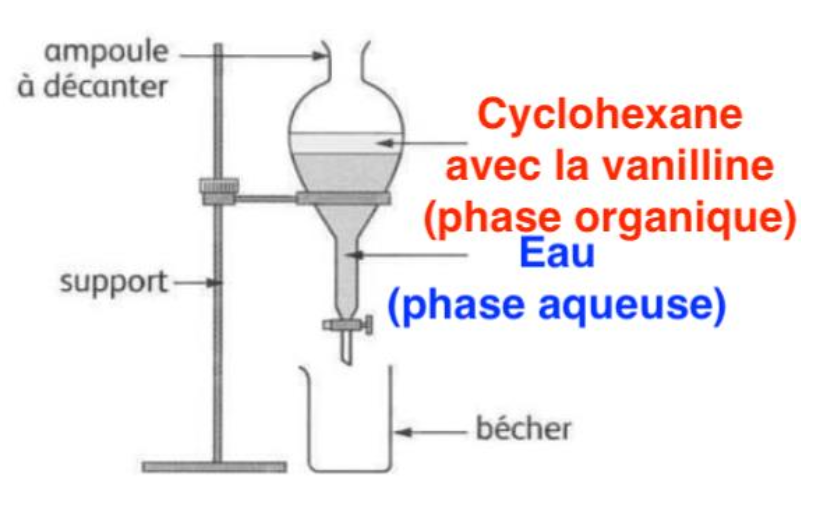
Synthèse de la vanilline
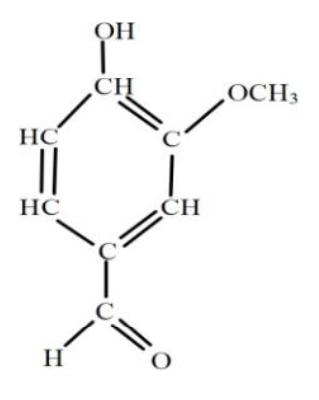
La molécule de vanilline (4-hydroxy-3-méthoxybenzaldéhyde) est représentée ci- contre.
La synthèse de la vanilline se fait en plusieurs étapes. Nous allons étudier la première étape c’est-à-dire la synthèse de l’acétate d’isoeugénol à partir de l’isoeugénol.
Mode opératoire :
- Dans un ballon de 250 mL, introduire 10 g d’isoeugénol, 20 mL d’anhydride éthanoïque et quelques gouttes de catalyseur.
- Chauffer en utilisant un montage à reflux et maintenir une ébullition douce pendant 30 minutes.
- Refroidir jusqu’à température ambiante.
- Verser le contenu du ballon dans un bécher contenant 30 mL d’eau glacée, tout en agitant.
- Filtrer et laver les cristaux formés avec de l’eau glacée.
La transformation est totale et l’équation de la réaction modélisant cette transformation est la suivante :
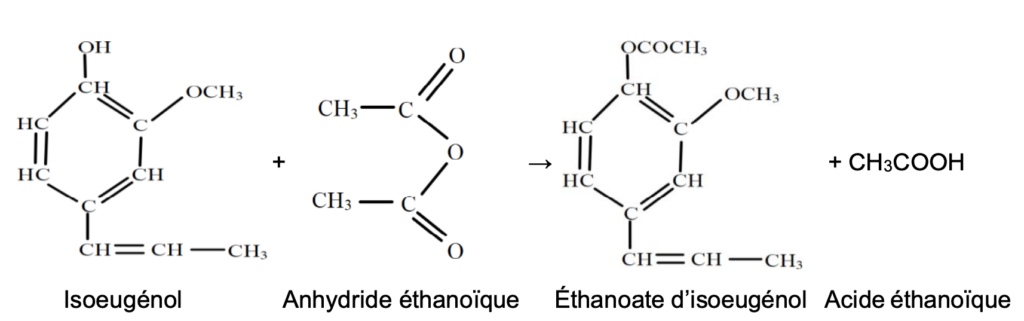
Données à 25 °C :
| Espèce chimique | Masse molaire moléculaire (g.mol-1) | Quelques propriétés |
| Isoeugénol | 164 | Densité d = 1,06 ; Nocif en cas d’ingestion et irritant pour les yeux, les voies respiratoires et la peau. |
| Éthanoate d’ isoeugénol | 205 | Température de Fusion Tfusion = 80 °C ; Soluble dans la plupart des solvants organiques et insoluble dans l’eau glacée |
| Anhydride éthanoïque | 102 | Densité d = 1,08 ; Corrosif, inflammable, provoque des brûlures. Peut réagir violemment avec l’eau. |
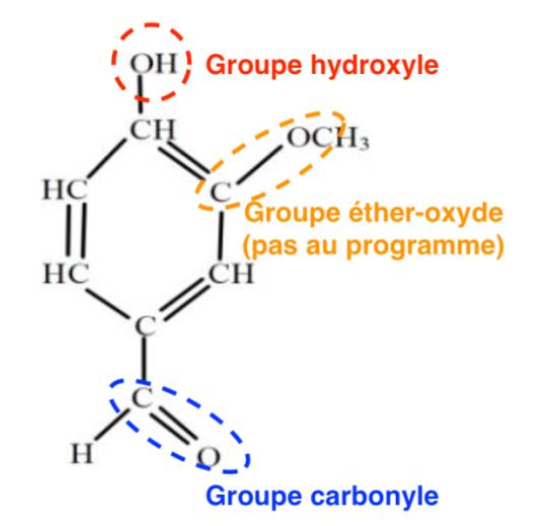
5. Reproduire la molécule de vanilline puis entourer et nommer les groupes caractéristiques.
Les groupes caractéristiques de la molécule de vanilline sont :
- —OH : Groupe hydroxyle
- C=O : Groupe carbonyle
- C—O—C : Groupe éther-oxyde (pas au programme)
6. Schématiser et légender le montage à reflux de la synthèse.
Montage à reflux :
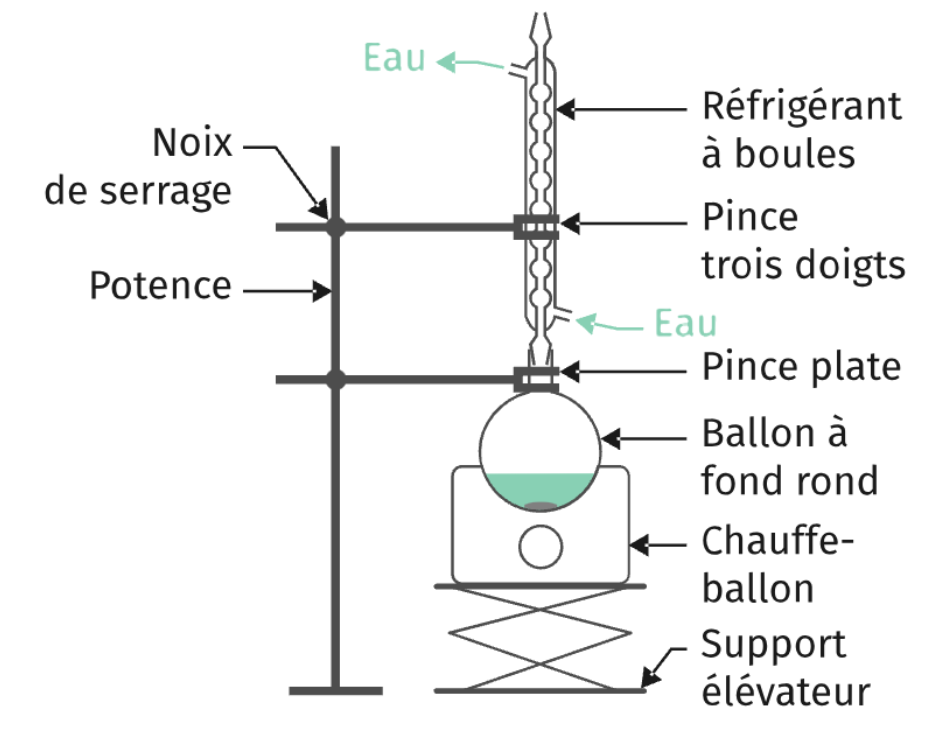
7. Expliquer le rôle du montage à reflux.
Le montage à reflux permet d’accélérer la réaction sans perte de matière.
8. Indiquer les règles de sécurité à respecter pour réaliser cette synthèse.
Isoeugénol est :
- Nocif en cas d’ingestion
- Irritant pour les yeux, les voies respiratoires et la peau.
Il faut donc mettre une blouse, des gants et des lunettes de protections et travailler sous hotte aspirante pour ne pas être en contact avec les vapeurs de ce produit.
L’anhydride éthanoïque est :
- Corrosif, inflammable, provoque des brûlures.
- Peut réagir violemment avec l’eau.
Il faut donc éloigner de toute flamme ou source de chaleur et utiliser une verrerie parfaitement sèche.
L’éthanoate d’isoeugénol n’est pas dangereux
Ainsi, les précautions à prendre pour réaliser cette synthèse sont :
- Mettre une blouse
- Porter lunettes de protections
- Porter des lunettes de protections
- Travailler sous hotte aspirante
- Éloigner de toute flamme ou source de chaleur
- Utiliser une verrerie parfaitement sèche.
9. Vérifier, par un calcul, que la quantité de matière initiale d’isoeugénol notée n1 est égale à 6,1 X 10–2 mol et que la quantité de matière d’anhydride éthanoïque, notée n2 est égale à 0,212 mol. Déterminer le réactif limitant.
Calculons la quantité d’isoeugénol introduit initialement dans le milieu réactionnel :
\[ \mathrm{ n_1 = n_{\text{isoeugénol}} = \frac{m_{\text{isoeugénol}}}{M_{\text{isoeugénol}}}}\]
\[ \mathrm{ n_1 = \frac{10}{164} = 6{,}1 \times 10^{-2} \ \text{mol}}\]
Calculons la quantité d’anhydride éthanoïque introduit initialement dans le milieu réactionnel :
\[ \mathrm{ n_2 = n_{\text{anhydride éthanoïque}} = \frac{m_{\text{anhydride éthanoïque}}}{M_{\text{anhydride éthanoïque}}}}\]
Or,
\[ \mathrm{ \rho_{\text{anhydride éthanoïque}} = \frac{m_{\text{anhydride éthanoïque}}}{V_{\text{anhydride éthanoïque}}}}\]
\[ \mathrm{ m_{\text{anhydride éthanoïque}} = \rho_{\text{anhydride éthanoïque}} \times V_{\text{anhydride éthanoïque}}}\]
D’où,
\[ \mathrm{ n_2 = \frac{\rho_{\text{anhydride éthanoïque}} \times V_{\text{anhydride éthanoïque}}}{M_{\text{anhydride éthanoïque}}}}\]
Or,
\[ \mathrm{ d = \frac{\rho_{\text{anhydride éthanoïque}}}{\rho_{\text{eau}}}}\]
\[ \mathrm{ \rho_{\text{anhydride éthanoïque}} = d \times \rho_{\text{eau}}}\]
D’où,
\[ \mathrm{ n_2 = \frac{d \times \rho_{\text{eau}} \times V_{\text{anhydride éthanoïque}}}{M_{\text{anhydride éthanoïque}}}}\]
\[ \mathrm{ n_2 = \frac{1{,}08 \times 1000 \times 20 \times 10^{-3}}{102} = 0{,}212 \ \text{mol}}\]
\[ \mathrm{x_{\text{max1}} = \frac{n_1}{1}}\]
\[ \mathrm{x_{\text{max1}} = \frac{6{,}1 \times 10^{-2}}{1} = 6{,}1 \times 10^{-2} \ \text{mol}}\]
\[ \mathrm{x_{\text{max2}} = \frac{n_2}{1}}\]
\[ \mathrm{x_{\text{max2}} = \frac{0{,}212}{1} = 0{,}212 \ \text{mol}}\]
\[ \mathrm{x_{\text{max1}} < x_{\text{max2}} \quad \Rightarrow \quad x_{\text{max}} = x_{\text{max1}} = 6{,}1 \times 10^{-2} \ \text{mol}}\]
Ainsi, l’anhydride éthanoïque est le réactif limitant.
L’expérimentateur a obtenu 11,3 g de cristaux d’éthanoate d’isoeugénol.
10. Déterminer le rendement de la synthèse. Conclure.
Déterminons la masse maximale d’éthanoate d’isoeugénol qu’il est possible d’obtenir si la transformation est considérée comme totale :
\[ \mathrm{n_{\text{ethanoate d’isoeugenol}}^{\text{max}} = \frac{m_{\text{ethanoate d’isoeugenol}}^{\text{max}}}{M_{\text{ethanoate d’isoeugenol}}}}\]
\[ \mathrm{m_{\text{ethanoate d’isoeugenol}}^{\text{max}} = n_{\text{ethanoate d’isoeugenol}}^{\text{max}} \times M_{\text{ethanoate d’isoeugenol}}}\]
\[ \mathrm{n_{\text{ethanoate d’isoeugenol}}^{\text{max}} = x_{\text{max}}}\]
\[ \mathrm{m_{\text{ethanoate d’isoeugenol}}^{\text{max}} = x_{\text{max}} \times M_{\text{ethanoate d’isoeugenol}}}\]
\[ \mathrm{m_{\text{ethanoate d’isoeugenol}}^{\text{max}} = 6{,}1 \times 10^{-2} \times 205 = 12{,}5 \ \text{g}}\]
Déterminons le rendement :
\[ \mathrm{\eta = \frac{m_{\text{ethanoate d’isoeugenol}}^{\text{expérimentale}}}{m_{\text{ethanoate d’isoeugenol}}^{\text{max}}}}\]
\[ \mathrm{\eta = \frac{11{,}3}{12{,}5} = 0{,}904}\]
\[ \mathrm{\eta = 90{,}4 \%}\]
Le rendement de cette synthèse est donc de 90,4 % .
Ainsi, la transformation est limitée.
Données : Extrait de table de données
| Liaison | Nombre d’onde (en cm-1) | Intensité |
| C = O des aldéhydes aromatique | 1650 – 1725 | Forte |
| N-H | 3050 – 3500 | Moyenne |
| C – H de CHO | 2700 – 2900 | Moyenne |
| O – H | 3100 – 3500 | Forte |
Pour analyser la molécule finale synthétisée au bout de toutes les étapes, l’expérimentateur réalise le spectre IR ci-dessous :
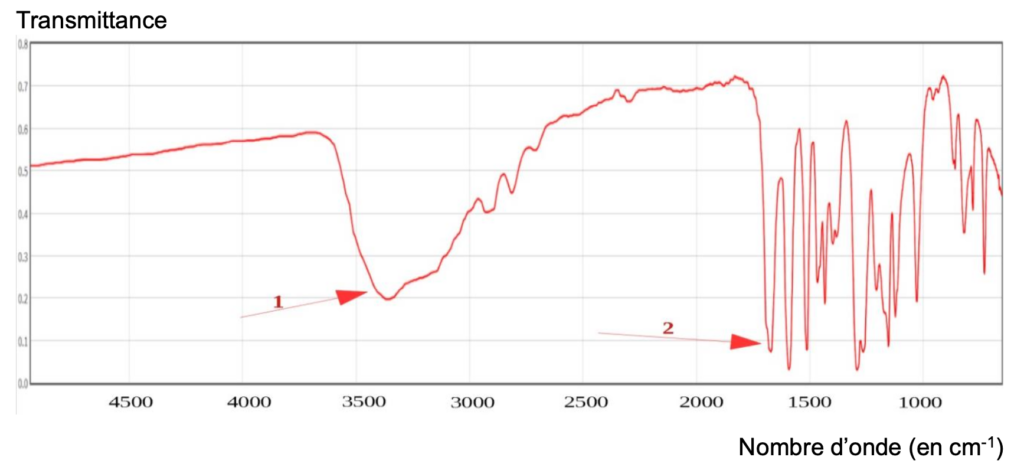
D’après NIST Mass Spectrometry Data Center, William E. Wallace, director, « Infrared Spectra » dans le WebBook de Chimie NIST, Base de Données Standard de Référence NIST Numéro 69
11. Identifier les groupes caractéristiques appartenant aux deux bandes d’absorption 1 et 2 et conclure quant à la synthèse de la molécule de vanilline.
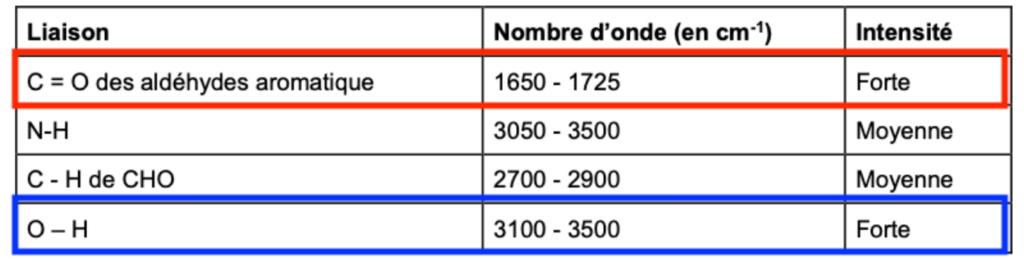
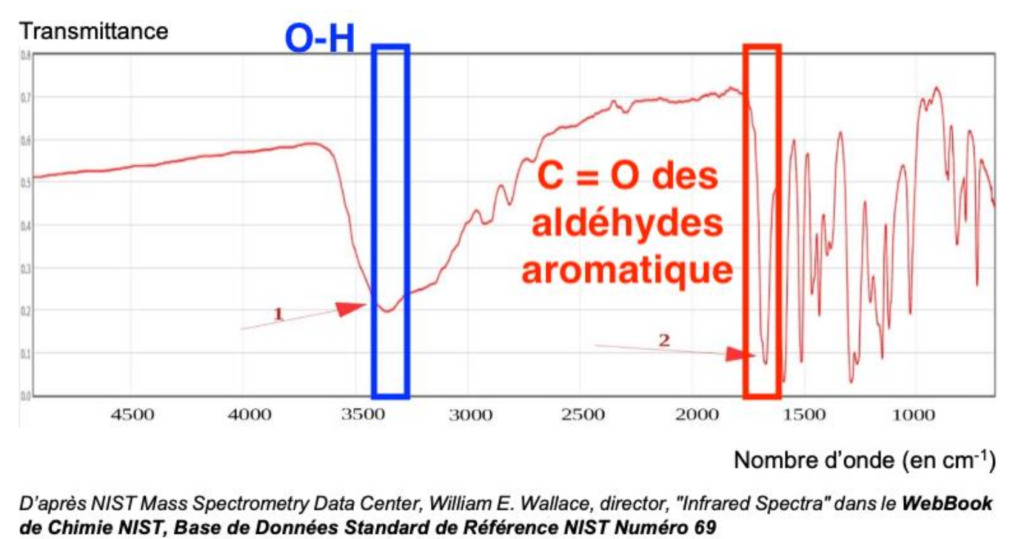
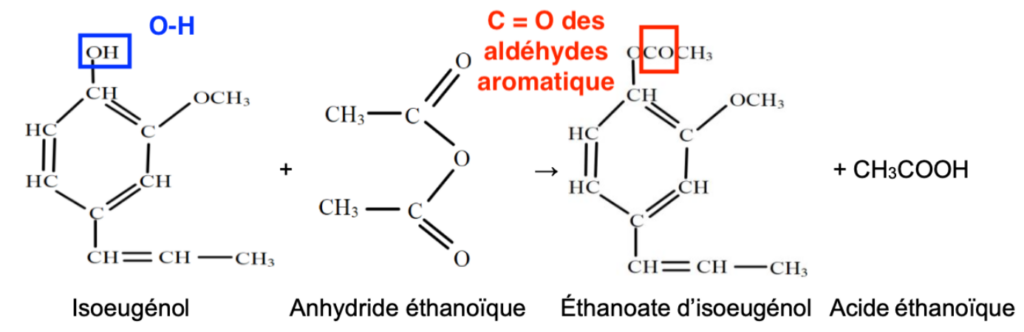
D’après la table spectroscopique IR :
- Une bande 1 vers 3400 cm-1 est caractéristique de la liaison O-H (aucune molécule de la réaction n’a du N—H)
- Une bande vers 1700 cm-1 est caractéristique de la liaison C = O des aldéhydes aromatique
On en déduit que la synthèse de la molécule de vanilline a bien eu lieu (apparition de la bande caractéristique de la liaison C = O des aldéhydes aromatique absente des réactifs).
