ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH121 et n°SPEPHCH124
Télécharger l’exercice en PDF :
L’acide thioglycolique est utilisé dans des domaines très variés tels que l’industrie pharmaceutique, la cosmétique, l’industrie du cuir et des métaux. C’est une substance totalement miscible dans l’eau. A température ambiante et pression atmosphérique, cet acide se présente sous la forme d’un liquide incolore qui possède une odeur forte et désagréable.
En cosmétique, l’acide thioglycolique entre dans la formulation de lotion pour cheveux et de crèmes dépilatoires ; un parfum est ajouté à la préparation afin de masquer son odeur.
Données :
- La formule brute de l’acide thioglycolique est : C2H4O2S.
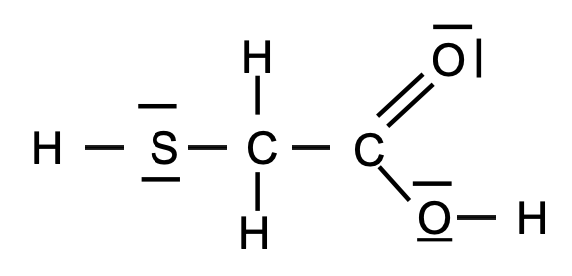
- Le schéma de Lewis de l’acide thioglycolique est représenté ci-dessous :
- La masse molaire de l’acide thioglycolique est 𝑀 = 92,1 g·mol-1.
- Électronégativité de quelques atomes: oxygène χ(O) = 3,4 ; soufre χ(S) = 2,6 ; carbone χ(C) = 2,6 ; hydrogène χ(H) = 2,2.
- Table de données pour la spectroscopie infrarouge :
| Liaison | Nombre d’onde (cm-1) | Intensité |
| O-H alcool libre | 3500 – 3700 | forte, fine |
| O-H alcool lié | 3200 – 3400 | forte, large |
| O-H acide carboxylique | 2500 – 3200 | forte à moyenne, large |
| C – H | 2900 – 3100 | moyenne à forte |
| C = O | 1700 – 1760 | forte et fine |
| C = C | 1620 – 1690 | moyenne |
Structure et propriétés de la molécule d’acide thioglycolique
1. Définir les deux types de tirets sur la formule de Lewis de l’acide thioglycolique.
Les deux types de tirets sur la formule de Lewis de l’acide thioglycolique sont :
- Les tirets reliant deux atomes : liaisons covalentes
- Les tirets portés par un atome : doublets non liants
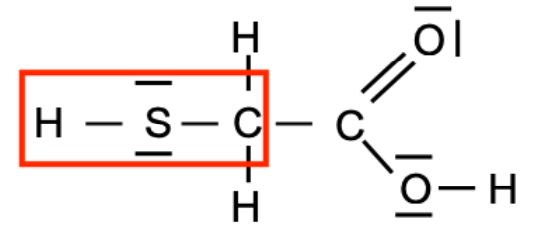
2. Prévoir, en justifiant, la géométrie de la molécule autour de l’atome de soufre (S) de l’acide thioglycolique.
L’atome de soufre (S) de l’acide thioglycolique fait deux liaisons simples et porte deux doublets non liants. La géométrie de la molécule autour de l’atome de soufre (S) de l’acide thioglycolique est linéaire.
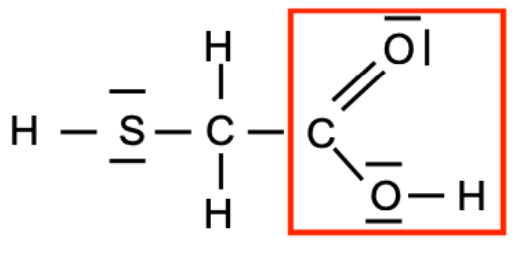
3. Identifier et nommer le groupe caractéristique de la molécule d’acide thioglycolique.
Le groupe caractéristique de la molécule d’acide thioglycolique est le groupe carboxyle.
4. Exploiter le spectre d’absorption infrarouge ci-dessous et identifier s’il peut correspondre à celui de l’acide thioglycolique.
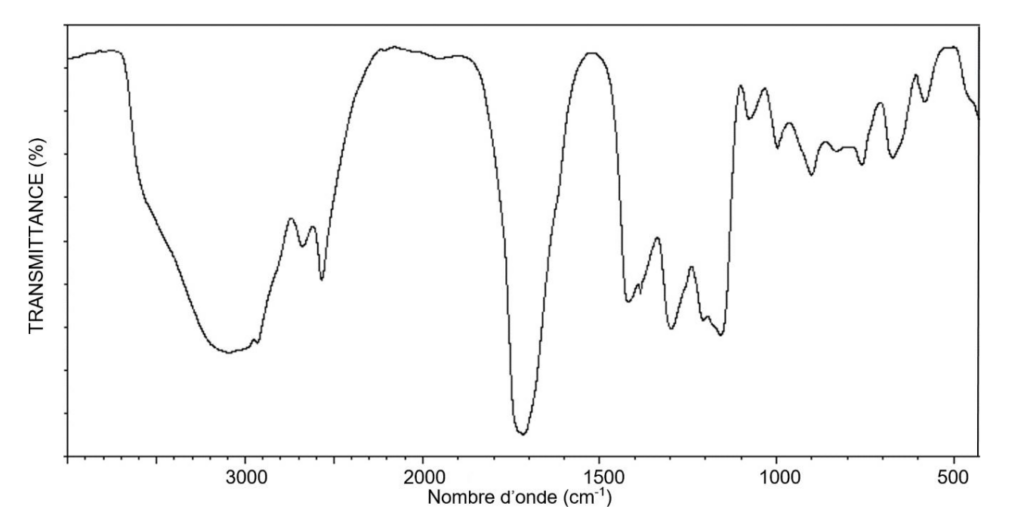

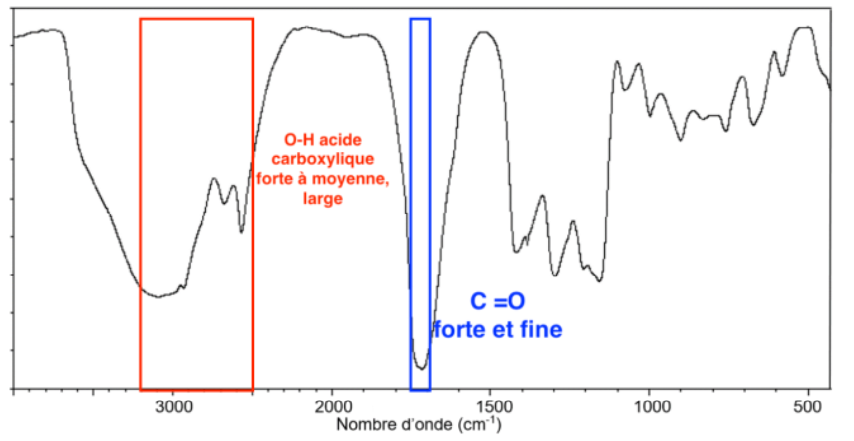
D’après la Table de données pour la spectroscopie infrarouge, un acide carboxylique donne un spectre ayant :
- Une bande forte à moyenne, large dont le nombre d’onde est compris entre 2500 et 3200 cm-1 pour la liaison O-H de l’acide carboxylique.
- Une bande forte et fine dont le nombre d’onde est compris entre 1700 et 1760 cm-1 pour la liaison C=O de l’acide carboxylique.
Ces deux bandes caractéristiques sont présentes dans le spectre donné. Ainsi, le spectre pourrait correspondre à celui de l’acide thioglycolique.
Étude de la miscibilité de l’acide thioglycolique dans l’eau.
5. Déterminer la polarité des liaisons dans la molécule d’eau.
Calculons la différence d’électronégativité entre l’atome d’oxygène et l’atome d’hydrogène :
∆χ=χ(O)-χ(H)
∆χ=3,4-2,2
∆χ=1,2
∆χ>0,4 : la liaison O—H est polaire.
Les deux liaisons O—H sont polaires.
L’atome d’oxygène étant plus électronégatif, chaque atome d’oxygène porte une charge partielle δ–. L’atome d’hydrogène porte une charge partielle δ+.
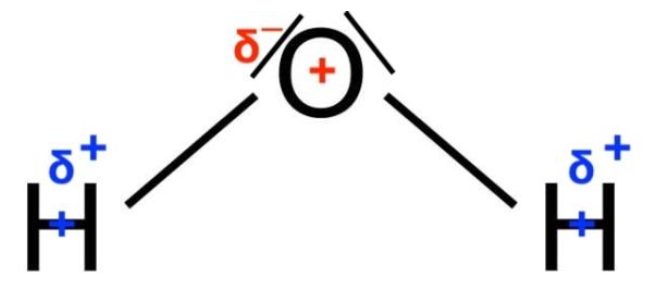
Le barycentre des charges positives G+ est situé sur l’atome de d’oxygène O.
Le barycentre des charges négatives G– est situé entre les deux atomes d’hydrogène H.
Le barycentre des charges positives G+ est différent du barycentre des charges négatives G– : la molécule d’eau H2O est polaire.
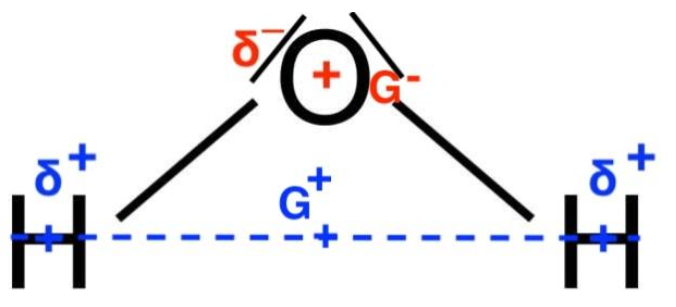
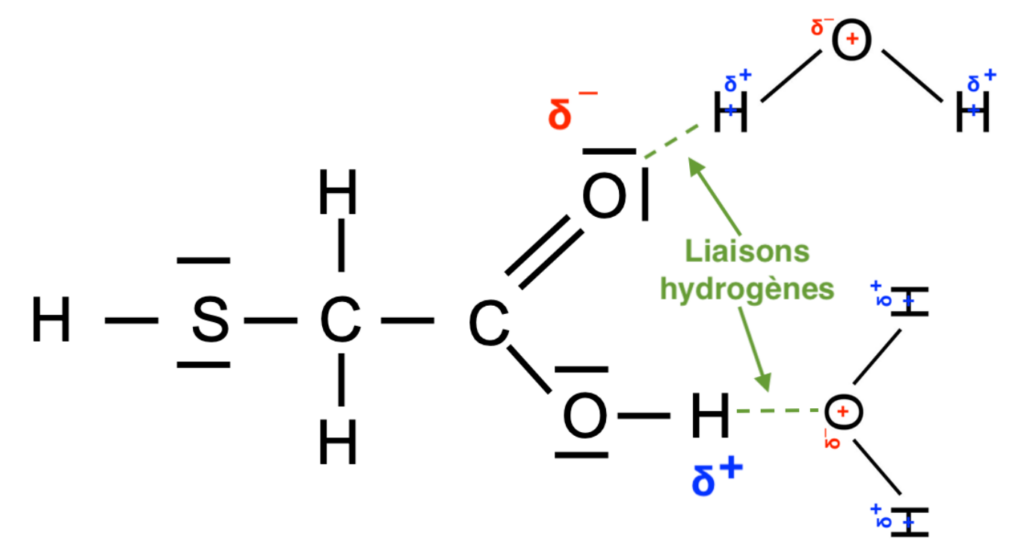
6. Citer, définir et représenter le type de liaison intermoléculaire modélisant la cohésion entre l’acide thioglycolique et l’eau.
L’eau est une molécule polaire et la molécule d’acide thioglycolique possède des atomes d’oxygène qui sont très électronégatifs.
Elles établissent entre elles des liaisons hydrogène.
Ces liaisons hydrogènes peuvent s’établir entre un atome d’hydrogène lié à un atome A et un atome B. Les atomes A et B pouvant être l’oxygène, le fluor ou l’azote (atomes de grande électronégativité). C’est ce qui explique la cohésion entre l’acide thioglycolique et l’eau.
Action de l’acide thioglycolique sur les cheveux
Les cheveux sont formés, entre autres, de molécules de cystine qui possèdent une liaison S- S que l’on appelle pont disulfure. Ces ponts participent à la forme naturelle du cheveu.
L’acide thioglycolique permet de modifier la forme du cheveu en rompant les liaisons S-S des ponts disulfures.
La molécule de cystine (notée R-S-S-R) est l’oxydant du couple rédox cystine/cystéine associé à la demi-équation électronique suivante :
R-S-S-R(aq) + 2H+(aq) + 2 e– =2 R-SH(aq)
L’acide thioglycolique est le réducteur du couple : C4H6O4S2(aq) / C2H4O2S(aq).
7. Écrire la demi-équation électronique associée au couple de l’acide thioglycolique.
L’acide thioglycolique est le réducteur du couple : C4H6O4S2(aq) / C2H4O2S(aq).
\[ \mathrm{ \text{C}_4\text{H}_6\text{O}_4\text{S}_2 \, \text{(aq)}/\text{C}_2\text{H}_4\text{O}_2\text{S} \, \text{(aq)} \quad : \quad \text{C}_4\text{H}_6\text{O}_4\text{S}_2 \, \text{(aq)} + 2\text{H}^+ \, \text{(aq)} + 2e^- = 2\text{C}_2\text{H}_4\text{O}_2\text{S} \, \text{(aq)} }\]
8. Écrire l’équation de la réaction modélisant l’action de l’acide thioglycolique sur la cystine.
Équation de la réaction modélisant l’action de l’acide thioglycolique C4H6O4S2(aq) sur la cystine R-S-S-R.
\[ \mathrm{ 2\text{C}_2\text{H}_4\text{O}_2\text{S} \, \text{(aq)} \rightarrow \text{C}_4\text{H}_6\text{O}_4\text{S}_2 \, \text{(aq)} + 2\text{H}^+ \, \text{(aq)} + 2e^- }\]
\[ \mathrm{ \text{R}-\text{S}-\text{S}-\text{R} \, \text{(aq)} + 2\text{H}^+ \, \text{(aq)} + 2e^- \rightarrow 2\text{R}-\text{SH} \, \text{(aq)} }\]
\[ \mathrm{ 2\text{C}_2\text{H}_4\text{O}_2\text{S} \, \text{(aq)} + \text{R}-\text{S}-\text{S}-\text{R} \, \text{(aq)} + 2\text{H}^+ \, \text{(aq)} \longrightarrow \text{C}_4\text{H}_6\text{O}_4\text{S}_2 \, \text{(aq)} + 2\text{R}-\text{SH} \, \text{(aq)} }\]
En simplifiant les \(\text{H}^+\) de part et d’autre de l’équation :
\[ \mathrm{ 2\text{C}_2\text{H}_4\text{O}_2\text{S} \, \text{(aq)} + \text{R}-\text{S}-\text{S}-\text{R} \, \text{(aq)} \longrightarrow \text{C}_4\text{H}_6\text{O}_4\text{S}_2 \, \text{(aq)} + 2\text{R}-\text{SH} \, \text{(aq)} }\]
Normes d’utilisation de l’acide thioglycolique dans les produits cosmétiques
L’acide thioglycolique n’est pas dénué de toxicité. C’est pourquoi la législation française impose des normes de concentration en acide thioglycolique strictes dans les produits cosmétiques.
Le décret 98-848 du 21 septembre 1998 stipule que seuls les coiffeurs sont autorisés à utiliser des produits renfermant de l’acide thioglycolique dont le pourcentage massique en acide thioglycolique est compris entre 8 % et 11 %.
Un élève désire déterminer la concentration en quantité de matière d’acide thioglycolique d’une lotion commerciale pour cheveux.
Il réalise le protocole suivant :
Étape 1 :
- diluer par 10 la lotion commerciale ;
- verser dans un erlenmeyer un volume V = 10 mL de lotion commerciale diluée au 10ième ;
- ajouter environ 30 mL d’acide chlorhydrique à 0,1 mol·L-1 ;
- ajouter un volume 𝑉1 = 20 mL de solution de diiode de concentration 𝐶1 = 0,047 mol·L-1.
Au cours de l’étape 1 l’acide thioglycolique (C2H4O2S) réagit avec le diiode (I2), cette transformation chimique, considérée comme totale, est modélisée par l’équation de réaction suivante :
I2(aq) + 2 C2H4O2S(aq) ⮕ 2 I–(aq) + 2 C4H6O4S2(aq) +2 H+(aq) (équation 1)
Étape 2 :
– ajouter ensuite goutte à goutte une solution de thiosulfate de sodium de concentration 𝐶2 = 0,10 mol·L-1 jusqu’à ce que la solution se décolore. Le volume de solution de thiosulfate de sodium versé pour atteindre l’équivalence est 𝑉𝐸 = 9,6 mL.
Au cours de l’étape 2 l’ion thiosulfate S2O32-(aq) réagi avec l’excès de diiode (I2) restant après l’étape 1, cette transformation, considérée comme totale, est modélisée par l’équation de réaction suivante :
I2(aq) + 2 S2O32-(aq) ⮕ 2 I–(aq) + S4O62-(aq) (équation 2)
L’élève a remarqué que toutes les solutions aqueuses contenant les espèces chimiques intervenant dans ces transformations sont incolores sauf la solution de diiode qui est de couleur marron.
L’élève a réalisé une photo de l’erlenmeyer à la fin de l’étape 1, juste avant d’y ajouter la solution de thiosulfate de sodium :
Solution de couleur marron

9. Déterminer la quantité de matière initiale de diiode introduite dans l’erlenmeyer lors de l’étape 1.
Déterminons la quantité de matière initiale de diiode introduite dans l’erlenmeyer lors de l’étape 1 :
\[ \mathrm{ C_1 = \frac{n_1}{V_1}}\]
\[ \mathrm{ \frac{n_1}{V_1} = C_1}\]
\[ \mathrm{ n_1 = C_1 \times V_1}\]
\[ \mathrm{ n_1 = 0{,}047 \times 20 \times 10^{-3}}\]
\[ \mathrm{ n_1 = 9{,}4 \times 10^{-4} \, \text{mol}}\]
10. Citer le fait expérimental qui témoigne que le diiode a été introduit en excès au cours de l’étape 1.
L’élève a remarqué que toutes les solutions aqueuses contenant les espèces chimiques intervenant dans ces transformations sont incolores sauf la solution de diiode qui est de couleur marron.
L’élève a réalisé une photo de l’erlenmeyer à la fin de l’étape 1, juste avant d’y ajouter la solution de thiosulfate de sodium :
La couleur marron indique la présence de diiode dans la solution. Il reste donc du diiode dans la solution à la fin de l’étape 1.
Ainsi, la couleur marron témoigne que le diiode a été introduit en excès au cours de l’étape 1.

11. Grâce à l’étape 2, déterminer que la quantité 𝑛f(I2) de diiode restant dans l’erlenmeyer à la fin de l’étape 1 est de 𝑛f(I2) = 4,8.10-4 mol.
\[ \mathrm{ \text{I}_2 \, \text{(aq)} + 2\text{S}_2\text{O}_3^{2-} \, \text{(aq)} \longrightarrow 2\text{I}^- \, \text{(aq)} + \text{S}_4\text{O}_6^{2-} \, \text{(aq)} }\]
À l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques :
\[ \mathrm{ \frac{n_f(\text{I}_2)}{1} = \frac{n(\text{S}_2\text{O}_3^{2-})_E}{2} }\]
Ainsi :
\[ \mathrm{ n_f(\text{I}_2) = \frac{n(\text{S}_2\text{O}_3^{2-})_E}{2} }\]
\[ \mathrm{ n_f(\text{I}_2) = \frac{C_2 \times V_E}{2} }\]
\[ \mathrm{ n_f(\text{I}_2) = \frac{0{,}10 \times 9{,}6 \times 10^{-3}}{2} }\]
\[ \mathrm{ n_f(\text{I}_2) = 4{,}8 \times 10^{-4} \, \text{mol} }\]
12. Déterminer la quantité 𝑛𝑟(𝐼2) de diiode ayant réagi dans l’erlenmeyer à la fin de l’étape 1 et en déduire la concentration en quantité de matière en acide thioglycolique de la lotion commerciale diluée 10 fois.
La quantité \( n_r(\text{I}_2) \) de diiode ayant réagi dans l’erlenmeyer à la fin de l’étape 1 est la quantité introduite moins la quantité restante (qui n’a pas réagi) :
\[ \mathrm{ n_r(\text{I}_2) = n_1 – n_f(\text{I}_2)}\]
\[ \mathrm{ n_r(\text{I}_2) = 9{,}4 \times 10^{-4} – 4{,}8 \times 10^{-4}}\]
\[ \mathrm{ n_r(\text{I}_2) = 4{,}6 \times 10^{-4} \, \text{mol}}\]
\[ \mathrm{ \text{I}_2 \, \text{(aq)} + 2\text{C}_2\text{H}_4\text{O}_2\text{S} \, \text{(aq)} \longrightarrow 2\text{I}^- \, \text{(aq)} + \text{C}_4\text{H}_6\text{O}_4\text{S}_2 \, \text{(aq)} + 2\text{H}^+ \, \text{(aq)}}\]
D’après l’équation :
\[ \mathrm{ \frac{n_r(\text{I}_2)}{1} = \frac{n(\text{C}_2\text{H}_4\text{O}_2\text{S})}{2}}\]
\[ \mathrm{ \frac{n(\text{C}_2\text{H}_4\text{O}_2\text{S})}{2} = \frac{n_r(\text{I}_2)}{1}}\]
\[ \mathrm{ n(\text{C}_2\text{H}_4\text{O}_2\text{S}) = 2n_r(\text{I}_2)}\]
\[ \mathrm{ C_{\text{acide thioglycolique dilué}} \times V = 2n_r(\text{I}_2)}\]
\[ \mathrm{ C_{\text{acide thioglycolique dilué}} = \frac{2n_r(\text{I}_2)}{V}}\]
\[ \mathrm{ C_{\text{acide thioglycolique dilué}} = \frac{2 \times 4{,}6 \times 10^{-4}}{10 \times 10^{-3}}}\]
\[ \mathrm{ C_{\text{acide thioglycolique dilué}} = 9{,}2 \times 10^{-2} \, \text{mol} \cdot \text{L}^{-1}}\]
13. Vérifier que la concentration en quantité de matière d’acide thioglycolique de la lotion commerciale pour cheveux est bien égale à 𝐶 = 0,92 mol·L-1.
La lotion commerciale a été diluée 10 fois :
\[ \mathrm{ C_{\text{acide thioglycolique commerciale}} = 10 \times C_{\text{acide thioglycolique diluée}}}\]
\[ \mathrm{ C_{\text{acide thioglycolique commerciale}} = 10 \times 9{,}2 \times 10^{-2}}\]
\[ \mathrm{ C_{\text{acide thioglycolique commerciale}} = 0{,}92 \, \text{mol} \cdot \text{L}^{-1}}\]
La masse volumique de la lotion commerciale, à 25 °C, est 𝜌 = 1,03 kg·L-1.
14. Conclure quant à l’utilisation de cette lotion commerciale pour cheveux par les coiffeurs.
Calculons le pourcentage massique en acide thioglycolique de la solution commerciale :
\[ \mathrm{ P_{\text{acide}} = \frac{m_{\text{acide}}}{m_{\text{solution}}}}\]
Or,
\[ \mathrm{ n_{\text{acide}} = \frac{m_{\text{acide}}}{M_{\text{acide}}}}\]
\[ \mathrm{ \frac{m_{\text{acide}}}{M_{\text{acide}}} = n_{\text{acide}}}\]
\[ \mathrm{ m_{\text{acide}} = n_{\text{acide}} \times M_{\text{acide}}}\]
D’où,
\[ \mathrm{ P_{\text{acide}} = \frac{n_{\text{acide}} \times M_{\text{acide}}}{m_{\text{solution}}}}\]
Or,
\[ \mathrm{ n_{\text{acide}} = C_{\text{acide thioglycolique commerciale}} \times V_{\text{solution}}}\]
D’où,
\[ \mathrm{ P_{\text{acide}} = \frac{C_{\text{acide thioglycolique commerciale}} \times V_{\text{solution}} \times M_{\text{acide}}}{m_{\text{solution}}}}\]
Or,
\[ \mathrm{ \rho_{\text{solution}} = \frac{m_{\text{solution}}}{V_{\text{solution}}}}\]
\[ \mathrm{ \frac{m_{\text{solution}}}{V_{\text{solution}}} = \rho_{\text{solution}}}\]
\[ \mathrm{ m_{\text{solution}} = \rho_{\text{solution}} \times V_{\text{solution}}}\]
D’où,
\[ \mathrm{ P_{\text{acide}} = \frac{C_{\text{acide thioglycolique commerciale}} \times V_{\text{solution}} \times M_{\text{acide}}}{\rho_{\text{solution}} \times V_{\text{solution}}}}\]
\[ \mathrm{ P_{\text{acide}} = \frac{C_{\text{acide thioglycolique commerciale}} \times M_{\text{acide}}}{\rho_{\text{solution}}}}\]
\[ \mathrm{ P_{\text{acide}} = \frac{0{,}92 \times 92{,}1}{1{,}03 \times 10^3}}\]
\[ \mathrm{ P_{\text{acide}} = 0{,}082}\]
\[ \mathrm{ P_{\text{acide}} = 8{,}2 \%}\]
Le décret 98-848 du 21 septembre 1998 stipule que seuls les coiffeurs sont autorisés à utiliser des produits renfermant de l’acide thioglycolique dont le pourcentage massique en acide thioglycolique est compris entre 8 % et 11 %.
Ce produit contient 8,2% en masse d’acide thioglycolique. Ce pourcentage est dans l’intervalle de valeurs autorisé par le décret.
Ainsi, cette lotion commerciale pour cheveux peut être utilisée par les coiffeurs.
