ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH120
Télécharger l’exercice en PDF :
Le fer est l’élément chimique de numéro atomique 26 et de symbole Fe. Le corps d’un être humain en renferme essentiellement dans les globules rouges et les muscles. Le rôle principal du fer dans l’organisme est de transporter l’oxygène dans le sang et de permettre la bonne oxygénation des organes.
Le fer est donc un élément indispensable au fonctionnement du corps humain et les besoins en fer alimentaire sont donc très importants.
L’objectif de l’exercice est de comprendre le rôle du fer dans l’organisme et d’identifier un aliment pouvant favoriser un apport en fer.
Rôle du fer dans l’organisme
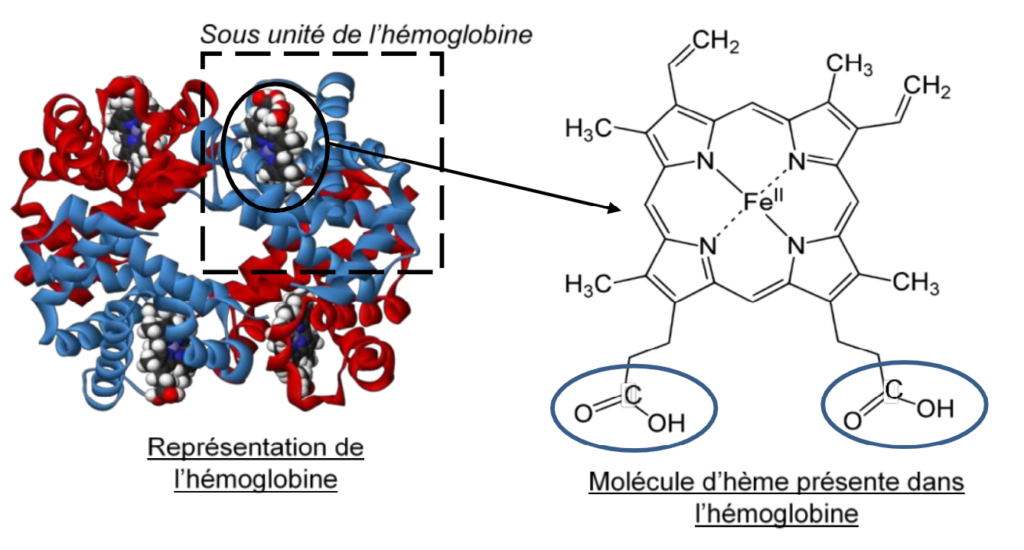
Plus précisément, le fer est un constituant de l’hémoglobine qui est une protéine présente dans les globules rouges du sang. C’est cette protéine qui va permettre aux globules rouges de transporter l’oxygène des poumons vers tous les autres organes, grâce à la molécule d’hème au centre de laquelle figure le fer sous forme ionique :
Données :
Numéros atomiques : carbone Z = 6 ; oxygène : Z = 8
1. Nommer la famille associée aux groupes caractéristiques dont les formules semi- développées sont entourées dans la molécule d’hème ci-dessus.
La famille associée aux groupes caractéristiques dont les formules semi-développées sont entourées dans la molécule d’hème ci-dessus est la famille des acides carbonyliques.
L’hémoglobine transporte l’oxygène jusqu’aux organes grâce au fer. C’est en effet sur le fer de l’hème que se fixent les molécules de dioxygène O2 grâce aux doublets d’électrons des atomes d’oxygènes.
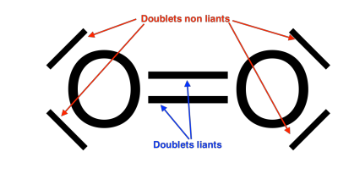
2. Représenter le schéma de Lewis d’une molécule de dioxygène et préciser la nature des doublets d’électrons présents dans cette molécule.
Z(O) = 8 Configuration électronique de l’oxygène : 1s2 2s2 2p4.
Électrons de valence de l’oxygène : 2+4=6
Structure électronique du gaz noble le plus proche : 1s2 2s2 2p6
Électrons engagés dans une liaison covalente : 8−6=2
Doublets liants : 2
Électrons non engagés dans une liaison covalente : 6−2=4
Doublets non liants : 4/2=2
L’oxygène à 2 liaisons covalentes et 2 doublets non liants.
Schéma de Lewis d’une molécule de dioxygène
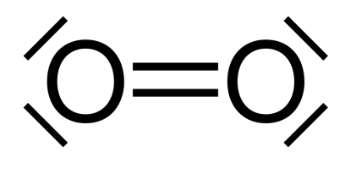
L’hémoglobine favorise également l’évacuation du dioxyde de carbone CO2.
3. Représenter le schéma de Lewis d’une molécule de dioxyde de carbone.
- Z(C) = 6 : Configuration électronique du carbone : 1s2 2s2 2p2.
Électrons de valence du carbone : 2+2=4
Structure électronique du gaz noble le plus proche : 1s2 2s2 2p6
Électrons engagés dans une liaison covalente : 8−4=4
Doublets liants : 4
Électrons non engagés dans une liaison covalente : 4−4=0
Doublets non liants : 0/2=0
Le carbone à 4 liaisons covalentes et 0 doublets non liants.
L’oxygène à 2 liaisons covalentes et 2 doublets non liants.(voir question 2)
Schéma de Lewis de la molécule de dioxyde de carbone CO2 :
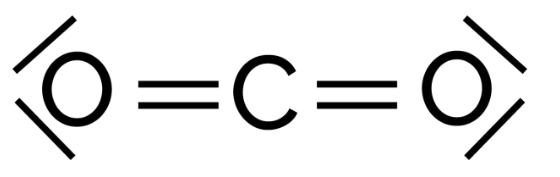
4. Justifier la géométrie linéaire d’une molécule de dioxyde de carbone :
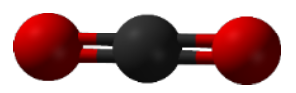
La géométrie linéaire d’une molécule de dioxyde de carbone (CO₂) peut être expliquée à l’aide de la répulsion des paires d’électrons de la couche de valence.
Les paires d’électrons autour de l’atome central (carbone) vont se disposer de manière à minimiser la répulsion entre elles.
La disposition qui minimise la répulsion est une ligne droite, donnant à la molécule une géométrie linéaire.
Titrage du fer dans un lait de soja
En l’absence de fer, l’organisme ne peut plus former d’hémoglobine et n’est donc plus capable d’assurer le transport de l’oxygène, d’où l’importance de son apport dans l’alimentation.
Un élève veut déterminer la teneur en fer d’un lait de soja.
Le lait de soja est une boisson produite à base de graines de soja et d’eau. D’aspect proche du lait de vache et de composition également proche sur plusieurs points, il est communément appelé « lait de soja » dans les pays francophones et souvent utilisé comme substitut au lait de vache dans l’alimentation et la cuisine, en particulier végétaliennes.
Source : D’après Wikipédia (septembre 2020)

Dans le lait de soja titré dans la suite de l’exercice, l’élément fer est présent sous forme d’ions fer II, de formule Fe2+(aq).
L’élève va déterminer la quantité d’ions fer II présents dans un lait de soja en réalisant un titrage avec une réaction d’oxydo-réduction support du titrage.
Pour cela, il titre un volume V2 = 20 mL de lait de soja par une solution aqueuse rose-violette de permanganate de potassium (K+(aq) + MnO4– (aq)) de concentration en quantité de matière C1 = 4,0×10-5 mol·L-1.
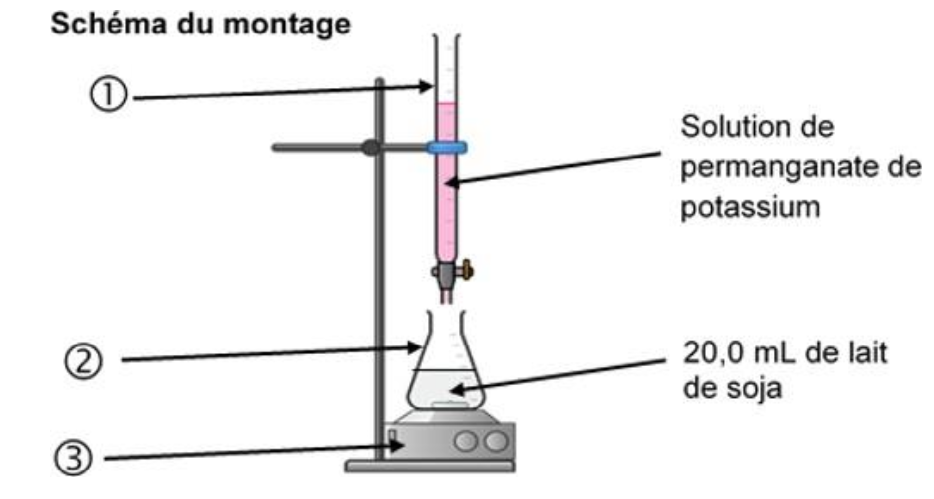
Le montage effectué pour ce titrage est schématisé ci-dessous :
Données :
- Couples oxydant-réducteur impliqués dans le titrage
Couple 1 : MnO4¯ (aq)/ Mn2+(aq) associé à la demi-équation électronique suivante :
MnO4¯ (aq) + 8 H+(aq) + 5 e– = Mn2+(aq) + 4 H2O(l)
Couple 2 : Fe3+(aq) / Fe2+(aq)
- Couleurs des espèces chimiques : les ions permanganate MnO4¯(aq) donnent une coloration rose-violette aux solutions aqueuses qui les contiennent. En revanche, les ions Mn2+(aq), Fe3+(aq) et Fe2+(aq) ne modifient pas significativement la couleur du lait de soja.
- Masse molaire atomique : M(Fe) = 55,8 g·mol-1
Étude du montage
5. Nommer le matériel du montage effectué pour ce titrage correspondant aux numéros ➀, ② et ③. Indiquer la verrerie dans laquelle doit être introduite la solution titrante.
Matériel du montage effectué pour ce titrage correspondant aux numéros ①, ② et ③ :
① : burette graduée
② : erlenmeyer
③ : agitateur magnétique
La solution titrante doit être introduite dans une burette graduée.
6. Parmi la verrerie ci-dessous, dire, en justifiant votre choix, celle qui est la plus adaptée pour faire le prélèvement des 20 mL de lait de soja :
- Éprouvette graduée
- Pipette jaugée
- Bécher
Parmi la verrerie proposée, pour faire le prélèvement on peut utiliser une éprouvette graduée ou une pipette jaugée.
La verrerie la plus adaptée pour faire le prélèvement des 20 mL de lait de soja est celle avec la meilleure précision : une pipette jaugée.
Réaction support du titrage
7. Établir, à l’aide des couples oxydant-réducteur donnés, l’équation de la réaction d’oxydo-réduction support du titrage suivante :
MnO4¯ (aq) + 5 Fe2+(aq) + 8 H+(aq) → Mn2+(aq) + 5 Fe3+(aq) + 4 H2O(l)
D’après le sujet : l’élément fer est présent sous forme d’ions fer II, de formule Fe2+(aq) est titré par une solution aqueuse rose-violette de permanganate de potassium (K+(aq) + MnO4— (aq)) :
MnO4¯ (aq)/ Mn2+(aq) : MnO4¯ (aq) + 8 H+(aq) + 5 e– = Mn2+(aq) + 4 H2O(l)
Fe3+(aq) / Fe2+(aq) : x5 Fe2+(aq) = Fe3+(aq) + e–
MnO4¯ (aq) + 8 H+(aq) + 5 Fe2+(aq) + 8 H+(aq) → Mn2+(aq)+ 4 H2O(l) + 5 Fe3+(aq)
Dans la même forme que le sujet :
MnO4¯ (aq) + 5 Fe2+(aq) + 8 H+(aq) → Mn2+(aq) + 5 Fe3+(aq) + 4 H2O(l)
8. Indiquer le rôle (oxydant ou réducteur) joué par les ions fer II dans cette réaction. Justifier la réponse.
Les ions fer II Fe2+ cèdent des électrons : ils jouent le rôle de réducteur.
Équivalence du titrage
9. Définir l’équivalence d’un titrage.
L’équivalence est atteinte lorsque les réactifs ont été introduits dans les proportions stœchiométriques.
10. En raisonnant sur l’évolution des quantités de matière des espèces chimiques présentes dans la verrerie ②, expliquer comment s’effectue le repérage de l’équivalence lors de ce titrage.
L’ions Fe2+ est incolore et le permanganate de potassium est rose-violet.
Avant l’équivalence, le permanganate de potassium est le réactif limitant et l’ions Fe2+ le réactif en excès. Le mélange est de la couleur du réactif en excès : il est incolore.
Après l’équivalence, le permanganate de potassium est le réactif en excès et l’ions Fe2+ le réactif limitant. Le mélange est de la couleur du réactif en excès : il est magenta.
Ainsi, à l’équivalence on observe un changement de couleur de l’incolore au rose-violet.
L’équivalence est obtenue en versant un volume de permanganate de potassium égal à V1,e = 11,7 mL.
11. Déterminer la quantité de matière d’ions permanganate MnO4¯(aq), notée n1,e, versée pour atteindre l’équivalence.
\( n_{1,e} = c_1 \, V_{1,e} \)
\( n_{1,e} = 4{,}0 \times 10^{-5} \times 11{,}7 \times 10^{-3} \)
\( n_{1,e} = 4{,}7 \times 10^{-7} \, \text{mol} \)
On note n2,i la quantité de matière initiale d’ions fer II, Fe2+(aq), présents dans les 20 mL de lait de soja.
12. Etablir la relation entre les quantités de matière de réactifs introduites pour atteindre l’équivalence.
MnO4¯ (aq) + 5 Fe2+(aq) + 8 H+(aq) → Mn2+(aq) + 5 Fe3+(aq) + 4 H2O(l)
À l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques :
\[ \mathrm{ \frac{n(\text{Fe}^{2+})}{5} = \frac{n(\text{MnO}_4^-)_\text{vE}}{1}}\]
\[ \mathrm{ \frac{n_{2,i}}{5} = \frac{n_{1,e}}{1}}\]
13. Déterminer la quantité de matière initiale d’ions fer II, Fe2+(aq), présents dans les 20 mL de lait de soja.
\( \frac{n_{2,i}}{5} = \frac{n_{1,e}}{1} \)
\( \frac{n_{2,i}}{5} = n_{1,e} \)
\( n_{2,i} = 5 \times n_{1,e} \)
\( n_{2,i} = 5 \times 4{,}7 \times 10^{-7} \)
\( n_{2,i} = 2{,}4 \times 10^{-6} \, \text{mol} \)
\( n_{2,i} = 2{,}35 \times 10^{-6} \, \text{mol} \) si on ne prend pas en compte les chiffres significatifs (pour la remarque de la question suivante).
Afin de vérifier la fiabilité de sa mesure, l’élève cherche des informations sur le lait de soja. Le site Wikipédia lui fournit l’information suivante :
| Composition moyenne d’un lait de soja en fer (pour 100 mL) | 0,64 mg |
14. Indiquer si le résultat obtenu à la question précédente (n2,i proche de 2,34×10 – 6 mol) est cohérent ou pas avec les informations obtenues par les recherches internet effectuées par l’élève. Justifier votre réponse.
Le candidat est invité à présenter son raisonnement de manière claire et ordonnée. Toute tentative de réponse, même incomplète, sera valorisée.
Calculons la masse de fer contenue dans les 20 mL de ce lait de soja :
\( n = \frac{m}{M} \)
\( m = n \times M \)
\( m = 2{,}34 \times 10^{-6} \times 55{,}8 \)
\( m = 1{,}31 \times 10^{-4} \, \text{g} \)
Calculons la masse de fer contenue dans les 100 mL de ce lait de soja :
| 20 mL | 1,31×10-4g |
| 100 mL | m’ |
\[ \mathrm{ m’ = \frac{100 \times 1{,}31 \times 10^{-4}}{20}}\]
\[ \mathrm{ m’ = 6{,}55 \times 10^{-4} \, \text{g}}\]
\[ \mathrm{ m’ = 0{,}655 \times 10^{-3} \, \text{g}}\]
\[ \mathrm{ m’ = 0{,}655 \, \text{mg}}\]
La valeur trouvée est proche de la composition moyenne d’un lait de soja en fer (pour 100 mL)
0,64 mg.
Ainsi, le résultat obtenu à la question précédente (n2,i proche de 2,34×10—6 mol) est cohérent avec les informations obtenues par les recherches internet effectuées par l’élève.
