ÉVALUATION – 10 points – Durée 1h – calculatrice autorisée
Sujet 2024 n°SPEPHCH106 et n°SPEPHCH114
Télécharger l’exercice en PDF :
Le frelon asiatique, un danger pour les abeilles
Apiculteur amateur à Montévrain, Francis Gandon insiste sur la nécessité de combattre le frelon asiatique
: « C’est inquiétant pour nos abeilles mais aussi pour la pollinisation nécessaire à la survie des plantes et des arbres. Leur présence aux abords des ruches stresse les butineuses qui refusent de sortir ».

Le géraniol est peut-être une solution pour lutter contre le frelon asiatique.
Une publication de 2014, signée du Centre national de recherche scientifique (CNRS), de l’Institut national de la recherche agronomique (Inra) et l’Université de Bordeaux, identifie parmi une trentaine de produits testés, trois produits qui attirent le frelon et le font rester longtemps dans le piège. L’un d’eux est le géraniol, un alcool insaturé présent dans différentes plantes et également produit par les abeilles (phéromone).
Sources : texte https://www.leparisien.fr/seine-et-marne-77/marne-et-gondoire et photo wikipédia
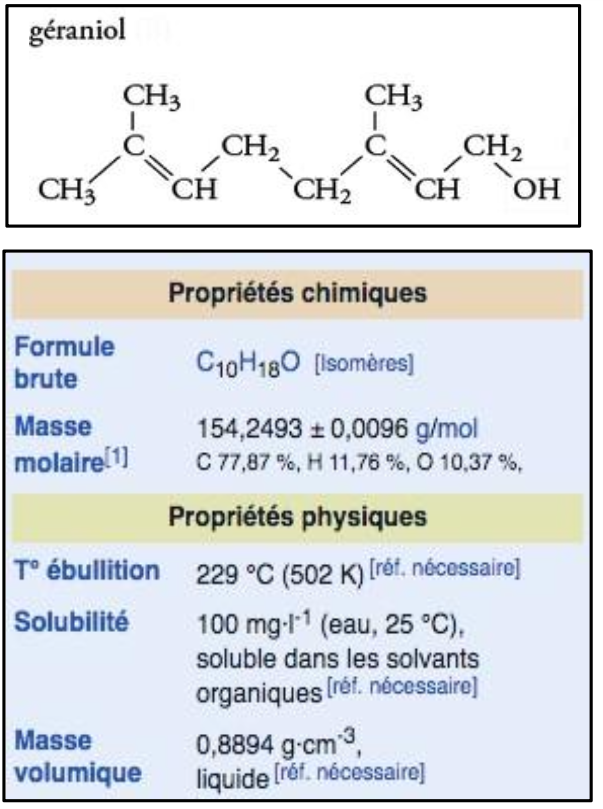
Le géraniol est un alcool insaturé. Il constitue une majeure partie de l’essence de rose et de palmarosa. Il est également présent dans les huiles essentielles de géranium, citron et citronnelle.
Son odeur de rose est couramment utilisée en parfumerie, notamment pour créer les parfums comme la pêche, la framboise, le pamplemousse…
On peut également utiliser cette molécule comme répulsif d’insectes. Bien qu’il chasse les moustiques, mouches, cancrelats, fourmis et les tiques, il est produit par les abeilles pour les aider à marquer les fleurs à nectar et localiser l’entrée de leurs ruches.
Source : extraits de https://fr.wikipedia.org/wiki/G%C3%A9raniol
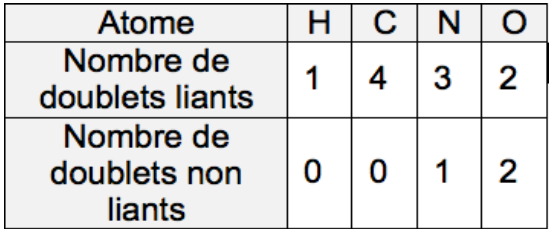
Données
- Tableau présentant le nombre de doublets liants et non liants de quelques atomes engagés dans une molécule :
- Valeurs de l’électronégativité de quelques éléments :

- Cercle chromatique :
Présentation du géraniol, un alcool insaturé
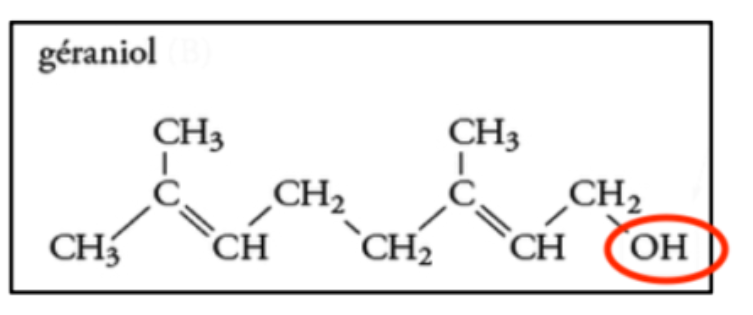
1. Recopier la formule semi-développée de la molécule de géraniol et entourer le groupe d’atomes caractéristique de la famille des alcools.
2. Représenter le schéma de Lewis de la molécule de géraniol.
La molécule de géraniol contient des atomes de carbone, hydrogène et oxygène.
D’après le tableau donné, les atomes de carbone et d’hydrogène n’ont pas de doublets non liants. L’atome d’oxygène en a 2.
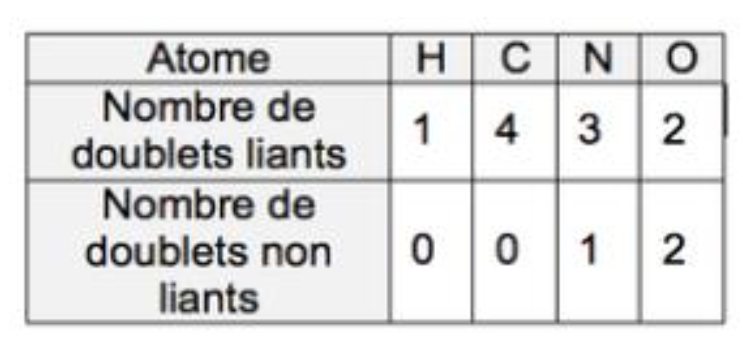
On ajoute donc deux doublets non liants à l’atome d’oxygène dans la molécule de géraniol.
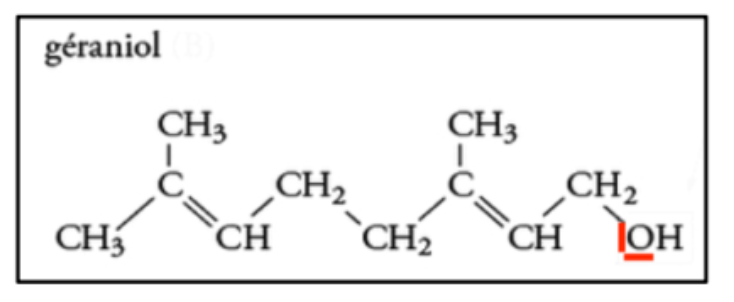
3. Nommer la géométrie autour de l’atome d’oxygène du géraniol.
L’atome d’oxygène du géraniol fait deux liaisons simples et porte deux doublets non liants : la géométrie autour de l’atome d’oxygène du géraniol est coudée.
4. Déterminer le caractère polaire ou apolaire de la molécule de géraniol.
Calculons la différence d’électronégativité entre l’atome d’oxygène et l’atome d’hydrogène :
∆χ=χ(O)-χ(H)
∆χ=3,5-2,2
∆χ=1,3
∆χ>0,4 : la liaison O—H est polaire.
Calculons la différence d’électronégativité entre l’atome de carbone et l’atome d’hydrogène :
∆χ=χ(C)-χ(H)
∆χ=2,5-2,2
∆χ=0,3
0≤∆χ≤0,4 : la liaison C—H n’est polaire.
Calculons la différence d’électronégativité entre l’atome d’oxygène et l’atome de carbone :
∆χ=χ(O)-χ(C)
∆χ=3,5-2,5
∆χ=1,0
∆χ>0,4 : la liaison C—O est polaire.
Le géraniol à des liaisons O—H et C—O sui sont polaires. Le géraniol est une molécule polaire.
5. Prévoir la solubilité du géraniol dans l’eau et dans les solvants organiques.
L’eau est une molécule polaire et la molécule de géraniol également.
L’eau et le géraniol établissent entre elles des liaisons hydrogène.
C’est pourquoi le géraniol est soluble dans l’eau.
Les solvants organiques sont apolaires et la molécule de géraniol est polaire. C’est pourquoi le géraniol n’est pas soluble dans les solvants organiques.
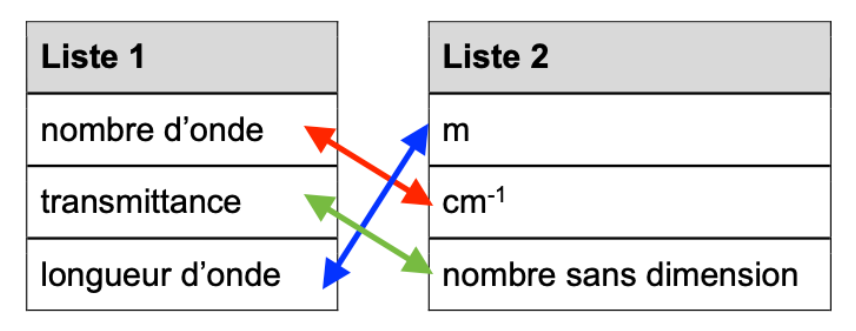
La liste 1 suivante concerne les grandeurs associées à un spectre infrarouge, la liste 2 concernent les unités de ces grandeurs.
| Liste 1 |
| nombre d’onde |
| transmittance |
| longueur d’onde |
| Liste 2 |
| m |
| cm−1 |
| nombre sans dimension |
6. Associer chaque grandeur de la liste 1 à son unité de la liste 2.
Le nombre d’onde s’exprime en cm-1
La transmittance est nombre sans dimension
La longueur d’onde s’exprime en mètre m
Synthèse du géraniol
Comme de nombreuses espèces chimiques naturelles, le géraniol peut être synthétisé par les chimistes. Il existe différentes voies de synthèse possibles pour le géraniol et elles comportent plusieurs étapes. Ce paragraphe de l’exercice s’intéresse à l’aspect expérimental de certaines étapes d’une synthèse. Lors de la première étape de la synthèse du géraniol, les réactifs sont placés dans le ballon surmonté d’un réfrigérant.
7. Expliquer le rôle du réfrigérant dans ce montage de synthèse.
Le réfrigérant dans ce montage de synthèse permet de récupérer les éléments qu’i s’évaporent lors de la synthèse. Il permet ne pas avoir de perte.
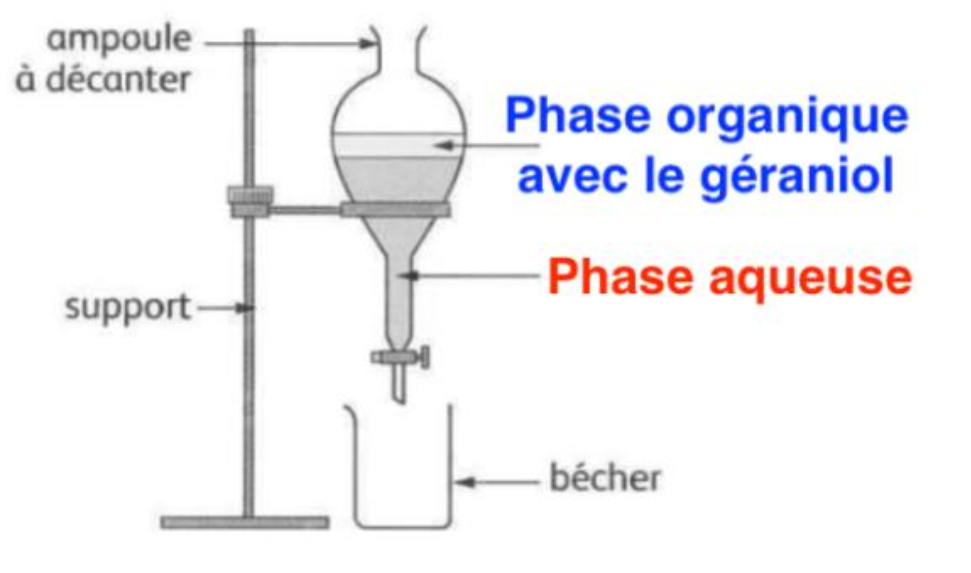
Lors de la phase suivante de la synthèse, on doit extraire le géraniol du mélange réactionnel. À cette fin, on a versé doucement le contenu du ballon dans un bécher contenant une solution glacée acidifiée, puis une ampoule à décanter permet de séparer les deux phases liquides non miscibles : la phase aqueuse de densité environ égale à 1 et la phase organique qui contient le géraniol de densité inférieure à 1.
8. Schématiser l’ampoule à décanter en indiquant la position des deux phases organique et aqueuse.
La phase aqueuse de densité environ égale à 1 et la phase organique qui contient le géraniol de densité inférieure à 1 : la phase organique qui contient le géraniol est moins dense que l’eau, elle est au-dessus de l’eau.
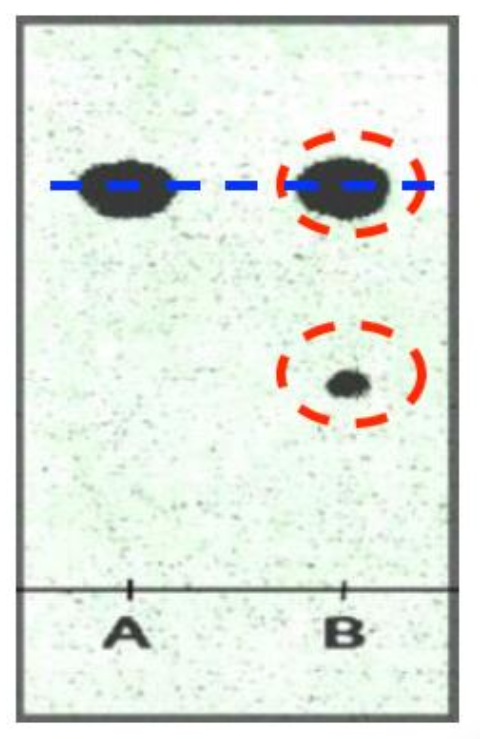
Après avoir isolé la phase organique, il est nécessaire de l’analyser afin de vérifier la pureté en géraniol, pour cela le technicien utilise une chromatographie sur couche mince :
Deux dépôts d’échantillons sont réalisés sur la plaque de silice :
- en A : géraniol de référence pur,
- en B : produit brut obtenu par synthèse,
Après élution par un éluant adapté, le chromatogramme révélé par lampe UV est présenté ci-contre.

9. Conclure, en argumentant votre réponse, sur la pureté en géraniol du produit synthétisé.
Le produit brut obtenu par synthèse (B) présente deux taches dans la chromatographie sur couche mince.
Une tache est sur le même niveau que la tâche du géraniol de référence pur (A). Ainsi, il y a du géraniol dans le produit obtenu par synthèse.
En conclusion, le produit obtenu par synthèse contient du géraniol et une autre espèce : il contient des imputées.
Le géraniol de synthèse doit vérifier les critères suivants pour pouvoir être utilisé comme attractant dans les pièges à frelons asiatiques :
- La teinte jde la substance chimique synthétisé doit être jaune.
- La pureté P de la substance chimique synthétisé doit être supérieur ou égal à 98,5 % en masse (100 g de produit doit contenir au minimum 98,5 g de géraniol).
Le technicien décide de purifier le produit synthétisé obtenu puis il le pèse et l’analyse. Il obtient une masse de produit de synthèse brut mbrut = 6,4 g dont il détermine la masse en géraniol pur mgéraniol = 6,2 g. Il réalise également le spectre d’absorption UV-visible du produit de synthèse obtenu et obtient une longueur d’onde au maximum d’absorption λmax = 450 nm.
10. Déterminer la valeur de la pureté en pourcentage massique du produit synthétisé. Puis conclure si le géraniol de synthèse obtenu pourra être utilisé comme attractant dans les pièges à frelons asiatiques.
Déterminons la valeur de la pureté en pourcentage massique du produit synthétisé :
\[ \mathrm{ P = \frac{m_{\text{géraniol}}}{m_{\text{brut}}}}\]
\[ \mathrm{ P = \frac{6{,}2}{6{,}4}}\]
\[ \mathrm{ P = 0{,}97}\]
\[ \mathrm{ P = 97 \, \%}\]
La pureté P de la substance chimique synthétisé doit être supérieur ou égal à 98,5 % en masse pour pouvoir être utilisé comme attractant dans les pièges à frelons asiatiques.
La pureté obtenue est inférieure au critère : le géraniol de synthèse obtenu ne pourra pas être utilisé comme attractant dans les pièges à frelons asiatiques.
La quantité de matière de réactif limitant utilisé est n0 = 0,05 mol, et on considère que les nombres stœchiométriques apparaissant dans les équations des réactions chimiques mises en jeu lors de la synthèse sont tous égaux à 1.
11. Déterminer le rendement de la synthèse après purification.
La quantité de matière de réactif limitant utilisée est \( n_0 = 0{,}05 \) mol, et les nombres stœchiométriques apparaissant dans les équations des réactions chimiques mises en jeu lors de la synthèse sont tous égaux à 1. On en déduit \( x_{\text{max}} \) :
\[ \mathrm{x_{\text{max}} = n_0}\]
\[ \mathrm{x_{\text{max}} = 0{,}05 \, \text{mol}}\]
Déterminons la masse maximale de géraniol qu’il est possible d’obtenir si la transformation est considérée comme totale :
\[ \mathrm{m_{\text{géraniol}}^{\text{max}} = \frac{m_{\text{géraniol}}^{\text{max}}}{M_{\text{géraniol}}}}\]
\[ \mathrm{\frac{m_{\text{géraniol}}^{\text{max}}}{M_{\text{géraniol}}} = m_{\text{géraniol}}^{\text{max}}}\]
\[ \mathrm{m_{\text{géraniol}}^{\text{max}} = n_{\text{géraniol}}^{\text{max}} \times M_{\text{géraniol}}}\]
Or
\[ \mathrm{n_{\text{géraniol}}^{\text{max}} = x_{\text{max}}}\]
\[ \mathrm{m_{\text{géraniol}}^{\text{max}} = x_{\text{max}} \times M_{\text{géraniol}}}\]
\[ \mathrm{m_{\text{géraniol}}^{\text{max}} = 0{,}05 \times 154{,}2493}\]
\[ \mathrm{m_{\text{géraniol}}^{\text{max}} = 7{,}7 \, \text{g}}\]
Déterminons le rendement :
\[ \mathrm{\eta = \frac{m_{\text{géraniol}}^{\text{expérimentale}}}{m_{\text{géraniol}}^{\text{max}}}}\]
\[ \mathrm{\eta = \frac{6{,}2}{7{,}7}}\]
\[ \mathrm{\eta = 0{,}81}\]
\[ \mathrm{\eta = 81 \, \%}\]
Le rendement de cette synthèse est de 81 %.
