Enseignement scientifique Terminale
Durée 1h – 10 points – Thème « Le futur des énergies »
Sujet n°ENSSCI3178
Télécharger l’exercice en PDF :
Lancé en 2016, l’observatoire climat-énergie dresse le bilan des efforts réalisés par la France pour organiser la transition énergétique.
L’objectif de cet exercice est d’étudier les émissions des gaz à effet de serre en France, plus particulièrement dans le domaine des transports.
Document 1 – Émissions de gaz à effet de serre en France
Les émissions nationales de gaz à effet de serre (représentées ici par la masse équivalente de CO2 en millions de tonnes émise chaque année) ont baissé de 4,2 % entre 2017 et 2018 après trois années de hausse consécutives. Cette réduction est en partie liée à un hiver plus doux qui a nécessité une utilisation moins importante de chauffage.
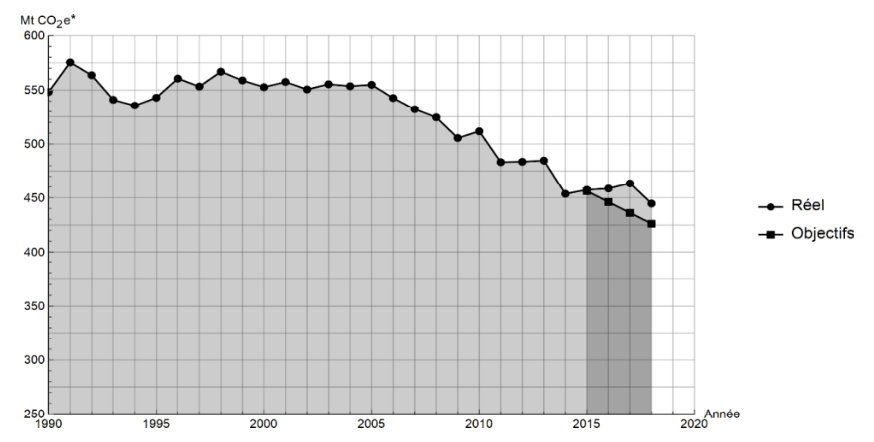
* Mt CO2 e : masse équivalente de dioxyde de carbone émise par les activités humaines en millions de tonnes
Source : d’après https://www.observatoire-climat-energie.fr
1- En s’appuyant sur le document 1, indiquer si les objectifs sur les émissions de gaz à effet de serre ont été atteints par la France depuis 2015. Justifier la réponse.
D’après le document 1 : les émissions de gaz à effet de serre réels sont supérieures aux objectifs pour les 3 années 2016, 2017 et 2018.
Ainsi, les objectifs sur les émissions de gaz à effet de serre n’ont pas été atteints par la France depuis 2015.
2- Expliquer pourquoi l’émission de dioxyde carbone est l’une des causes du réchauffement climatique.
Le dioxyde carbone est un gaz à effet de serre. L’augmentation de la concentration des gaz à effet de serre est responsable d’un forçage radiatif positif. Cela conduit à une augmentation de la température.
C’est pourquoi l’émission de dioxyde carbone est l’une des causes du réchauffement climatique.
On souhaite déterminer à présent à la masse de dioxyde de carbone produite lors de la combustion du cétane (voir le document 2).
Document 2 – Émission de gaz à effet de serre dans les transports ; combustion au sein d’un moteur Diesel
Dans les transports, les émissions de gaz à effet de serre dépassent de 12,6 % la part annuelle du budget carbone qui leur est affectée.
Ce document prend exemple d’un moteur Diesel présent dans une voiture. Les moteurs Diesel fonctionnent par combustion dans un moteur thermique : une réaction chimique a lieu entre le carburant (appelé combustible) et le dioxygène de l’air (appelé comburant). Cette réaction est exothermique.
Pour les moteurs Diesel, le composé principal est le cétane, de formule brute C16H34. L’équation de la combustion complète s’écrit :
C16H34(l) +49/2 O2(g) ➜ 16 CO2(g)+ 17 H2O(l)
L’unité de quantité de matière utilisée par le chimiste est la mole.
Dans l’équation de la combustion du cétane pour 1 mole de cétane consommée, 16 moles de dioxyde de carbone, CO2, sont libérées sous forme gazeuse.
La masse m (en kg) est reliée à la quantité de matière n (en mol) :
- une masse mcétane =0,226 kg de cétane correspond à une quantité de matière n = 1 mol de cétane ;
- une masse mdioxyde de carbone = 0,044 kg de dioxyde de carbone correspond à une quantité de matière n = 1 mol de dioxyde de carbone.
L’énergie massique dégagée par la combustion de cétane est 42,3 MJ / kg : ce qui signifie que pour 1 kg de cétane brûlé, une énergie de 42,3 MJ est dégagée.
3- Vérifier que la masse de cétane consommée pour la production d’une énergie E = 1 MJ est égale à mcétane= 0,024 kg.
L’énergie massique dégagée par la combustion de cétane est 42,3 MJ/kg: ce qui signifie que pour 1 kg de cétane brûlé, une énergie de 42,3 MJ est dégagée.
| 1 kg | 42,3 MJ |
| mcétane | 1 MJ |
$m_{cétane}=(1\times1)/42,3$
$m_{cétane}=0,024\ Kg$
4- En déduire la quantité de matière de cétane (en mole) consommée lors d’une combustion qui dégage 1 MJ.
Une masse m cétane = 0,226 kg de cétane correspond à une quantité de matière n = 1 mol de cétane
| 0,226 kg | 1 mol |
| 0,024 Kg | $n_{cétane}$ |
$n_{cétane}=(0,024\times1)/0,226$
$n_{cétane}=0,11\ mol$
5- En utilisant la valeur ncétane= 0,11 mol, calculer la masse mdioxyde de carbone de dioxyde de carbone formé par sa combustion.
Dans l’équation de la combustion du cétane pour 1 mole de cétane consommée, 16 moles de dioxyde de carbone, CO2, sont libérées sous forme gazeuse.
| 1 mole de cétane | 16 moles de dioxyde de carbone |
| 0,11 mol de cétane | $n_{(CO_2)}$ moles de dioxyde de carbone |
$n_{(CO_2)}=(0,11\times16)/1$
$n_{(CO_2)}=1,76\ mol$
Une masse m CO2 = 0,044 kg de dioxyde de carbone correspond à une quantité de matière n= 1 mol de dioxyde de carbone.
| 0,044 kg | 1 mol |
| $m_{(CO_2)}$ | 1,76 mol |
$m_{(CO_2)}=(1,76\times0,044)/1$
$m_{(CO_2)}=0,077\ Kg$
La masse m CO2 de dioxyde de carbone formée est $m_{(CO_2)}=0,077\ Kg$.
6- Un véhicule hybride*, utilisé en trajet mixte, réduit de 25 % la consommation de carburant par rapport à son équivalent thermique (d’après auto-ies, 6 juin 2024). D’après vos connaissances et les résultats précédents, cette baisse de consommation permet-elle de réduire de 25 % le rejet de dioxyde de carbone ?
*véhicule hybride : véhicule qui combine 2 types de motorisation, une motorisation thermique et une motorisation électrique.
La quantité de dioxyde de carbone produit est proportionnelle à la masse de carburant consommée.
Ainsi, la baisse de consommation de carburant de 25 % entraîne une réduction proportionnelle des émissions de dioxyde de carbone.
