E3C2 – 10 points – Durée 1h – calculatrice autorisée
Le baume du tigre® est un onguent issu de la pharmacopée chinoise dont la commercialisation remonte à la fin du XIXème siècle. En particulier, le baume du tigre rouge® est très utilisé pour soulager les douleurs musculo-squelettiques ; il est donc particulièrement apprécié des sportifs.

Le camphre constitue le principal composant du baume du tigre®. Historiquement, le camphre était d’origine naturelle : le plus anciennement connu semble avoir été le camphre de Bornéo, fourni par un grand arbre de l’île de Sumatra en Indonésie. Actuellement, la majorité du camphre produit en France est obtenue par une synthèse multi-étapes à partir de l’a-pinène extrait de la résine de pin. Cette synthèse est présentée ci-dessous.
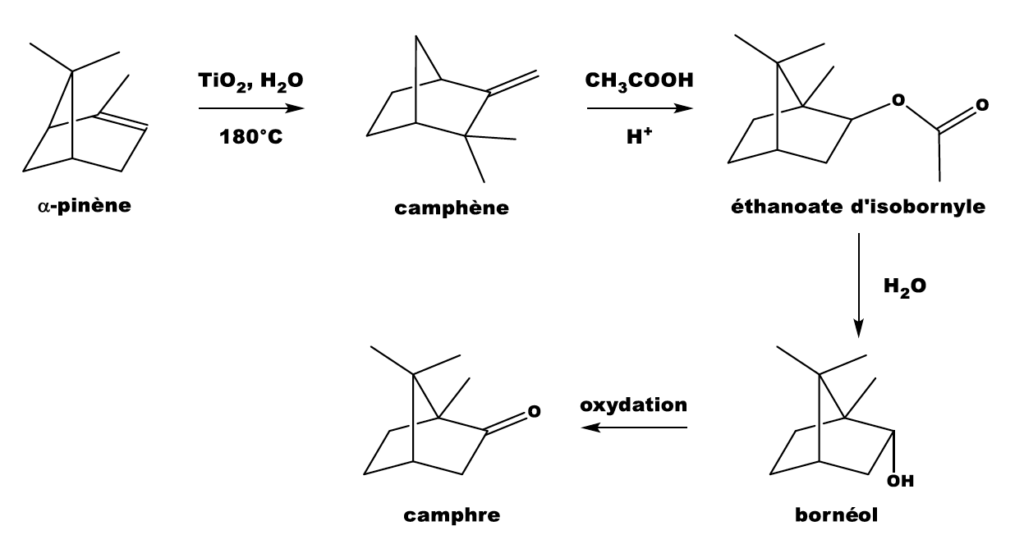
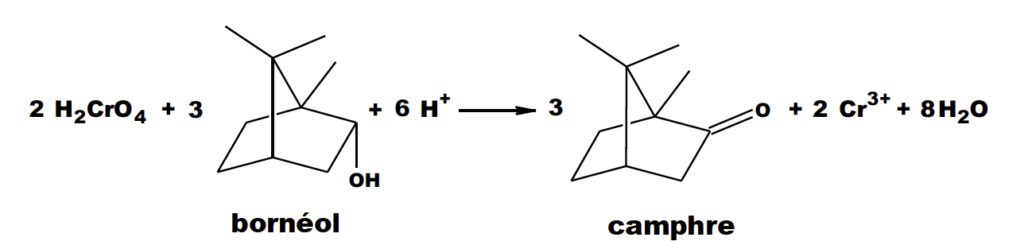
Cet exercice s’intéresse à la dernière étape qui permet de produire le camphre par oxydation du bornéol avec comme oxydant l’acide chromique (réactif de Jones) ;
La transformation chimique peut être modélisée par la réaction chimique d’équation :
Le protocole de cette étape ainsi que les données spécifiques à ce dernier, sont fournis ci-après.
Protocole de synthèse du camphre à partir du bornéol
Étape 1 Dans un ballon bicol de 250 mL, placé dans un bain de glace, muni d’une agitation magnétique, d’un réfrigérant à eau et d’une ampoule de coulée, dissoudre 5,0 g de bornéol commercial dans 15 mL de propanone. Ajouter goutte à goutte 11,0 mL de solution d’acide chromique de concentration C = 2,0 mol·L-1. Enlever le bain de glace et attendre que la température du mélange atteigne la température ambiante.
Étape 2 Introduire le mélange dans une ampoule à décanter de 250 mL contenant 120 mL d’eau et ajouter 25 mL d’éther diéthylique. Agiter, décanter et séparer la phase organique. Traiter deux fois la phase aqueuse avec chaque fois 25 mL d’éther diéthylique.
Étape 3 Regrouper et laver les phases organiques avec successivement 25 mL d’une solution saturée de chlorure de sodium (Na+(aq) + Cl–(aq)), 25 mL d’une solution saturée d’hydrogénocarbonate de sodium (Na+(aq) + HCO3−(aq)) et 25 mL d’une solution saturée de chlorure de sodium. Recueillir la phase organique dans un erlenmeyer. Sécher sur sulfate de magnésium anhydre. Éliminer le solvant grâce à un montage de distillation simple. Verser le résidu du ballon dans bécher taré, refroidir et recueillir les cristaux obtenus, les sécher.
Étape 4 Déterminer la masse puis réaliser le spectre infrarouge du solide obtenu.
Données
Données physico-chimiques relatives aux espèces chimiques mises en jeu dans ce protocole
| Nom | Données physico-chimiques et pictogrammes |
|---|---|
| Acide chromique H2CrO4 | Solution aqueuse d’acide chromique  |
| Propanone C3H6O | - Température d’ébullition : 56 °C sous 1,013 hPa - Densité : d = 0,79 - Solvant organique miscible à l’eau et à l’éther diéthylique  |
| Éther diéthylique C4H10O | - Température d’ébullition : 34 °C sous 1,013 hPa - Densité : d = 0,71 - Solvant organique très peu miscible à l’eau  |
| Bornéol C10H18O | - Masse molaire M = 154,2 g·mol-1 - Température de fusion : 208 °C - Solubilité : presque insoluble dans l'eau ; très soluble dans l'éthanol ; soluble dans l'éther de pétrole, dans la propanone et l'éther diéthylique |
| Camphre C10H16O | - Masse molaire M = 152,2 g·mol-1 - Température de fusion : 175 - 177 °C - Solubilité : peu soluble dans l’eau ; très soluble dans l’éthanol ; soluble dans l’éther diéthylique |
Données de spectroscopie infrarouge :
| Liaison | Nombre d’onde (cm-1) | Bande d’absorption |
| O-H libre | 3580 – 3650 | Bande forte et fine |
| O-H liée (pont hydrogène) | 3100 – 3500 | Bande forte et large |
| O-H (acide carboxylique) | 2500 – 3300 | Bande forte et large |
| Ctri-H (Ctri : carbone trivalent) | 3000 – 3100 | Bande moyenne |
| Ctet-H (Ctet : carbone tétravalent) | 2800 – 3000 | Bande forte |
| C-H de CHO (aldéhyde) | 2650 – 2800 | Bande moyenne |
| C=O (aldéhyde, cétone) | 1650 – 1730 | Bande forte |
| C=O (acide carboxylique) | 1690 – 1760 | Bande forte |
| C=C | 1625 – 1685 | Bande moyenne |
| Ctet-H | 1415 – 1470 | Bande forte |
| C-O | 1050 – 1450 | Bande forte |
1. Indiquer, en justifiant, les précautions à prendre lors de cette étape de la synthèse.
2. Caractériser chacune des étapes du protocole en utilisant les termes suivants : analyse du produit synthétisé ; transformation des réactifs ; isolement du produit synthétisé.
3. Justifier l’utilisation de l’éther diéthylique dans l’étape 2 du protocole.
Le schéma du montage de distillation simple est donné ci-dessous.
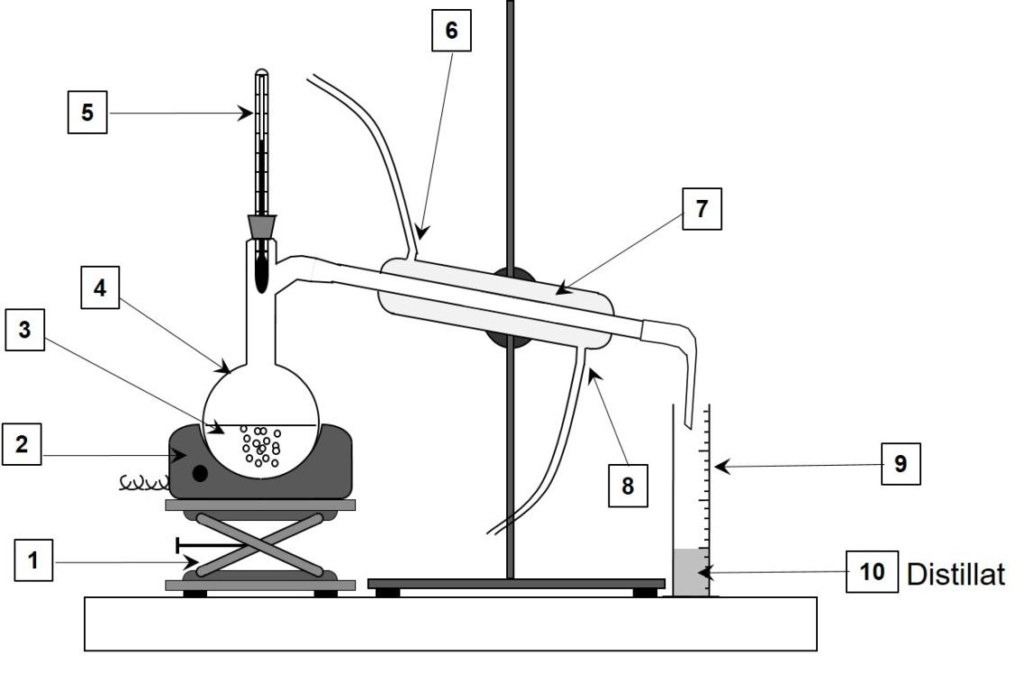
4. Sans reproduire le schéma, indiquer sur votre copie chaque nombre de la légende ainsi que le terme associé. Préciser quelle(s) espèce(s) chimique(s) est(sont) présente(s) dans le distillat (10).
5. À l’aide des couples d’oxydo-réduction : H2CrO4 / Cr3+ et camphre / bornéol, retrouver l’équation de la réaction de synthèse et justifier que le bornéol subit bien une oxydation.
6. Montrer que l’acide chromique et le bornéol ont été introduits dans les propositions stœchiométriques.
7. Montrer que la masse maximale de camphre que l’on peut former à l’issue de la synthèse vaut mthéorique = 5,0 g.
Une synthèse réalisée au laboratoire en suivant ce protocole a permis d’obtenir 2,2 g de solide.
8. En supposant que le solide obtenu est du camphre pur, déterminer le rendement de cette synthèse.
Lors de la synthèse au laboratoire, le technicien a réalisé une chromatographie sur couche mince. Il a noté sur son cahier de laboratoire : Rf(camphre) = 0,52 attendu dans les conditions de la CCM et il a reproduit ci-contre le chromatogramme obtenu après élution et révélation.

- Prélèvement au début de la transformation
- Prélèvement en cours de transformation
- Prélèvement en fin de transformation
9. Analyser l’allure du chromatogramme obtenu et indiquer les informations qu’il fournit sur la synthèse.
Le spectre IR du bornéol commercial est fourni ci-dessous. Il représente la transmittance (en %) en fonction du nombre d’onde (wavenumbers en anglais) exprimé en cm-1.
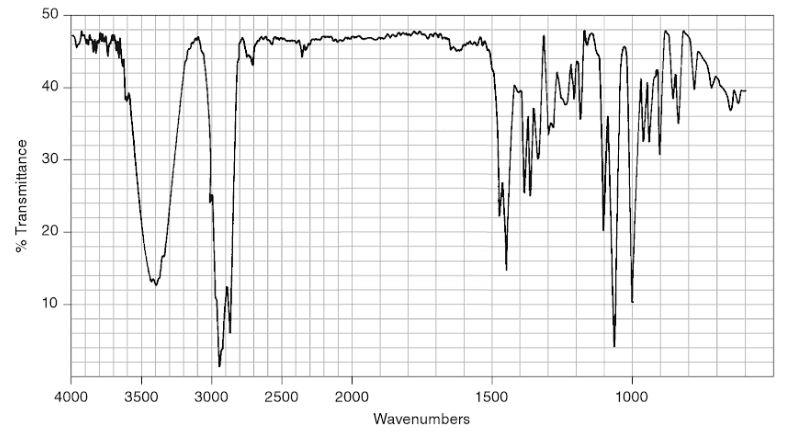
Donald L. Pavia, George S. Kriz, Gary M. Lampman, Randall G. Engel. A Small Scale Approach to Organic Laboratory Techniques, p. 256.
10. Donner les principales modifications attendues sur le spectre IR du solide obtenu par rapport celui du bornéol si le solide est du camphre pur.
