E3C2 – 10 points – Durée 1h – calculatrice autorisée
Des élèves d’une classe de première réalisent la synthèse d’un savon.
Cet exercice a pour objectif d’étudier quelques caractéristiques des espèces chimiques mises en jeu lors de cette synthèse d’une part et d’analyser les différentes étapes du protocole d’autre part. Il s’intéresse enfin aux propriétés lavantes du savon.
Protocole de la synthèse d’un savon : l’oléate de sodium
Étape 1 : verser dans un ballon :
- 13,6 g d’huile d’olive (on considère que l’huile d’olive est de l’oléine pure) ;
- 20 mL d’éthanol ;
- 20,0 mL de soude à 10 mol∙L-1 (en excès) ;
- quelques grains de pierre ponce.
Étape 2 : chauffer à reflux le mélange réactionnel pendant 20 minutes environ.
Étape 3 : laisser refroidir le mélange quelques minutes puis le verser dans un bécher contenant 200 mL d’une solution aqueuse concentrée de chlorure de sodium.
Étape 4 : le précipité obtenu, l’oléate de sodium, est le savon. Il est filtré, rincé à l’eau salée, séché, puis pesé.
Équation de la réaction modélisant la synthèse de l’oléate de sodium
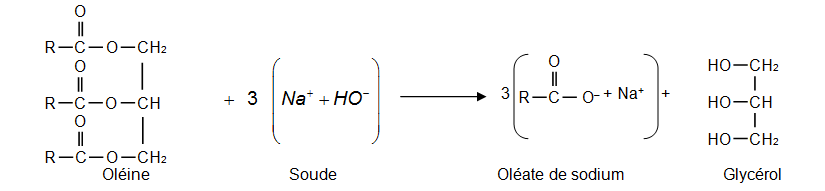
Dans les représentations semi-développées ci-dessus, les chaînes carbonées sont représentées par le symbole « R » ; R est un groupe qui contient 17 atomes de carbone reliés entre eux.
Données :
- numéro atomique Z de quelques éléments : H : 1 ; O : 8 ; Na : 11 ;
- électronégativité χ de quelques éléments selon l’échelle de Pauling : H : 2,2 ; O : 3,5 ; Na : 0,9 ;
- masses molaires en g∙mol–1 : M(oléine) = 884 ; M(hydroxyde de sodium) = 40 ;
M(oléate de sodium) = 304 ;
- L’huile est peu soluble dans les solvants polaires alors que les espèces ioniques y sont généralement très solubles :
| Oléine | Hydroxyde de sodium (soude) | Oléate de sodium (Savon) | |
| Solubilité dans l’eau | insoluble | soluble | soluble |
| Solubilité dans l’éthanol | soluble | soluble | soluble |
| Solubilité dans l’eau salée | insoluble | soluble | peu soluble |
1. Espèces chimiques mises en jeu dans la synthèse du savon
1.1. L’eau
1.1.1. Établir le schéma de Lewis de la molécule d’eau en déterminant au préalable le nombre total d’électrons de valence.
1.1.2. Interpréter la géométrie coudée de cette molécule.
1.1.3. En déduire le caractère polaire ou apolaire de la molécule d’eau en justifiant votre réponse.
1.1.4. Justifier que l’huile ne soit pas soluble dans l’eau.
1.2. La soude
La soude est une solution aqueuse d’hydroxyde de sodium. Elle est obtenue dans le cas de cette synthèse par dissolution dans l’eau d’un échantillon d’hydroxyde de sodium NaOH solide de masse m = 400 g pour obtenir un volume V = 1,0 L de solution.
1.2.1. Exprimer, puis calculer la concentration en quantité de matière en soluté apporté de la solution de soude.
1.2.2. Écrire l’équation de la réaction qui modélise la dissolution de l’hydroxyde de sodium solide NaOH(s) dans l’eau.
1.2.3. Exprimer puis calculer les concentrations en quantités de matière effectives des ions présents dans la solution de soude.
2. Analyse du protocole de synthèse du savon
2.1. Étude qualitative à partir des données fournies
2.1.1. Préciser le rôle de l’éthanol dans l’étape 1 en justifiant votre réponse.
2.1.2. Après le chauffage, on réalise les deux étapes suivantes décrites sur la figure 3 ci-dessous :
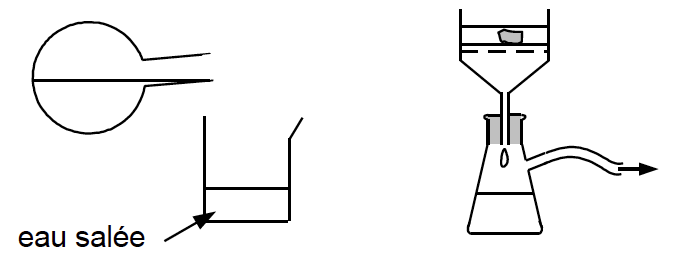
Justifier l’utilisation d’eau salée dans l’étape 3 et indiquer le nom du dispositif utilisé à l’étape 4 et son intérêt.
2.2. Étude quantitative
On cherche à déterminer le rendement de la synthèse du savon. La masse du savon obtenu est égale à mexp = 10,5 g.
2.2.1. Vérifier que la soude est le réactif introduit en excès.
2.2.2. Déterminer le rendement de cette synthèse. Commenter.
3. Propriétés lavantes d’un savon
On s’intéresse désormais aux propriétés lavantes d’un savon.
On peut représenter schématiquement l’ion oléate, l’ion actif du savon de la façon suivante :

Figure 4. Représentations schématiques de l’ion oléate
3.1 Caractériser les parties 1 et 2 des schémas de l’ion de la figure 4 à l’aide du vocabulaire suivant : hydrophile, hydrophobe, lipophile, lipophobe.
3.2 En déduire, parmi les schémas 5.a et 5.b de la figure 5, celui qui peut expliquer le mode d’action d’un savon. Décrire en un schéma et/ou une ou deux phrases l’étape suivante menant à l’élimination de la tache de graisse lors du lavage par du savon.
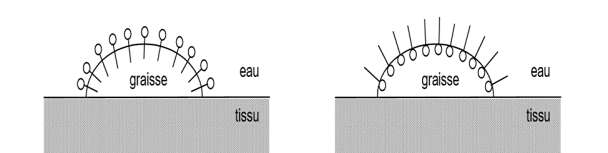
Schéma 5.a. —————————————————- Schéma 5.b.
Figure 5
