E3C2 – 10 points – Durée 1h – calculatrice autorisée
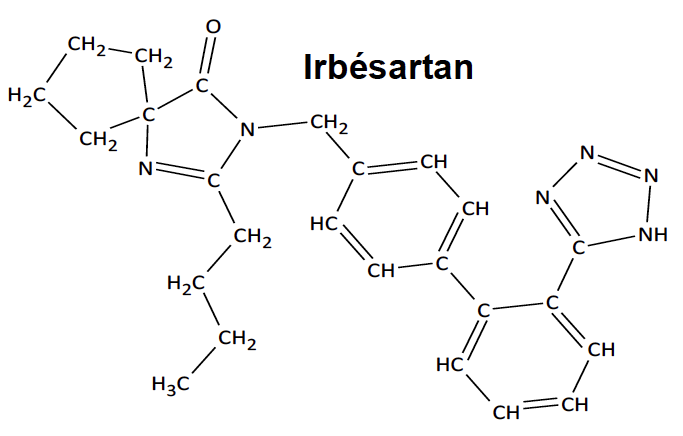
L’irbésartan, dont la formule est représentée ci-contre, est un composé organique utilisé dans le traitement de l’hypertension artérielle.
Cette espèce présente des points communs avec une hormone produite naturellement par l’organisme responsable d’une élévation de la pression artérielle. L’irbésartan vient se fixer sur les récepteurs spécifiques de cette hormone, les empêchant alors de la reconnaître et évitant ainsi une élévation trop importante de la pression artérielle.
d’après Thèse : Conception et synthèse de métalloprotéases et de cibles à ligand acide, Cousaert N., 2008 https://tel.archives-ouvertes.fr/tel-00356629/document
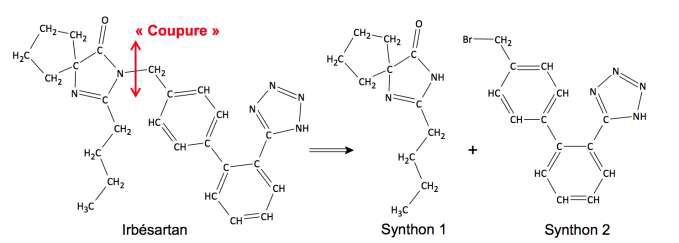
Pour synthétiser une molécule complexe les chimistes la « coupe » fictivement en plusieurs fragments appelés « synthons ». Le choix des synthons se fait de telle sorte qu’ils soient fabriqués en un minimum d’étapes avec de bons rendements. Ces synthons réagiront ensuite entre eux pour conduire à la molécule souhaitée.
Dans le cas de la synthèse de l’irbésartan, une équipe de chimiste a envisagé la fabrication des deux synthons ci-dessous (synthons 1 et 2) :
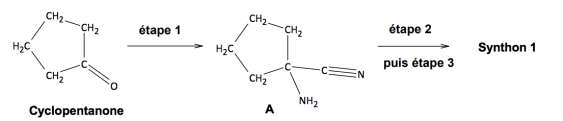
La synthèse du synthon 1 se fait en trois étapes à partir de la molécule de cyclopentanone. Ce sujet porte sur l’étape 1 de cette synthèse multi-étapes, celle permettant d’obtenir le composé A.
Protocole expérimental de l’étape 1 :
➀ Dans un ballon de 250 mL, introduire 5,2 g (80 mmol) de cyanure de potassium solide, 8 mL d’eau et un barreau aimanté. Mettre le tout au-dessus d’un agitateur magnétique et agiter jusqu’à dissolution complète.
➁ Introduire successivement 20 mL d’une solution aqueuse d’ammoniac de concentration en quantité de matière d’ammoniac 10,8 mol.L-1, puis 6,3 mL de cyclopentanone dissous dans 8 mL de méthanol.
③ Surmonter le ballon d’un réfrigérant, agiter et chauffer le mélange durant 45 minutes à 60 °C.
④ Laisser refroidir tout en continuant à agiter durant 45 minutes.
⑤ Verser le mélange dans une ampoule à décanter et ajouter 50 mL de dichlorométhane. Séparer les phases.
⑥ Extraire la phase aqueuse avec trois fois 25 mL de dichlorométhane.
⑦ Rassembler les phases organiques et les sécher avec du sulfate de magnésium anhydre MgSO4 (s). Filtrer et récupérer la phase organique.
⑧ Le solvant organique est évaporé et on obtient alors 7,1 g d’une huile incolore : le composé A.
Données:
Quelques informations relatives aux espèces chimiques de l’étape 1 du protocole expérimental
| Espèce chimique, Formule brute Masse molaire | État physique Température d’ébullition Densité par rapport à l’eau à 20°C (à la pression atmosphérique) |
| Cyclopentanone C5H8O Mcyclo = 84,1 g.mol-1 | Liquide incolore Téb=130,5°C ρcyclo = 950 g.L – 1 |
| Solution aqueuse d’ammoniac à 10,8 mol.L– 1 NH3(aq) MNH3(aq)= 17,0 g.mol– 1 | Liquide incolore Téb=50 °C ρNH3(aq) = 910 g.L – 1 |
| Cyanure de potassium KCN (s) MKCN (s)= 17,0 g.mol– 1 | Solide blanc Non renseigné Non renseigné |
| A C6H10N2 MA= 110,2 g.mol– 1 | Huile incolore Non renseigné Non renseigné |
Masse volumique de l’eau à 20°C : ρeau = 1000 g.L – 1
Masse volumique du dichlorométhane : ρdichlo = 1330 g.L – 1
Tableau des miscibilités entre différentes espèces chimiques
| Eau | Dichlorométhane | Molécule A | |
| Eau | Non miscible | Bonne | |
| Dichlorométhane | Non miscible | Très bonne | |
| Molécule A | Bonne | Très bonne |
Valeurs des électronégativités de certains atomes (selon Pauling)
| Atomes | H | C | O | N |
| Électronégativité | 2,1 | 2,5 | 3,5 | 3,0 |
1. À propos des réactifs et produits
1.1. Définir un composé organique.
1.2. Recopier la molécule de cyclopentanone et la molécule A sur la copie et y ajouter tous les doublets non liants de la molécule. Justifier la démarche.
1.3. Entourer le groupe caractéristique présent sur la molécule de cyclopentanone et préciser le nom de la famille de composés associée.
2. Analyse du protocole
Deux solvants sont mélangés lors de cette synthèse, l’eau et le méthanol, dont le mélange est homogène.
2.1. Représenter le schéma de Lewis de la molécule d’eau, puis celui de la molécule de méthanol de formule brute CH4O.
2.2. Donner le nom de l’interaction prépondérante entre l’eau et le méthanol qui permet d’expliquer la présence d’une seule phase dans le milieu réactionnel. Justifier à l’aide d’un schéma.
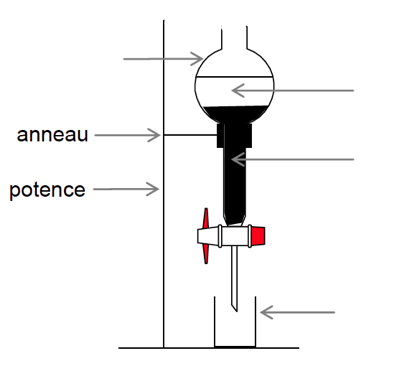
2.3. Citer le nom du montage utilisé lors du chauffage. Donner son intérêt.
2.4. Donner le nom de l’opération effectuée lors des étapes ⑤ et ⑥ du protocole de synthèse.
2.5. Sur l’annexe à rendre avec la copie compléter le schéma correspondant à la fin de l’opération ⑤. Préciser la nature des phases sur le schéma en justifiant la réponse sur la copie et indiquer dans quelle phase se trouve le composé A.
2.6. Donner le nom de l’opération ⑦ et préciser le rôle du sulfate de magnésium anhydre ajouté à la phase organique lors de cette étape.
3. Rendement de la synthèse
L’équation de la réaction modélisant la transformation associée à l’étape 1 est la suivante :
![]()
![]() +
+ ![]()
![]()
![]()
![]()
3.1. Calculer les quantités de matière d’ammoniac et de cyclopentanone introduites initialement dans le milieu réactionnel.
3.2. En déduire la valeur de l’avancement maximal de la réaction xmax.
3.3. Définir le rendement de la synthèse et le calculer en admettant que l’huile incolore obtenue correspond au composé A pur.
Annexe à rendre avec la copie
Question 2.5.