Bac Amérique du nord 2025 Sujet 1
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n°25-PYCJ1AN1
Sujet et corrigé
EXERCICE 1 : ÉTUDE D’UN VERNIS À ONGLES (9 POINTS)
Les vernis à ongles vont le plus souvent servir à embellir l’ongle en lui conférant plus de brillance et en le colorant. La formulation d’un vernis est pensée en amont pour en faciliter l’usage pour le consommateur, en permettant une application facile, avec un séchage rapide par polymérisation ou évaporation.
Pour cela, les fabricants utilisent plusieurs types de substances :
- un agent filmogène, le plus souvent de la nitrocellulose, inflammable ;
- des résines qui donnent le brillant et l’adhérence ;
- des plastifiants pour rendre la matière flexible ;
- pour la couleur, des pigments minéraux ou organiques et des nacres naturelles ou synthétiques ;
- des solvants pour solubiliser les composants et diminuer le temps de séchage par évaporation du vernis.
Serrero, Chloé. Vernis cosmétiques : substances dangereuses pour la santé et formulations alternatives.
Thèse de doctorat en pharmacie, Université de Bordeaux, 2023.
L’objectif de cet exercice est d’étudier la synthèse de l’éthanoate d’éthyle, couramment utilisé comme solvant dans la formulation des vernis, puis de déterminer le pourcentage massique d’un pigment dans un vernis.
1. Étude d’une synthèse au laboratoire d’un solvant pour vernis
Dans les vernis classiques, l’éthanoate de butyle et l’éthanoate d’éthyle sont majoritairement utilisés comme solvant.
La formule topologique de l’éthanoate d’éthyle est représentée ci-dessous :

Figure 1. Formule de l’éthanoate d’éthyle
Q.1. Représenter la formule semi-développée de l’éthanoate d’éthyle. Entourer le groupe caractéristique présent dans cette molécule et nommer la famille fonctionnelle associée.
Famille fonctionnelle : Ester

L’éthanoate d’éthyle est formé à partir de l’acide éthanoïque et de l’éthanol, selon la transformation chimique modélisée par la réaction dont l’équation est donnée ci-dessous :

Le mécanisme réactionnel de la synthèse de l’acétate d’éthyle est modélisé par plusieurs actes élémentaires, dont le premier est représenté sur la figure 2.

Figure 2. Première étape du mécanisme réactionnel
Q.2 Justifier le sens de la flèche courbe de la figure 2.
Il s’agit d’une formation entre l’atome d’oxygène vers l’ion hydrogène : la flèche va du site donneur au site accepteur.
L’atome d’oxygène avec ses doublets non liants est le site donneur et l’ion hydrogène avec sa charge positive est le site receveur.
Ainsi, la flèche vas de l’atome d’oxygène vers l’ion hydrogène.
L’éthanoate d’éthyle peut être synthétisé dans un laboratoire au lycée en suivant les étapes du protocole expérimental décrit ci-dessous :
Étape 1 – Introduire dans un ballon un volume d’éthanol V1 = 11,7 mL. Sous la hotte, ajouter V2 = 14,3 mL d’acide éthanoïque et 5 gouttes d’acide sulfurique concentré. Mettre quelques grains de pierre ponce dans le ballon et chauffer à reflux pendant environ 15 minutes, en surveillant le chauffage.
Étape 2 – Laisser refroidir le mélange réactionnel à l’air ambiant puis dans un bain d’eau froide. Verser le contenu du ballon dans une ampoule à décanter puis ajouter environ 50 mL d’eau salée. Agiter prudemment en dégazant régulièrement. Laisser décanter, puis éliminer la phase aqueuse.
Étape 3 – Pour neutraliser le reste d’acide, ajouter à la phase organique 60 mL d’une solution aqueuse d’hydrogénocarbonate de sodium (Na+(aq) + HCO3–(aq)) de concentration en quantité de matière de 1 mol·L-1. Laisser dégazer et décanter puis éliminer la phase aqueuse. Recueillir la phase organique dans un bécher. Sécher cette phase avec du chlorure de calcium anhydre puis filtrer. Recueillir le filtrat dans un erlenmeyer propre et sec.
Données :
– Données physico-chimiques de quelques espèces impliquées dans le protocole expérimental :

| Acide éthanoïque CH3COOH | Éthanol C2H5OH | Éthanoate d’éthyle CH3COOC2H5 | Acide sulfurique H2SO4 | Eau salée utilisée | |
| Masse molaire (g·mol-1) | 60,0 | 46,1 | 88,1 | 98,0 | |
| Masse volumique (g·mL-1) à 20°C | 1,05 | 0,789 | 0,902 | 1,15 | |
| Température d’ébullition(°C) | 118 | 78,4 | 77,1 | ||
| Température de fusion (°C) | 16,6 | – 117 | – 83,6 | ||
| Solubilité dans l’eau | Très grande | Très grande | 87 g·L-1 à 20 °C | Très grande | |
| Solubilité dans l’eau salée | Très grande | Très grande | Presque nulle | Très grande |
– Couples acido-basiques: CO2,H2O(aq) / HCO3–(aq) , CH3COOH(aq) / CH3COO–(aq) .
Q.3. Définir un catalyseur et justifier le fait que l’acide sulfurique ajouté dans l’étape 1 peut jouer ce rôle.
Un catalyseur est une espèce qui augmente la vitesse d’une transformation, sans figurer dans l’équation de la réaction.
L’acide sulfurique n’apparait pas dans l’équation de la réaction, ce n’est ni un réactif ni un ion spectateur.
Ainsi, l’acide sulfurique ajouté dans l’étape 1 peut jouer ce rôle de catalyseur.
Q.4. Indiquer l’étape qui, parmi les trois étapes du protocole expérimental, correspond à une extraction.
L’étape qui, parmi les trois étapes du protocole expérimental, correspond à une extraction est l’étape 2.
Q.5. Schématiser l’ampoule à décanter après la décantation de l’étape 2, et indiquer les espèces chimiques présentes dans chacune des deux phases. Justifier.
Supposons la réaction limitée, il y a :
- L’éthanol (réactif non totalement consommé)
- L’acide éthanoïque (réactif non totalement consommé)
- L’acide sulfurique (catalyseur)
- L’éthanoate d’éthyle (produit)
- L’eau (produit)
On ajoute de l’eau salée (phase aqueuse). La solubilité de l’éthanol, de l’acide éthanoïque et de l’acide sulfurique est très grande dans l’eau salée. Ils y sont donc.
La solubilité de l’éthanoate d’éthyle presque nulle dans l’eau salée. Il n’y est pas et constitue la phase organique.
La densité de l’eau salée est de 1,15 alors que celle de l’éthanoate d’éthyle est de 0,902 : l’eau salée est en bas et l’éthanoate d’éthyle en haut.

Q.6. Écrire l’équation de la réaction modélisant la transformation acido-basique entre les ions hydrogénocarbonate HCO3–(aq) et l’acide éthanoïque qui se déroule dans l’étape 3 du protocole expérimental et nommer le gaz formé.
La réaction ayant lieu entre les ions $H_3O^+$ et les ions hydrogénocarbonate $HCO_3^-$ est :
$$HCO_3^-(aq)+{\rm CH}_3COOH(aq)\longrightarrow H_2{\rm CO}_3(aq)+{\rm CH}_3COO^-(aq)$$
$H_2CO_3(aq)$ se décompose en $H_2O(aq)+CO_2(g)$.
Le gaz formé est le dioxyde de carbone.
La synthèse réalisée a permis d’obtenir un volume de filtrat égal à Vester = 12,0 mL.
Q.7. Déterminer la valeur du rendement de cette synthèse, sachant que l’acide éthanoïque est en excès.
Le candidat est invité à prendre des initiatives et à présenter sa démarche, même si elle n’a pas abouti. La démarche suivie est évaluée et doit donc être correctement présentée.
Calculons la quantité de matière d’éthanol introduite dans le mélange :
$$n_{\text{éthanol}}=m_{\text{éthanol}} M_{\text{éthanol}}$$
Or
$$\rho_{\text{Éthanol}}=\frac{m_{\text{Éthanol}}}{V_{\text{Éthanol}}}$$
$$m_{\text{Éthanol}} V_{\text{Éthanol}}=\rho_{\text{Éthanol}}$$
$$m_{\text{Éthanol}}=\rho_{\text{Éthanol}}\times V_{\text{Éthanol}}$$
$$n_{\text{Éthanol}}=\frac{\rho_{\text{Éthanol}}\times V_{\text{Éthanol}}}{M_{\text{Éthanol}}}$$
$$n_{\text{Éthanol}}=\frac{0,789\times 11,7}{46,1}$$
$$n_{\text{Éthanol}}=2,0\times 10^{-1}\ \text{mol}$$
Calculons la quantité de matière d’acide éthanoïque introduite dans le mélange :
$$n_{\text{acide éthanoïque}}=\frac{m_{\text{acide éthanoïque}}}{M_{\text{acide éthanoïque}}}$$
Or
$$\rho_{\text{Acide éthanoïque}}=\frac{m_{\text{Acide éthanoïque}}}{V_{\text{Acide éthanoïque}}}$$
$$m_{\text{Acide éthanoïque}} V_{\text{Acide éthanoïque}}=\rho_{\text{Acide éthanoïque}}$$
$$m_{\text{Acide éthanoïque}}=\rho_{\text{Acide éthanoïque}}\times V_{\text{Acide éthanoïque}}$$
$$n_{\text{Acide éthanoïque}}=\frac{\rho_{\text{Acide éthanoïque}}\times V_{\text{Acide éthanoïque}}}{M_{\text{Acide éthanoïque}}}$$
$$n_{\text{Acide éthanoïque}}=\frac{1,05\times 14,3}{60,0}$$
$$n_{\text{Acide éthanoïque}}=2,5\times 10^{-1}\ \text{mol}$$
$$x_{\max 1}=n_{\text{Éthanol}}=2,0\times 10^{-1}\ \text{mol}$$
$$x_{\max 2}=n_{\text{Acide éthanoïque}}=2,5\times 10^{-1}\ \text{mol}$$
L’éthanol est le réactif limitant.
$$x_{\max}=x_{\max 1}=2,0\times 10^{-1}\ \text{mol}$$
Le rendement est défini par :
$$\eta=\frac{n_{\text{éthanoate d’éthyle ,exp}}}{n_{\text{éthanoate d’éthyle ,max}}}$$
$$n_{\text{Éthanoate d’éthyle ,exp}}=\frac{m_{\text{Éthanoate d’éthyle ,exp}}}{M_{\text{Éthanoate d’éthyle}}}$$
Or
$$\rho_{\text{Éthanoate d’éthyle}}=\frac{m_{\text{Éthanoate d’éthyle ,exp}}}{V_{\text{Éthanoate d’éthyle ,exp}}}$$
$$m_{\text{Éthanoate d’éthyle ,exp}}=\rho_{\text{Éthanoate d’éthyle}}\times V_{\text{Éthanoate d’éthyle ,exp}}$$
$$n_{\text{Éthanoate d’éthyle ,exp}}=\frac{\rho_{\text{Éthanoate d’éthyle}}\times V_{\text{Éthanoate d’éthyle ,exp}}}{M_{\text{Éthanoate d’éthyle}}}$$
$$n_{\text{Éthanoate d’éthyle ,exp}}=\frac{0,902\times 12,0}{88,1}$$
$$n_{\text{Éthanoate d’éthyle ,exp}}=1,2\times 10^{-1}\ \text{mol}$$
Et
$$n_{\text{Éthanoate d’éthyle ,max}}=x_{\max}=2,0\times 10^{-1}\ \text{mol}$$
$$\eta=\frac{1,2\times 10^{-1}}{2,0\times 10^{-1}}$$
$$\eta=0,60$$
$$\eta=60\ %$$
Q.8. Choisir la ou les bonne(s) proposition(s) permettant d’augmenter le rendement de cette synthèse. Justifier.
Proposition A : ajouter de l’éthanol en excès aux 14,3 mL d’acide éthanoïque.
Proposition B : doubler le volume d’acide sulfurique.
Proposition C : éliminer l’eau produite au cours de la réaction.
Les bonne(s) proposition(s) permettant d’augmenter le rendement de cette synthèse sont :
Proposition A : ajouter de l’éthanol en excès aux 14,3 mL d’acide éthanoïque car on augmente xmax.
Proposition C : éliminer l’eau produite au cours de la réaction car le quotient de réaction sera toujours inferieur a la constante de réaction.
2. Détermination du pourcentage massique du pigment dans un vernis
Parmi les pigments couramment utilisés pour colorer les vernis à ongles, on trouve l’oxyde de fer (III), de formule Fe2O3. Ce composé minéral de couleur rouge doit être présent avec un pourcentage massique de 5 % pour avoir un pouvoir couvrant optimal.
L’étude quantitative permettant de déterminer le pourcentage massique d’oxyde de fer (III) dans un vernis à ongles est réalisée à l’aide d’un dosage spectrophotométrique. Dans les conditions de l’expérience, on transforme les ions Fe3+(aq) en ions Fe2+(aq) que l’on dose.
Le dosage se déroule en trois étapes :
Étape 1 : préparation de la gamme d’étalonnage ;
Étape 2 : réalisation de la courbe d’étalonnage à l’aide de mesures spectrophotométriques ;
Étape 3 : préparation de l’échantillon et mesure de son absorbance.
Étape 1 : préparation de la gamme d’étalonnage des solutions en ions Fe2+(aq).
La gamme d’étalonnage est réalisée à partir d’une solution mère S0, de concentration en quantité de matière en ions Fe2+(aq) : C0 = 3,58 x 10-4 mol·L-1.
Pour obtenir une gamme d’étalonnage colorée, une solution d’orthophénantroline a été ajoutée aux solutions d’ions Fe2+(aq).
Pour préparer chaque solution étalon Si, un volume Vi est prélevé de la solution mère S0 auquel sont ajoutés une solution d’orthophénantroline et de l’eau distillée jusqu’à atteindre un volume total de 50,0 mL.
| Solution étalon Si | S1 | S2 | S3 | S4 | S5 | S6 |
| Vi en mL de solution S0 | 2,0 | 4,0 | 6,0 | 8,0 | 10,0 | 12,0 |
Q.9. Indiquer la verrerie nécessaire à la préparation de la solution étalon S5 à partir de la solution mère S0, puis calculer la valeur de sa concentration en quantité de matière C5.
Le volume Vi est prélevé. Pour la solution S5, on prélève 10,0 mL avec une pipette jaugée.
Le volume total de 50,0 mL est celui de la fiole jaugée de 50,0 mL.
Lors d’une dilution, la quantité de matière se conserve :
$$n_5=n_0$$
$$C_5V_5=C_0V_0$$
$$C_5=\frac{C_0V_0}{V_5}$$
$$C_5=\frac{3,58\times 10^{-4}\times 10,0\times 10^{-3}}{50,0\times 10^{-3}}$$
$$C_5=7,16\times 10^{-5}\ \text{mol.L}^{-1}$$
Étape 2 : réalisation de la courbe d’étalonnage.
Données :
- Spectre d’absorption d’une solution d’ions Fe2+(aq) en présence d’orthophénantroline :

Source : d’après Vakh, C., et al. (2015). Simultaneous determination of iron (II) and ascorbic acid in pharmaceuticals. Journal of Pharmacological and Toxicological Methods, 73(1), 56–62.
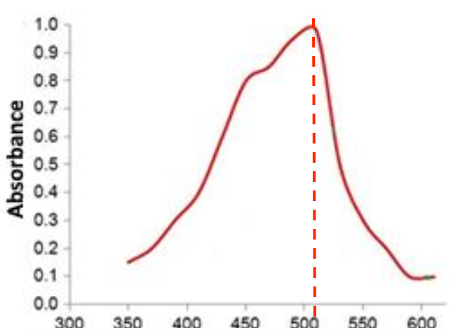
Q.10. Indiquer, en justifiant la réponse, la valeur de la longueur d’onde à laquelle il faut régler le spectrophotomètre pour réaliser les mesures d’absorbance.
La valeur de la longueur d’onde à laquelle il faut régler le spectrophotomètre pour réaliser les mesures d’absorbance est la valeur pour laquelle l’absorbance est maximale soit
$$\lambda_{max}=510\ \text{nm}$$
On mesure l’absorbance des solutions Si à l’aide d’un spectrophotomètre réglé sur la longueur d’onde choisie précédemment. La courbe d’étalonnage de la figure 3 représente l’absorbance des solutions étalons en fonction de la concentration en quantité de matière des ions Fe2+(aq).
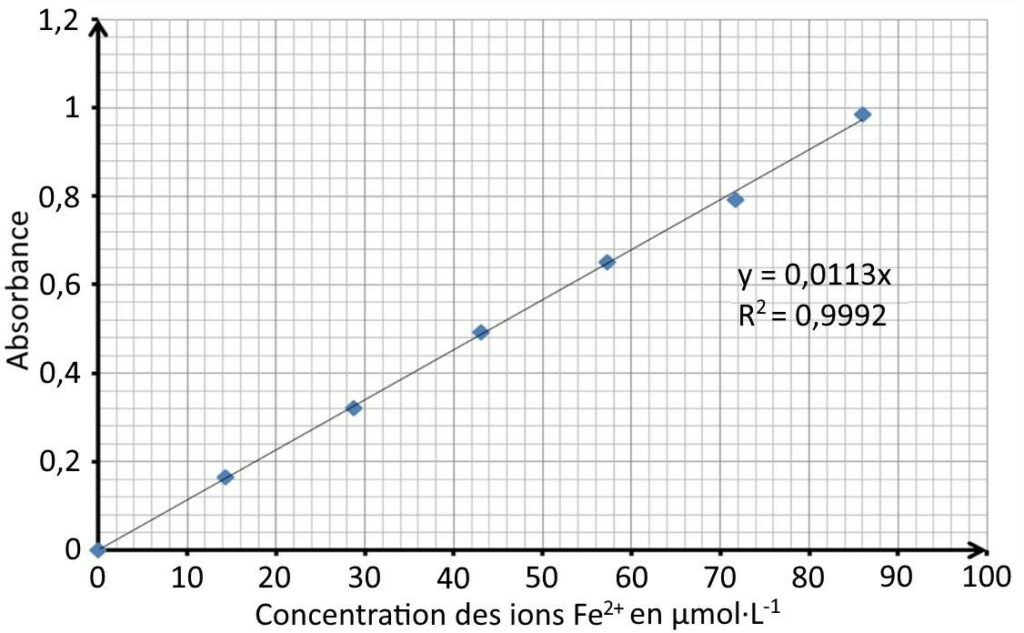
Figure 3. Courbe d’étalonnage
Q.11. Justifier que la courbe d’étalonnage de la figure 3 vérifie la loi de Beer-Lambert.
A en fonction de c est une droite passant par l’origine :
A et c sont proportionnel : A=kc.
La loi de Beer-Lambert est vérifiée.
Étape 3 : préparation de l’échantillon de vernis et mesure de son absorbance.
Données :
- Masse molaire : M(Fe2O3) = 159,7 g·mol-1
Un échantillon de vernis de masse m = 0,0103 g est introduit dans une fiole jaugée de 50,0 mL. Il subit les étapes suivantes :
- Quelques millilitres d’acide chlorhydrique en excès sont ajoutés. La transformation chimique entre l’acide chlorhydrique et l’oxyde de fer Fe2O3 est modélisée par la réaction représentée par l’équation suivante :
Fe2O3(s) + 6 H3O+(aq) ➝ 2 Fe3+(aq) + 9 H2O(l)
- Une solution d’ions hydroxylammonium est ajoutée. Les ions hydroxylammonium réduisent ensuite une mole d’ions Fe3+(aq) en une mole d’ions Fe2+(aq).
- Quelques gouttes d’orthophénantroline sont ajoutés. L’orthophénantroline réagit avec les ions Fe2+(aq), permettant d’obtenir une solution colorée comparable à celles de la gamme d’étalonnage.
Le tout est complété avec de l’eau distillée jusqu’au trait de jauge. On obtient la solution S. L’absorbance mesurée de la solution S est As = 0,360.
Q.12. À partir de l’absorbance mesurée de la solution S, de la courbe d’étalonnage et des données fournies, montrer que la valeur de la quantité de matière de Fe2O3 dans l’échantillon de vernis vaut 0,80 x 10-6 mol.
Pour As = 0,360, graphiquement la concentration en ions Fe2+ est :
$$[Fe^{2+}]=32\ \mu\text{mol.L}^{-1}$$
$$n_{Fe^{2+}}=[Fe^{2+}]\times V$$
$$n_{Fe^{2+}}=32\times 10^{-6}\times 50,0\times 10^{-3}$$
$$n_{Fe^{2+}}=1,6\times 10^{-6}\ \text{mol}$$
Les ions hydroxylammonium réduisent une mole d’ions Fe3+ en une mole d’ions Fe2+ :
$$n_{Fe^{3+}}=n_{Fe^{2+}}=1,6\times 10^{-6}\ \text{mol}$$
D’après l’équation :
$$Fe_2O_3(s)+6H_3O^+(aq)\rightarrow 2Fe^{3+}(aq)+9H_2O(l)$$
$$n_{Fe_2O_3}=\frac{n_{Fe^{2+}}}{2}$$
$$n_{Fe_2O_3}=\frac{1,6\times 10^{-6}}{2}$$
$$n_{Fe_2O_3}=0,8\times 10^{-6}\ \text{mol}$$
Q.13. En déduire si le vernis étudié possède un pouvoir couvrant optimal.
D’après les données : Fe2O3 doit être présent à 5 % massique.
Calculons le pourcentage massique :
$$P=\frac{m_{Fe_2O_3}}{m_{total}}$$
Or
$$n_{Fe_2O_3}=\frac{m_{Fe_2O_3}}{M_{Fe_2O_3}}$$
$$m_{Fe_2O_3}=n_{Fe_2O_3}\times M_{Fe_2O_3}$$
$$P=\frac{n_{Fe_2O_3}\times M_{Fe_2O_3}}{m_{total}}$$
$$P=\frac{0,8\times 10^{-6}\times 159,7}{0,0103}$$
$$P=0,012$$
$$P=1,2\ %$$
Le pourcentage massique est inférieur à 5% : le vernis étudié ne possède pas un pouvoir couvrant optimal.
