Métropole Septembre 2025 Sujet 1
Exercice 2 – (4 points) – Durée 0h42 – Calculatrice autorisée
Sujet n°25-PYCJ1ME3
Sujet et corrigé
Exercice 2 – Étude d’une lessive « multi-usages » (4 points)
Le carbonate de sodium, de formule Na2CO3, entre dans la composition de nombreuses lessives pour le nettoyage des sols et des murs. Il permet de « solubiliser » les corps gras, facilitant ainsi l’action des tensioactifs.

Les objectifs de cet exercice sont de :
- mener une étude des propriétés acido-basiques de l’ion carbonate ;
- vérifier que le pourcentage en masse de carbonate de sodium présent dans une lessive « multi-usages » est bien compris entre 30 et 60 %, comme annoncé par le fabriquant.
1. Étude des propriétés acido-basiques de l’ion carbonate Données :
- masse molaire de Na2CO3 : 106,0 g·mol–1 ;
- valeurs des pKA à 25 °C des couples acide-base associés à CO2(aq) :
- CO2(aq) / HCO3–(aq) : pKA1 = 6,4 ;
- HCO3–(aq) / CO32–(aq) : pKA2 = 10,3 ;
- diagramme de distribution en fonction du pH des différentes espèces acide-base des couples associés à CO2(aq) :
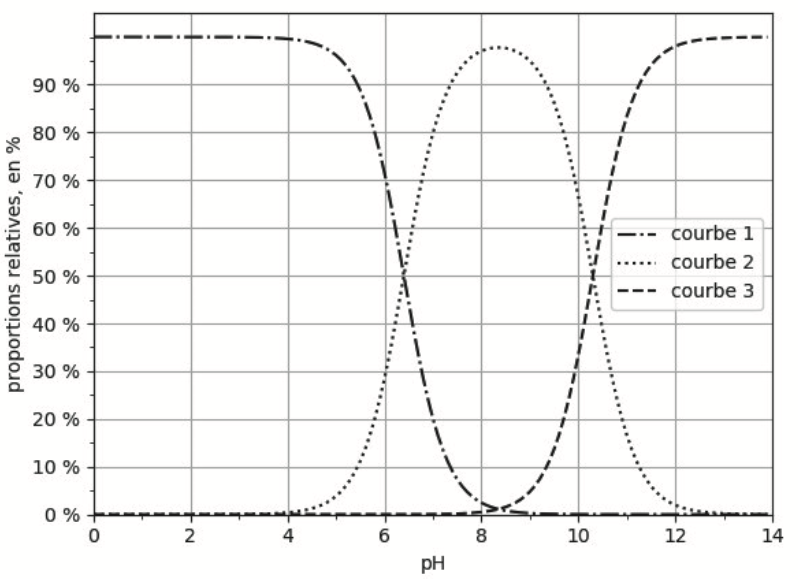
Figure 1. Diagramme de distribution des différentes espèces acide-base des couples associés à CO2(aq)
Q1. Représenter le diagramme de prédominance des espèces acide-base des couples associés à CO2(aq).
Remarque : le sujet nous donne le couple acide base ${\rm CO}_2(aq)/{\rm HCO}_3^-(aq)$. Or pour passer de la forme acide à la forme basique on enlève un ion $H^+$ ce qui n’est pas le cas ici.
Le bon couple est $H_2O,{\rm CO}_2(aq)/{\rm HCO}_3^-(aq)$.
Q2. Identifier, en justifiant, les espèces chimiques associées à chacune des courbes 1, 2 et 3 de la figure 1.
D’après le diagramme de prédominance (Q1) :
Pour un $pH<6,4$ l’espèce prédominante est $H_2O,{\rm CO}_2$ qui correspond à l’espèce associée à la courbe 1
Pour un $6,4 <pH<10,3$ l’espèce prédominante est ${\rm HCO}_3^-$ qui correspond à l’espèce associée à la courbe 2
Pour un $pH>10,3$ l’espèce prédominante est ${\rm CO}_3^{2-}$ qui correspond à l’espèce associée à la courbe 3
Q3. Expliquer, en justifiant, comment retrouver la valeur du pKA2 associée au couple HCO3–(aq) / CO32–(aq) à l’aide de la figure 1.
Lorsque $\left[{\rm HCO}3^-\ \right]{eq}=\left[{\rm CO}3^{2-}\ \right]{eq}$ (courbe 2 et courbe 3 se croisent, elles sont à 50%), $pH={\rm pK}{A2}$
Graphiquement $\left[{\rm HCO}3^-\ \right]{eq}=\left[{\rm CO}3^{2-}\ \right]{eq}$ pour $pH=10,3$
Ainsi, ${\rm pK}{A2}=10,3$

Q4. Écrire l’équation de réaction modélisant la transformation mettant en jeu l’ion carbonate CO32–(aq) et l’eau.
Justifier le caractère basique des ions carbonate dans l’eau.
$${\rm CO}_3^{2-}(aq)+H_2O\left(l\right)\rightleftarrows{\rm HCO}_3^-+HO^-(aq)$$
L’ion carbonate est capable de capter un ion $H^+$. Ainsi l’ion carbonate est une base.
2. Détermination du pourcentage en masse de carbonate de sodium présent dans une lessive
Afin de déterminer le pourcentage en masse de carbonate de sodium présent dans une lessive « multi- usages », on réalise le protocole expérimental suivant :
- peser une masse de 4,0 g de lessive et la dissoudre dans une fiole jaugée de 100,0 mL ;
- diluer d’un facteur 10 la solution de lessive obtenue ;
- prélever un volume de 50,0 mL de solution de lessive diluée puis réaliser son titrage par une solution d’acide chlorhydrique de concentration cA = 1,0×10–1 mol·L–1.
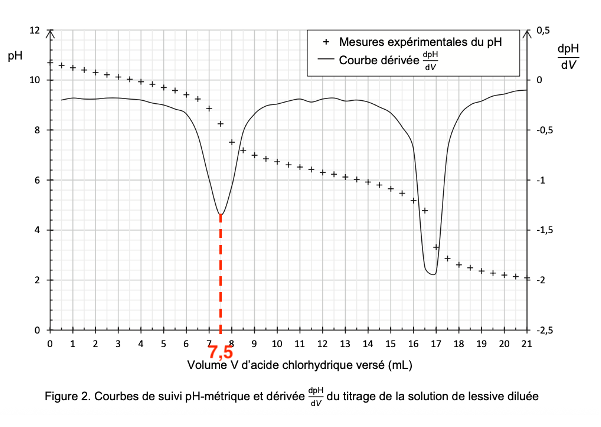
La courbe du suivi pH-métrique de ce titrage ainsi que celle de la dérivée sont données en figure 2 ci-dessous.
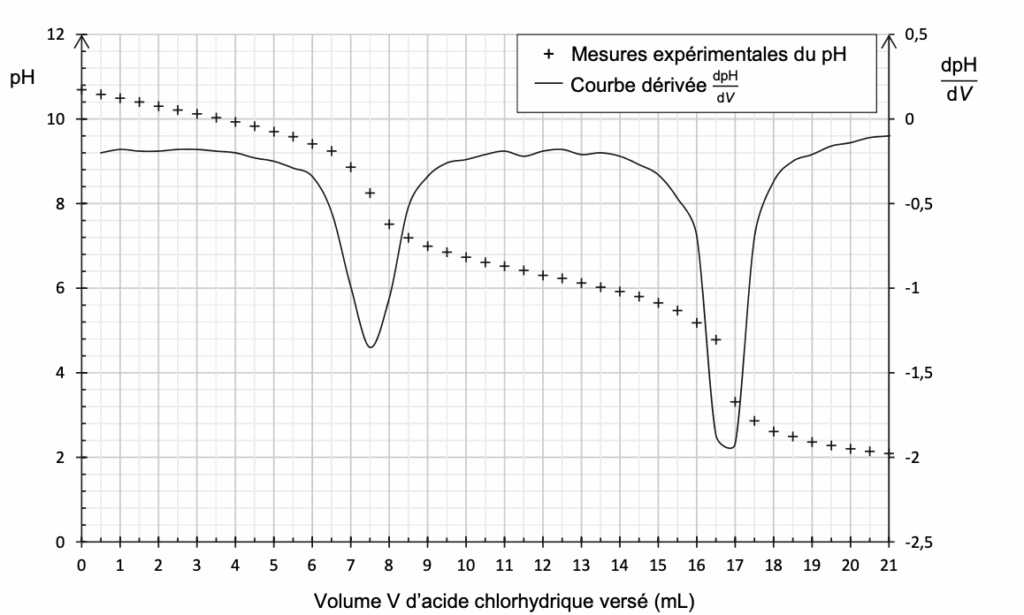
Figure 2. Courbes de suivi pH-métrique et dérivée dpH/dV du titrage de la solution de lessive diluée
Q5. Réaliser un schéma légendé du dispositif expérimental du titrage pH-métrique.
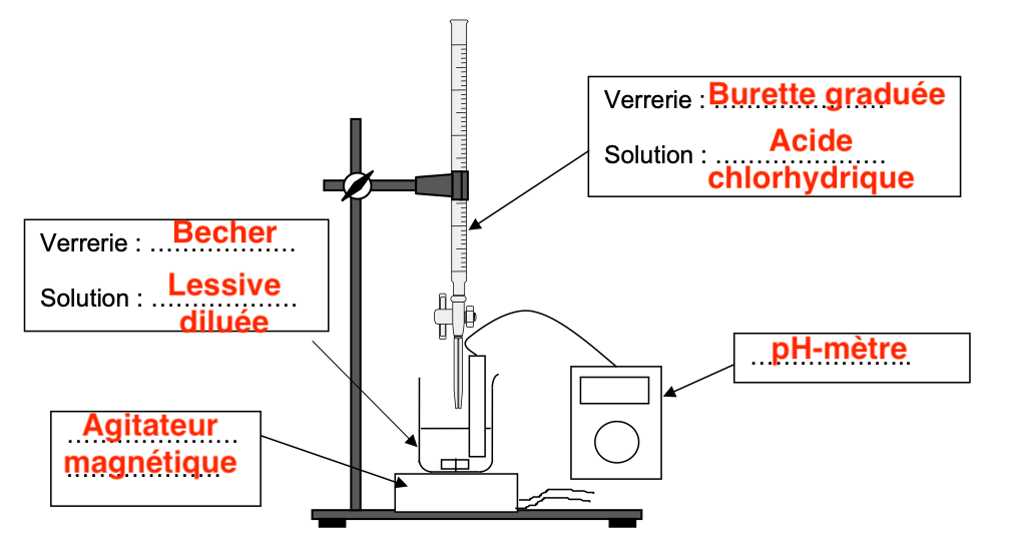
Q6. Préciser, en justifiant, la verrerie à utiliser pour préparer un volume de 100,0 mL de solution de lessive diluée 10 fois.
D’après l’énoncé : « préparer un volume de 100,0 mL de solution de lessive diluée 10 fois. »
$$F=\frac{V_1}{V_0}$$
$$F\times V_0=V_1$$
$$V_0=\frac{V_1}{F}$$
$$V_0=\frac{100,0}{10}$$
$$V_0=10,0\ mL$$
On choisit :
- une fiole jaugée V1=100,0 mL
- une pipette jaugée V0=10,0 mL
Dans la suite de l’exercice, on admet que les ions carbonate sont les seules espèces titrées jusqu’à la première équivalence.
Q7. Écrire l’équation de la réaction support du titrage entre les ions carbonate et les ions oxonium, modélisant la transformation ayant lieu jusqu’à la première équivalence.
Équation de la réaction support du titrage entre les ions carbonate et les ions oxonium, modélisant la transformation ayant lieu jusqu’à la première équivalence :
$${\rm CO}_3^{2-}(aq)+H_3O^+\left(aq\right)\rightarrow{\rm HCO}_3^-+H_2O\left(l\right)$$
Q8. Déterminer le pourcentage en masse de carbonate de sodium Na2CO3 présent dans la lessive « multi- usages » étudiée. Commenter.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
$${\rm CO}_3^{2-}(aq)+H_3O^+\left(aq\right)\rightarrow{\rm HCO}3^-+H_2O\left(l\right)$$
A l’équivalence :
$$\frac{n{{\rm CO}3^{2-}}^i}{1}=\frac{n{H_3O^+}^{eq}}{1}$$
$$n_0({\rm CO}_3^{2-})=n_e(H_3O^+)$$
$$c_{dilue}\times V_1=c_A\times V_E$$
$$c_{dilue}=\frac{c_A\times V_E}{V_1}$$
On détermine graphiquement le volume à l’équivalence (première équivalence) au premier pic de la dérivée de dpH/dV : $V_E=7,5\ mL$
$$c_{dilue}=\frac{1,00\times {10}^{-1}\times 7,5\times {10}^{-3}}{50,0\times {10}^{-3}}$$
$$c_{dilue}=1,5\times {10}^{-2}\ mol{.L}^{-1}$$
D’après le sujet la solution à été diluée d’un facteur 10 :
$$c=10\times c_{dilue}$$
$$c=10\times 1,5\times {10}^{-2}$$
$$c=1,5\times {10}^{-1}\ \ mol{.L}^{-1}$$
Déterminons la masse de carbonate de sodium (${\rm Na}_2{\rm CO}_3$) présente dans 4,0 g de lessive :
$$n{{\rm Na}_2{\rm CO}_3}=\frac{m{{\rm Na}_2{\rm CO}_3}}{M{{\rm Na}_2{\rm CO}_3}}$$
$$\frac{m{{\rm Na}_2{\rm CO}_3}}{M{{\rm Na}_2{\rm CO}_3}}=n{{\rm Na}_2{\rm CO}_3}$$
$$m{{\rm Na}_2{\rm CO}_3}=n{{\rm Na}_2{\rm CO}_3}\times M{{\rm Na}_2{\rm CO}_3}$$
Or
$$n_{{\rm Na}_2{\rm CO}_3}=n{{\rm CO}_3^{2-}}$$
D’où
$$m{{\rm Na}_2{\rm CO}_3}=n{{\rm CO}_3^{2-}}\times M{{\rm Na}_2{\rm CO}_3}$$
Or
$$c=\frac{n_{{\rm CO}_3^{2-}}}{V}$$
$$\frac{n{{\rm CO}_3^{2-}}}{V}=c$$
$$n{{\rm CO}_3^{2-}}=c\times V$$
D’où
$$m{{\rm Na}_2{\rm CO}_3}=c\times V\times M{{\rm Na}_2{\rm CO}_3}$$
$$m{{\rm Na}_2{\rm CO}_3}=1,5\times {10}^{-1}\ \ \times 100,0\times {10}^{-3}\times 106,0$$
$$m{{\rm Na}_2{\rm CO}_3}=1,6\ g$$
Déterminons le pourcentage en masse de carbonate de sodium Na2CO3 présent dans la lessive « multi-usages » étudiée.
$$P=\frac{m_{{\rm Na}_2{\rm CO}_3}}{m{lessive}}\times 100$$
$$P=\frac{1,6\ }{4,0}\times 100$$
$$P=40\ %$$
D’après le sujet : « le pourcentage en masse de carbonate de sodium présent dans une lessive « multi-usages » est compris entre 30 et 60 % »
Ainsi, le pourcentage en masse de carbonate de sodium présent dans une lessive « multi-usages » est bien compris entre 30 et 60 %.
On réalise une expérience similaire, en remplaçant la lessive par une solution de carbonate de sodium pur. Dans ce cas, le volume versé à la seconde équivalence Véq2 est le double du volume versé à la première équivalence Véq1.
Q9. Comparer les valeurs des volumes obtenus à la première et à la seconde équivalence lors du titrage de la lessive. En déduire la nature probable d’autres espèces présentes dans la lessive.
Graphiquement :
le volume à la première équivalence (au premier pic de la dérivée de $dpH/dV$) est : $V_{eq1}=7,5\ mL$
le volume à la deuxième équivalence (au deuxième pic de la dérivée de $dpH/dV$) est : $V_{eq2}=16,8\ mL$
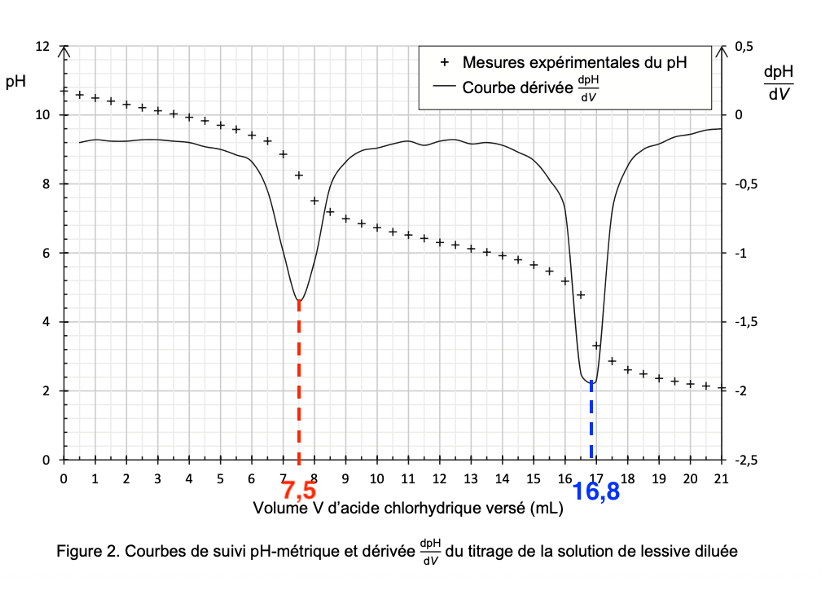
D’après le sujet, pour une solution de carbonate de sodium pur le volume versé à la seconde équivalence Véq2 est le double du volume versé à la première équivalence Véq1.
$$\frac{V_{eq2}}{V_{eq1}}=\frac{16,8}{7,5}$$
$$\frac{V_{eq2}}{V_{eq1}}=2,2$$
$$V_{eq2}=2,2\times V_{eq1}$$
Ici Véq2 n’est pas le double du volume versé à la première équivalence Véq1 : la solution de carbonate de sodium n’est pas pure.
Ainsi, il existe d’autres espèces présentes dans la lessive qui sont probablement des espèces basiques car réagissant avec l’acide chlorhydrique.
