Polynésie 2025 Sujet 2
Exercice 3 – (4 points) – Durée 0h42 – Calculatrice autorisée
Sujet n°25-PYCJ2PO1
Sujet et corrigé
EXERCICE 3 – ÉTUDE D’UN SOIN CAPILLAIRE (4 POINTS)
L’acide glycolique est connu pour ses utilisations en dermatologie afin de lutter contre l’acné mais il entre aussi dans la composition de soins capillaires. C’est une molécule qui, grâce à sa petite taille, pénètre facilement les cheveux et se fixe sur la kératine pour renforcer la fibre capillaire et réduire les cassures.
Dans l’industrie chimique, on le synthétise à partir d’une réaction catalysée faisant intervenir du formaldéhyde et du monoxyde de carbone en présence d’eau selon l’équation de réaction suivante :
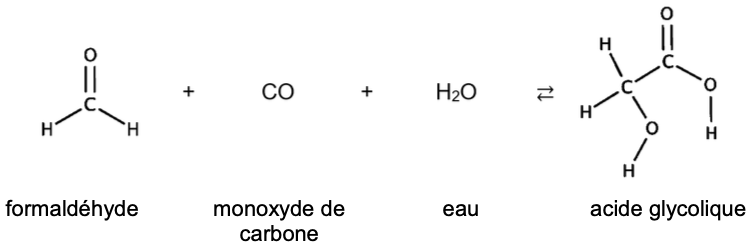
L’objectif de cet exercice est d’étudier la molécule d’acide glycolique puis de vérifier le pourcentage en masse ou titre massique d’un soin capillaire indiqué par le fabriquant.
Étude de la synthèse de la molécule d’acide glycolique.
Données :
- préfixes utilisés pour la nomenclature systématique :
| Nombre d’atomes de carbone | 1 | 2 | 3 | 4 | 5 |
| Préfixe | méth- | éth- | prop- | but- | pent- |
- en nomenclature systématique, les aldéhydes sont désignés par le suffixe -al.
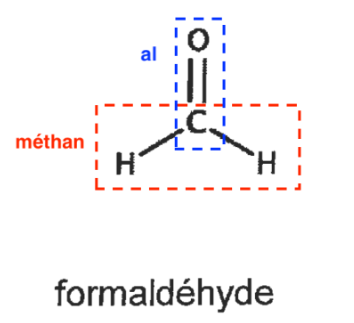
Q1. À l’aide des données, indiquer le nom du formaldéhyde en nomenclature systématique.
Nom du formaldéhyde en nomenclature systématique : méthanal
Al : Liaison C=O
Méthan : 1 atome de carbone
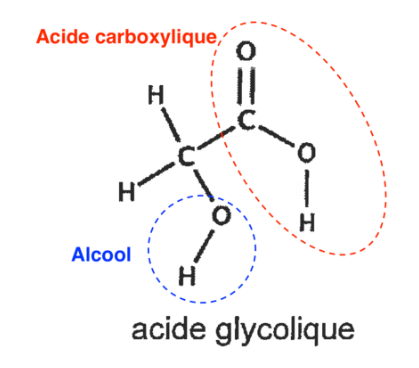
Q2. Recopier sur la copie la formule semi-développée de la molécule d’acide glycolique puis entourer et nommer les groupes caractéristiques présents dans la molécule en précisant les familles fonctionnelles associées.
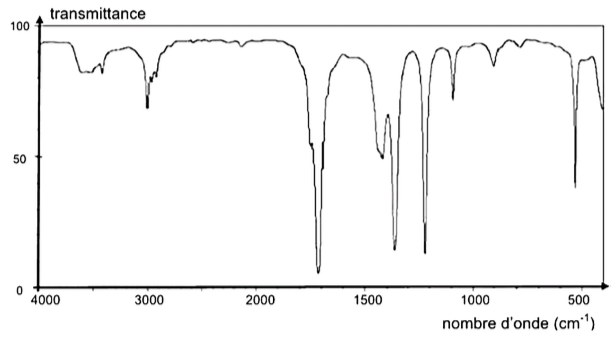
La figure 1 présente les spectres infrarouge de deux espèces chimiques. L’un des spectres est celui de l’acide glycolique.
Spectre A :
Spectre B :
Figure 1. Spectres infrarouge de deux espèces chimiques.
Données :
- table simplifiée de données de spectroscopie IR :
| Liaison | Nombre d’onde (cm–1) | Intensité |
| O-H alcool libre | 3500 – 3700 | forte, fine |
| O-H alcool lié | 3200 – 3400 | forte, large |
| O-H acide carboxylique | 2500 – 3200 | forte à moyenne, large |
| C = O ester | 1700 – 1740 | forte |
| C = O aldéhyde et cétone | 1650 – 1730 | forte |
| C = O acide carboxylique | 1680 – 1710 | forte |
Q3. À l’aide des données, identifier parmi les spectres A et B de la figure 1 celui qui correspond à la molécule d’acide glycolique. Justifier la réponse.
La molécule d’acide glycolique possède :
Une liaison O-H d’un alcool
Une liaison O-H d’un acide carboxylique
Une liaison C=O d’un acide carboxylique
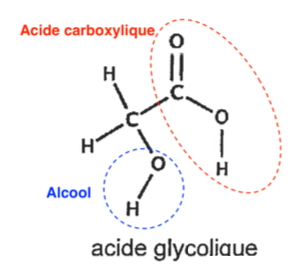
Le spectre d’absorption IR de l’acide glycolique doit présenter :
- Une bande correspondant à une liaison C = O acide carboxylique (nombre d’onde compris entre 1680 et 1710 cm-1)
- Une bande correspondant à une liaison O-H acide carboxylique (nombre d’onde compris entre 2500 et 3200 cm-1)
- Une bande correspondant à une liaison O-H alcool (nombre d’onde compris entre 3200 et 3400 cm-1)

Le spectre B possède toutes les bandes correspondantes aux liaisons de l’acide glycolique.
Ainsi, le spectre B correspond à la molécule d’acide glycolique.
Étude d’un sérum capillaire.
Sur le flacon d’un sérum réparateur de cheveux, le fabriquant indique 7,0 % en masse d’acide glycolique. On souhaite vérifier ce pourcentage en masse ou titre massique grâce à un titrage colorimétrique.
Pour cela, après avoir dilué 10 fois le sérum, on titre un prélèvement de volume V1 = 20,0 mL de solution diluée par une solution titrante d’hydroxyde de sodium (Na+(aq) ; HO–(aq)) de concentration en quantité de matière C2 = 2,0×10–1 mol∙L–1 en présence d’un indicateur coloré. La valeur du volume de solution titrante versé à l’équivalence est VE = 9,4 mL.
Données :
- principaux indicateurs colorés :
| Nom | Teinte acide | Zone de virage | Teinte basique |
| Hélianthine | rouge | 3,1 – 4,4 | jaune |
| Rouge de méthyle | rouge | 4,2 – 6,2 | jaune |
| Bleu de bromothymol (BBT) | jaune | 6,0 – 7,6 | bleu |
| Phénolphtaléine | incolore | 8,2 – 10,0 | rose-violet |
- masse molaire de l’acide glycolique : M = 76,0 g∙mol–1 ;
- masse volumique du sérum capillaire ρ = 1,0 g∙mL–1 ;
- des études montrent que lors du titrage d’une solution d’acide glycolique par une solution d’hydroxyde de sodium, le pH à l’équivalence est voisin de 8,5.
Q4. Rédiger le protocole expérimental permettant de préparer un volume V = 50,0 mL de solution de sérum capillaire dilué 10 fois.
D’après l’énoncé : « on prépare 50,0 mL d’une solution de sérum capillaire dilué 10 fois »
$$F=\frac{V_1}{V_0}$$
$$F\times V_0=V_1$$
$$V_0=\frac{V_1}{F}$$
$$V_0=\frac{50}{10}$$
$$V_0=5,0\ mL$$
On choisit :
- une fiole jaugée V1=50 mL
- une pipette jaugée V0=5 mL
Protocole expérimental permettant de préparer la solution S :
- Prélever, à l’aide d’une pipette jaugée de 2,00 mL de la solution mère.
- Introduire le prélèvement dans une fiole jaugée de 50,0 mL.
- Ajouter au ¾ de l’eau distillée et homogénéiser.
- Ajuster avec de l’eau distillée jusqu’au trait de jauge.
- Homogénéiser.
Q5. Indiquer, en justifiant à l’aide des données, l’indicateur coloré que l’on peut utiliser lors de ce titrage.
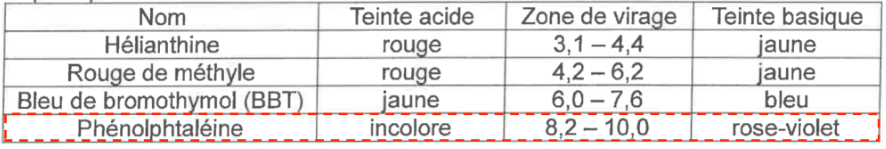
La phénolphtaléine contient pHeq dans sa zone de virage. Ainsi, la phénolphtaléine convient comme indicateur coloré pour ce titrage.
On souhaite modéliser la transformation chimique mise en jeu lors de ce titrage. Pour cela, on notera AH l’acide glycolique et A– l’ion glycolate.
Q6. Écrire l’équation de la réaction support du titrage réalisé.
L’équation de la réaction support du titrage est :
$$HA\left(aq\right)+{\rm HO}^-\left(aq\right)\rightarrow A^-\left(aq\right)+\ H_2O(l)$$
Q7. Définir l’équivalence d’un titrage.
L’équivalence est atteinte lorsque les réactifs sont introduits dans des proportions stœchiométriques.
Q8. En déduire l’expression puis calculer la valeur de la concentration en quantité de matière en acide glycolique C1 du sérum dilué puis la concentration en quantité de matière en acide glycolique du sérum commercial notée C.
A l’équivalence :
$$\frac{n_{HA}^i}{1}=\frac{n_{{\rm HO}^-}^{eq}}{1}$$
$$C_1\times V_1=C_2\times V_E$$
$$C_1=\frac{C_2\times V_E}{V_1}$$
$$C_1=\frac{2,0\times{10}^{-1}\times9,4\times{10}^{-3}}{20,0\times{10}^{-3}}$$
$$C_1=9,4\times{10}^{-2}\ mol.L^{-1}$$
La solution de sérum capillaire dilué 10 fois :
$$C=10{\timesC}_1$$
$$C=10\times9,4\times{10}^{-2}$$
$$C=9,4\times{10}^{-1}\ mol.L^{-1}$$
Données :
- pour discuter de l’accord du résultat d’une mesure avec une valeur de référence, on utilise le quotient $\frac{|x – x_{\text{réf}}|}{u(x)}$ avec x, la valeur mesurée, $x_{\text{réf}}$ la valeur de référence et $u(x)$, l’incertitude-type associée à la valeur mesurée x.
On estime l’incertitude-type sur la détermination de la concentration en quantité de matière en acide glycolique u(C) = 0,05 mol∙L–1.
Q9. À l’aide des données, indiquer si le pourcentage en masse ou titre massique indiqué par le fabriquant est correct.
Calculons la concentration de la solution d’acide glycolique :
$$C_{ref}=\frac{n_{acide}}{V_{Solution}}$$
Or
$$n_{acide}=\frac{m_{acide}}{M_{acide}}$$
Ainsi :
$$C_{ref}=\frac{n_{acide}}{V_{Solution}}=\frac{m_{acide}}{M_{acide}\times V_{Solution}}$$
Or le titre massique (pourcentage) est défini par :
$$t_m=\frac{m_{acide}}{m_{solution}}$$
D’ou
$$m_{acide}=t_m\times m_{solution}$$
Ainsi :
$$C_{ref}=\frac{m_{acide}}{M_{acide}\times V_{Solution}}=\frac{t_m\times m_{solution}}{M_{acide}\times V_{Solution}}$$
Or
$$\rho_{solution}=\frac{m_{solution}}{V_{Solution}}$$
Ainsi :
$$C_{ref}=\frac{t_m\times m_{solution}}{M_{acide}\times V_{Solution}}=\frac{t_m\times\rho_{solution}}{M_{acide}}$$
$$C_{ref}=\frac{\frac{7}{100}\times1,0\times{10}^3}{76,0}$$
$$C_{ref}=9,2\times{10}^{-1}\ mol.L^{-1}$$
D’après les données : pour discuter de l’accord du résultat d’une mesure avec une valeur de référence, on peut utiliser le quotient :
$$\frac{\left|x-x_{ref}\right|}{u\left(x\right)}$$
$$\frac{\left|C-C_{ref}\right|}{u\left(C\right)}=\frac{\left|9,4\times{10}^{-1}-9,2\times{10}^{-1}\right|}{0,05}$$
$$\frac{\left|C-C_{ref}\right|}{u\left(C\right)}=0,4$$
$$\frac{\left|C-C_{ref}\right|}{u\left(C\right)}<2$$
Ainsi, pourcentage en masse indiqué par le fabriquant est correct.
