Bac Amérique du sud 2025 Sujet 1
Exercice 2 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°25-PYCJ1AS1
Sujet et corrigé
EXERCICE 2. Recharge des voitures électriques (5 points)
Dans cet exercice, on s’intéresse à une pile à combustible au bioéthanol. Elle permet d’alimenter des bornes de recharge de voitures électriques. Ce modèle de pile à combustible est dit à oxydes solides (ou SOFC selon l’acronyme anglais de solid oxide fuel cells).
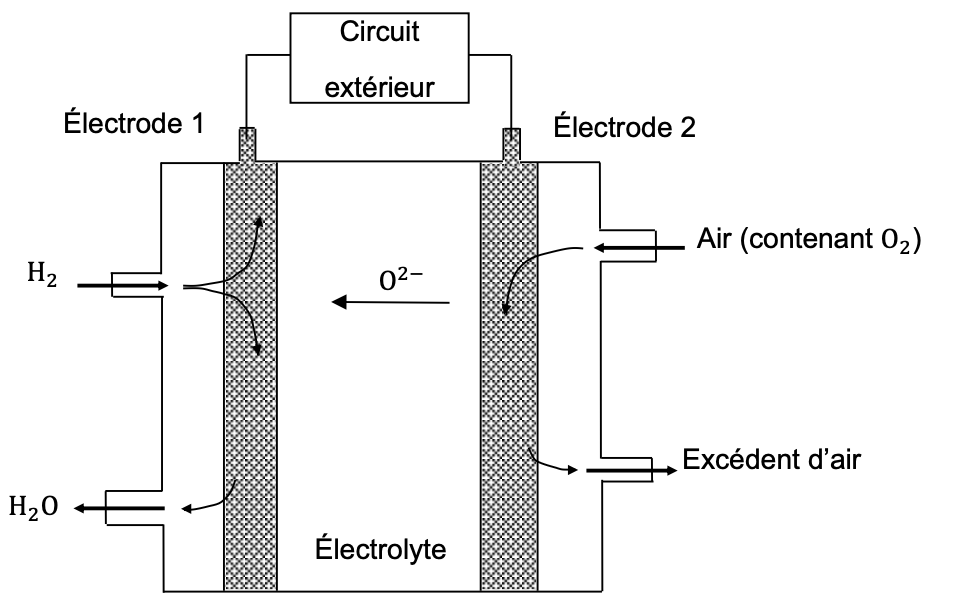
Figure 1. Schéma de fonctionnement de la pile étudiée
Comme le montre la figure 1, au niveau de l’électrode 2, le dioxygène présent dans l’air est transformé en ion oxyde (O2−). Les ions diffusent dans l’électrolyte et réagissent avec le dihydrogène, obtenu par vaporeformage d’éthanol, au niveau de l’électrode 1. Au niveau de l’électrode 1, la transformation est modélisée par une réaction électrochimique d’équation suivante :
H2 + O2− → H2O + 2 e−
Données :
- masses molaires atomiques : 𝑀(C) = 12,0 g⋅mol-1 ; 𝑀(H) = 1,0 g⋅mol-1 ; 𝑀(O) = 16,0 g⋅mol-1 ;
- constante d’Avogadro : 𝑁A = 6,02 × 1023 mol−1 ;
- charge électrique élémentaire : 𝑒 = 1,60 × 10−19 C ;
- constante de Faraday : ℱ = 9,65 × 104 C⋅mol-1 ;
- énergie stockée dans une pile (en joule) : 𝐸 = 𝑄 ⋅ 𝑈 où 𝑄 est la capacité électrique de la pile en coulomb (C) et 𝑈 la tension à vide en volt (V) à ses bornes ;
– 1 W⋅h = 3600 J ;
- tension à vide de la pile à combustible étudiée : 𝑈 = 1,0 V ;
- densité de l’éthanol : 𝑑éthanol = 0,789 à 25 °C ;
- masse volumique de l’eau : 𝜌 = 1,00 g⋅cm-3 à 25 °C.
Le vaporeformage de l’éthanol consiste à transformer de l’eau et de l’éthanol en dihydrogène et en dioxyde de carbone en présence d’un catalyseur. Cette transformation est modélisée par une réaction dont l’équation est écrite ci-dessous.
C2H5OH (𝓁) + 3 H2O (g) → 6 H2 (g) + 2 CO2 (g)
Cependant, de nombreuses autres transformations sont possibles d’où la nécessité d’avoir un catalyseur très actif et extrêmement sélectif pour ne produire que du dihydrogène et du dioxyde de carbone à partir de l’éthanol. Dans la suite, on suppose que la conversion d’éthanol en dihydrogène est totale.
Q1. Rappeler la définition d’un catalyseur.
Un catalyseur est une espèce qui augmente la vitesse d’une transformation, sans figurer dans l’équation de la réaction.
Q2. Montrer que dans un volume de 1,0 L, la valeur de la quantité d’éthanol présente est voisine de 17 moles.
Calculons la quantité de matière d’éthanol C2H5OH présente :
$n_{Ethanol}=\frac{m_{Ethanol}}{M_{Ethanol}}$
Or
$\rho_{Ethanol}=\frac{m_{Ethanol}}{V_{Ethanol}}$
$\frac{m_{Ethanol}}{V_{Ethanol}}=\rho_{Ethanol}$
$m_{Ethanol}=\rho_{Ethanol}\times V_{Ethanol}$
D’où
$n_{Ethanol}=\frac{\rho_{Ethanol}\times V_{Ethanol}}{M_{Ethanol}}$
Or
$d_{Ethanol}=\frac{\rho_{Ethanol}}{\rho_{eau}}$
$\frac{\rho_{Ethanol}}{\rho_{eau}}=d_{Ethanol}$
$\rho_{Ethanol}=d_{Ethanol}\times \rho_{eau}$
D’où
$n_{Ethanol}=\frac{d_{Ethanol}\times \rho_{eau}\times V_{Ethanol}}{M_{Ethanol}}$
$n_{Ethanol}=\frac{0,789\times 1,0\times 10^3\times 1,0}{2\times 12,0+5\times 1,0+16,0+1,0}$
$n_{Ethanol}=17\ mol$
Q3. En déduire la valeur de la quantité de dihydrogène obtenue lors du vaporeformage d’un litre d’éthanol, la vapeur d’eau étant en excès.
| $ C_2H_5OH\ (l)$ | $+3\ H_2O(g) \rightarrow$ | $6\ H_2(g) $ | $+2\ {\rm CO}_2(g)$ | |
| État initial | 17 | Excès | 0 | 0 |
| État intermédiaire | 17-x | Excès | 6 x | 2 x |
| État final | 17-xf | Excès | 6 xf | 2 xf |
$17-x_{max}=0$
$-x_{max}=-17$
$x_{max}=17\ mol$
D’après l’énoncé « on suppose que la conversion d’Ethanol en dihydrogène est totale. »
$x_f=x_{max}=17\ mol$
$n_{H_2}^{produite}=6\ x_f$
$n_{H_2}^{produite}=6 \times 17$
$n_{H_2}^{produite}=102\ mol$ Ainsi, 102 mol de dihydrogène sont obtenu lors du vaporeformage d’un litre d’Ethanol
Q4. Établir l’équation de la réaction électrochimique modélisant la transformation prenant place au niveau de l’électrode 2.
D’après l’énoncé « au niveau de l’électrode 2, le dioxygène présent dans l’air est transformé en ion oxyde (O2−). »
$O_2+4e^-\rightarrow2O^{2-}$
Q5. En déduire que l’équation de la réaction modélisant le fonctionnement de la pile est :
2 H2 (g) + O2 (g) → 2 H2O (g)
Électrode 1 : $H_2+O^{2-}\rightarrow H_2O+2e^-\ \ \ \times 2$
Électrode 2 : $O_2+4e^-\rightarrow 2O^{2-}$
$2H_2+2O^{2-}+O_2\rightarrow 2H_2O+2O^{2-}$
$2H_2+O_2\rightarrow 2H_2O$
Ainsi, l’équation de la réaction modélisant le fonctionnement de la pile est :
$2H_2(g)+O_2(g)\rightarrow 2H_2O(g)$
Q6. Indiquer, en justifiant, la polarité des deux électrodes de cette pile et les nommer.
$H_2+O^{2-}\rightarrow H_2O+2e^-$ se déroule à l’électrode 1. Cette réaction libère des électrons : c’est la borne négative de la pile.
$O_2+4e^-\rightarrow 2O^{2-}$ se déroule à l’électrode 2. Cette réaction consomme des électrons : c’est la borne positive de la pile.
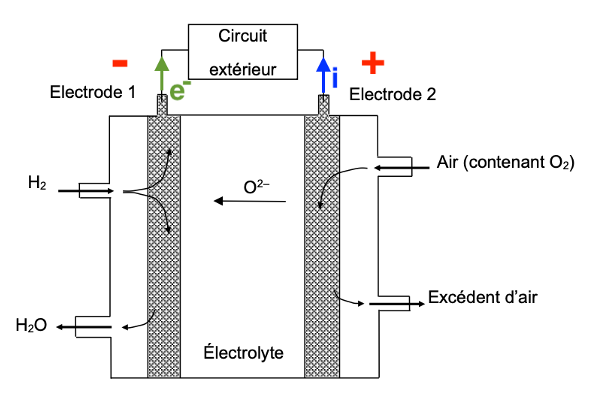
Q7. Sur le document-réponse 1 de L’ANNEXE À RENDRE AVEC LA COPIE, indiquer cette polarité ainsi que le nom et le sens de circulation des porteurs de charge à l’extérieur de la pile.
Le sens du courant électrique à l’extérieur de la pile va de la borne positive vers la borne négative.
À l’extérieur de pile les porteurs de charge sont les électrons qui se déplacent de la borne négative vers la borne positive.
Q8. Montrer que la valeur maximale de la capacité électrique de la pile étudiée utilisant 1,0 L d’éthanol est 𝑄max = 2,0 × 107 C.
$Q=n_{e^-} \times Na \times e$
Or d’après l’équation $H_2+O^{2-}\rightarrowH_2O+2e^-$
$\frac{n_{e^-}}{2}=n_{H_2}^{produite}$
$n_{e^-}=2 \times n_{H_2}^{produite}$
d’ou
$Q_{max}=2 \times n_{H_2}^{produite} \times Na \times e$
$Q_{max}=2 \times 102 \times 6,02 \times {10}^{23} \times 1,60 \times {10}^{-19}$
$Q_{max}=2,0\ \times {10}^7\ C$
Le rendement de la pile à combustible SOFC est voisin de 70 %.
Q9. Estimer le nombre de véhicules électriques équipés de batteries de 40 kW·h que l’on peut recharger à partir d’un volume de 30 m3 d’éthanol.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
D’après l’énoncé :
Énergie stockée dans une pile (en joule) : $𝐸 = 𝑄 ⋅ 𝑈$ où 𝑄 est la capacité électrique de la pile en coulomb (C) et 𝑈 la tension à vide en volt (V) à ses bornes ;
$1 W⋅h = 3600 J$ ;
tension à vide de la pile à combustible étudiée : $𝑈 = 1,0 V$ ;
Calculons l’énergie maximale produite par un litre d’Ethanol :
$E_{max}=Q_{max} \times U$
$E_{max}=2,0\ \times {10}^7 \times 1,0$
$E_{max}=2,0\ \times {10}^7\ J$
Le rendement de la pile à combustible SOFC est voisin de 70 %.
Calculons l’énergie réellement produite par un litre d’Ethanol :
$Eréel=70/100×Emax$
$Eréel=70/100×2,0 ×10^7$
$Eréel=1,4 ×10^7 J$
Convertissons cette énergie en W⋅h :
| 1 W⋅h | 3600 J |
| Eréel | $1,4 ×10^7 J$ |
$Eréel=1,4 ×10^7 ×1/3600$
$Eréel=3,9 ×10^3 W∙h$
Cette énergie est obtenue pour un litre d’éthanol. Calculons l’énergie obtenue pour 30 m3 d’éthanol :
| 1 L | $3,9 ×10^3 W∙h$ |
| 30 m3 = 30 x 103 L | $E_{30}$ |
$E_{30}=\frac{30\ \times {10}^3\ \times 3,9\ \times {10}^3\ }{1}$
$E_{30}=1,2 \times {10}^8\ W\cdot h$
Estimer le nombre de véhicules électriques équipés de batteries de 40 kW·h que l’on peut recharger à partir d’un volume de 30 m3 d’éthanol.
| 1 véhicule | 40 kW·h |
| N véhicules | $1,2 \times {10}^8\ W\cdot h$ |
$N=\frac{1,2 \times {10}^8\ \times 1\ }{40\ \times {10}^3}$
$N=3,0 \times {10}^3$
Ainsi, on peut recharger 3000 véhicules électriques équipés de batteries de 40 kW·h que à partir d’un volume de 30 m3 d’éthanol.
ANNEXE À RENDRE AVEC LA COPIE
Document-réponse 1 (exercice 2, question Q7)

