Bac Amérique du sud 2025 Sujet 1
Exercice 3 – (4 points) – Durée 0h42 – Calculatrice autorisée
Sujet n°25-PYCJ1AS1
Sujet et corrigé
EXERCICE 3. Étude d’un herbicide (4 points)
Un herbicide, ou désherbant, est une substance destinée à tuer les végétaux.
Pendant longtemps, le principe actif utilisé était le glyphosate, mais cette substance toxique, irritante et écotoxique a été classée cancérigène, et est donc remplacée par une autre molécule : l’acide pélargonique.
Le but de cet exercice est de vérifier l’indication de la concentration en masse d’acide pélargonique figurant sur les flacons en vente dans les commerces spécialisés : 43,06 g·L−1.
Données diverses :
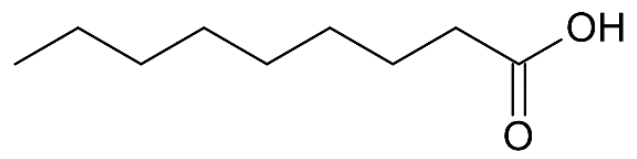
- l’acide pélargonique est le nom usuel de l’acide nonanoïque ;
- formule topologique de l’acide pélargonique :
- masse molaire de l’acide nonanoïque : 𝑀 = 158 g·mol−1 ;
- masse volumique de la solution d’herbicide : 𝜌 = 1,00 × 103 g·L−1.
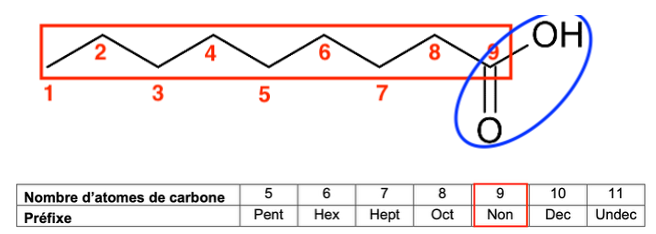
Préfixes de la nomenclature en chimie organique
| Nombre d’atomes de carbone | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| Préfixe | Pent | Hex | Hept | Oct | Non | Dec | Undec |
Matériels et produits mis à disposition :
- agitateur magnétique avec un barreau aimanté ;
- pH-mètre et conductimètre étalonnés ;
- béchers de volumes divers, éprouvettes (50 mL ; 100 mL et 250 mL), erlenmeyers de volumes divers, burette graduée, fioles jaugées (50,0 mL ; 100,0 mL et 200,0 mL), pipettes jaugées (2,0 mL ; 5,0 mL ; 10,0 mL et 20,0 mL) ;
- solution d’hydroxyde de sodium (Na+(aq) ; HO−(aq)) de concentration en soluté apporté 𝐶 = 1,00 × 10−2 mol⋅L−1 ;
- herbicide commercial ;
- eau distillée.
Comparaison d’une mesure avec une valeur de référence
Le résultat d’une mesure est considéré en accord avec une valeur de référence si la valeur du quotient 𝑧 est inférieure ou égale à 2.
avec :
$z = \dfrac{|x – x_{ref}|}{u(x)}$
- 𝑥 : la valeur mesurée ;
- 𝑥𝑟𝑒𝑓 : la valeur de référence ;
- 𝑢(𝑥) : l’incertitude-type associée à la mesure de 𝑥.
Pour cette expérience, on considère que la concentration en masse d’acide pélargonique est déterminée avec une incertitude-type 𝑢(𝑐𝑚) = 1,2 g·L−1.
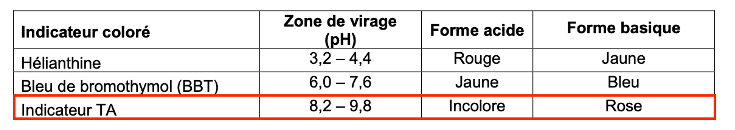
Zone de virage de quelques indicateurs colorés
| Indicateur coloré | Zone de virage (pH) | Forme acide | Forme basique |
| Hélianthine | 3,2 – 4,4 | Rouge | Jaune |
| Bleu de bromothymol (BBT) | 6,0 – 7,6 | Jaune | Bleu |
| Indicateur TA | 8,2 – 9,8 | Incolore | Rose |
Q1. Justifier le nom « acide nonanoïque » en nomenclature officielle de l’acide pélargonique.
L’acide pélargonique il comporte :
- 9 atomes de carbone : nona
- Un groupe COOH : acide …….oïque
C’est pourquoi il s’appelle « acide nonanoïque » en nomenclature officielle.
La solution commerciale d’herbicide est trop concentrée pour pouvoir être titrée directement.
Q2. Proposer un protocole permettant de diluer la solution d’un facteur 10 en utilisant le matériel mis à disposition.
D’après l’énoncé il faut « diluer la solution d’un facteur 10. »
$F=\frac{V_1}{V_0}$
$\frac{V_1}{V_0}=F$
$V_1=F\times V_0$
$V_1=10\times V_0$
Le volume V1 de la solution fille (volume de la fiole jaugée), doit être 10 plus grand que le volume V0 de la solution mère (volume de la pipette jaugée).
On choisit :
- une fiole jaugée V1=50,0 mL
- une pipette jaugée V0=5,0 mL
Ou
- une fiole jaugée V1=100,0 mL
- une pipette jaugée V0=10,0 mL
Ou
- une pipette jaugée V0=20,0 mL
- une fiole jaugée V1=200,0 mL
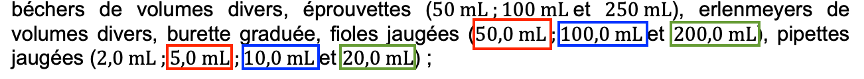
Protocole expérimental permettant de préparer la solution S :
- Prélever, à l’aide d’une pipette jaugée de 5,0 mL de la solution mère.
- Introduire le prélèvement dans une fiole jaugée de 50,0 mL.
- Ajouter au ¾ de l’eau distillée et homogénéiser.
- Ajuster avec de l’eau distillée jusqu’au trait de jauge.
- Homogénéiser.
La solution diluée ainsi obtenue est notée « solution S ».
On réalise un dosage par titrage acido-basique de l’acide pélargonique contenu dans cette solution par une solution d’hydroxyde de sodium (Na+(aq) ; HO−(aq)).
Protocole expérimental :
- remplir convenablement la burette avec la solution titrante d’hydroxyde de sodium de concentration 𝐶 = 1,00 × 10−2 mol⋅L−1 ;
- prélever un volume 𝑉S = 5,0 mL de solution S et le verser dans un bécher ;
- placer l’électrode du pH-mètre et ajouter un peu d’eau pour l’immerger ;
- ajouter lentement la solution titrante dans le bécher en notant régulièrement les valeurs du pH.
L’équation de la réaction support du titrage est :
C8H17COOH(aq)+ HO−(aq) → C8H17COO−(aq)+ H2O(l)
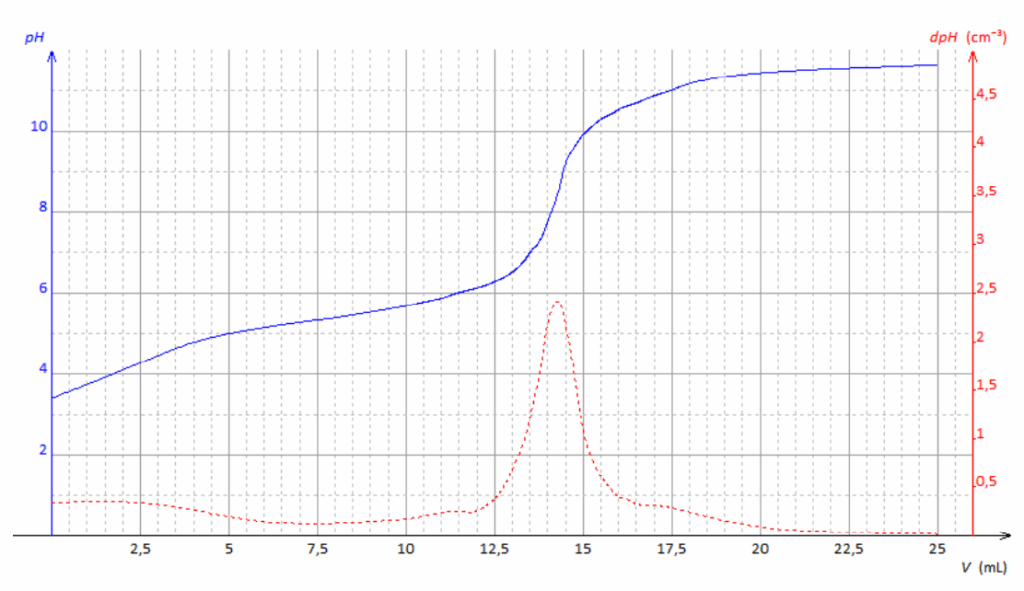
La courbe obtenue est donnée en ANNEXE A RENDRE AVEC LA COPIE.
Q3. Définir l’équivalence d’un titrage.
A l’équivalence, les réactifs sont introduits dans les proportions stœchiométriques.
Q4. Déterminer la valeur du volume 𝑉E d’hydroxyde de sodium versé à l’équivalence. Faire apparaitre la démarche sur le document-réponse 2 de L’ANNEXE À RENDRE AVEC LA COPIE.
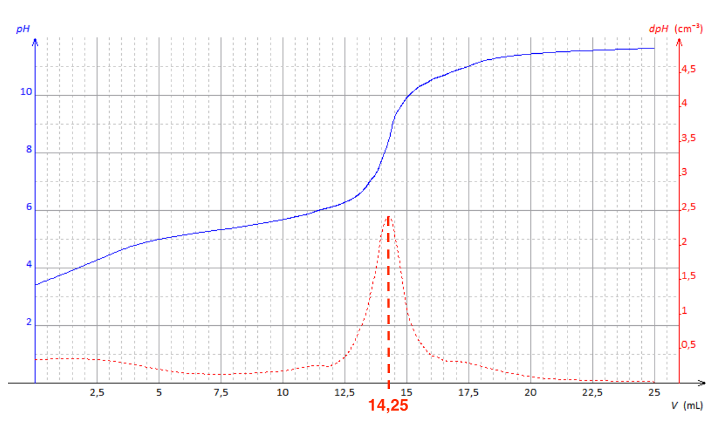
On peut déterminer graphiquement le volume à l’équivalence avec la méthode des tangentes parallèles ou au pic de la dérivée de dpH/dV.
Dans notre cas, le saut de pH est peu marqué.
Pour être plus précis, on utilise le pic de la dérivée de dpH/dV.
Graphiquement au pic de la dérivée de dpH/dV : VE=14,25 mL
Q5. Exploiter les résultats pour déterminer la concentration 𝐶ap en quantité d’acide pélargonique dans la solution commerciale d’herbicide.
L’équation de la réaction support du titrage est :
$C_{18}H_{17}COOH(aq)+HO^-(aq)\rightarrow C_{18}H_{17}COO^-(aq)+H_2O(l)$
A l’équivalence :
$\frac{n_{C_{18}H_{17}COOH}^i}{1}=\frac{n_{HO^-}^{eq}}{1}$
$C_S\times V_S=C\times V_E$
$C_S=\frac{C\times V_E}{V_S}$
$C_S=\frac{1,00\times 10^{-2}\times 14,25\times 10^{-3}}{5,0\times 10^{-3}}$
$C_S=2,85\times 10^{-2}\ \text{mol.L}^{-1}$
D’après le sujet la solution a été diluée d’un facteur 10 :
$C_{ap}=10\times C_S$
$C_{ap}=10\times 2,9\times 10^{-2}$
$C_{ap}=2,85\times 10^{-1}\ \text{mol.L}^{-1}$
Q6. Vérifier si le résultat de ce titrage est cohérent avec l’indication du fabriquant.
L’indication de la concentration en masse d’acide pélargonique figurant sur les flacons en vente dans les commerces spécialisés : 43,06 g·L−1
Calculons la concentration en masse d’acide pélargonique trouvée :
$C_{m,ap}=C_{ap}\times M$
$C_{m,ap}=2,85\times 10^{-1}\times 158$
$C_{m,ap}=4,50\times 10^{1}\ \text{g.L}^{-1}$
D’après l’énoncé « le résultat d’une mesure est considéré en accord avec une valeur de référence si la valeur du quotient 𝑧 est inférieure ou égale à 2. »
$z=\left|\frac{x-x_{ref}}{u(x)}\right|$
$z=\left|\frac{C_m-C_{m,ap}}{u(C_m)}\right|$
$z=\left|\frac{43,06-4,50\times 10^{1}}{1,2}\right|$
$z=1,6$
$z<2$ : le résultat est considéré en accord avec l’indication du fabriquant.
Titrage colorimétrique
Il est également possible de réaliser un titrage colorimétrique de la solution S à l’aide d’un indicateur coloré.
Q7. Choisir l’indicateur coloré adapté à ce titrage. Justifier.
Pour choisir un indicateur coloré, il faut que le pH à l’équivalence soit compris dans sa zone de virage.
Graphiquement pHeq= 8,5
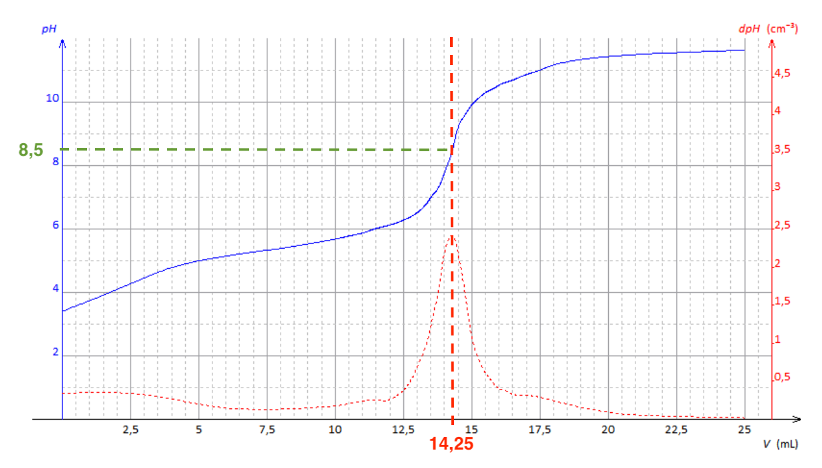
Nous choisissons Indicateur TA comme indicateur coloré.
Q8. Préciser le changement de couleur observé à l’équivalence du titrage.
Avant l’équivalence, le pH est inférieur à 8,2 : la solution prend la teinte acide de l’indicateur TA et reste incolore.
Après l’équivalence, le pH dépasse 9,8 : la solution prend la teinte basique de l’indicateur TA et devient rose.
Ainsi, le changement de couleur à l’équivalence est de l’incolore au rose.
ANNEXE À RENDRE AVEC LA COPIE
Document-réponse 2 (exercice 3, question Q4)
Courbe de titrage de 𝑉𝑆 = 5,0 mL de solution 𝑆 d’herbicide diluée par une solution d’hydroxyde de sodium de concentration 𝐶 = 1,00 × 10−2 mol⋅L−1.
- En trait plein est représentée l’évolution du pH en fonction du volume 𝑉 de solution d’hydroxyde de sodium versé.
- En pointillés est représentée l’évolution de la dérivée du 𝑝𝐻 par rapport au volume 𝑉 en fonction de ce volume 𝑉 de solution d’hydroxyde de sodium versé.