Bac Amérique du sud 2025 Sujet 2
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n°25-PYCJ2AS1
Sujet et corrigé
EXERCICE 1. Infusion à la framboise (9 points)
La frambinone, couramment appelée « cétone de la framboise », est une molécule (figure 1) qui permet de retrouver l’odeur caractéristique de la framboise. Elle est utilisée essentiellement comme arôme alimentaire. La frambinone naturelle étant présente en très faible concentration dans la framboise, son extraction est coûteuse et n’est pas envisageable à l’échelle industrielle.
L’objectif de cet exercice est d’étudier dans une première partie une des voies de synthèse de la frambinone et dans une deuxième partie le détartrage d’une bouilloire utilisée pour préparer une infusion à la framboise.
Les parties 1 et 2 sont indépendantes.
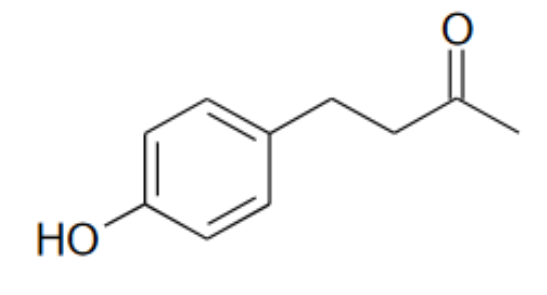
Figure 1. Structure de la frambinone ou cétone de la framboise
Partie 1. Synthèse de la frambinone
Q1. Représenter la formule semi-développée de la molécule de frambinone.
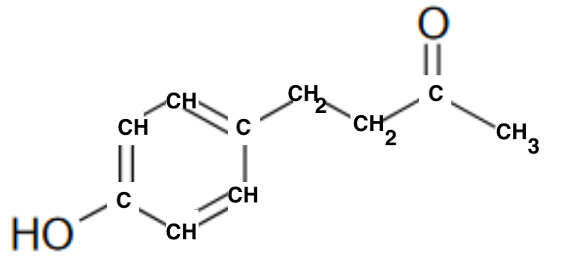
Q2. Entourer et nommer les groupes caractéristiques de la frambinone et préciser le groupe qui permet de justifier son appellation de « cétone de la framboise ».
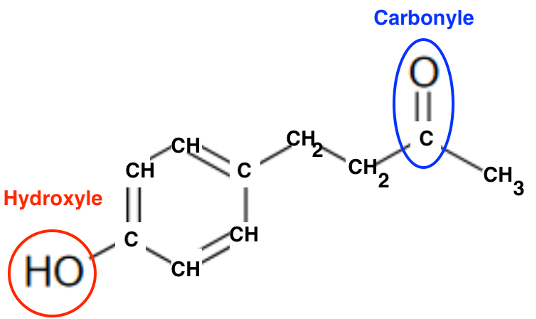
Le groupe qui permet de justifier son appellation de « cétone de la framboise » est le groupe carbonyle de la famille des cétones.
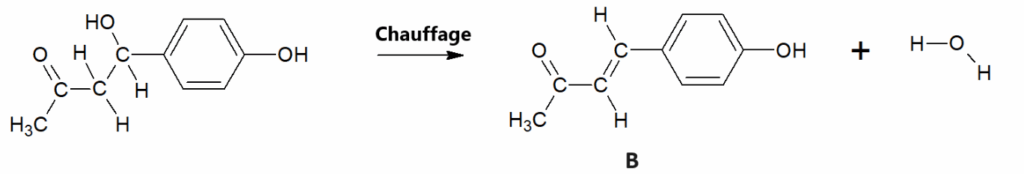
Les deux étapes de la séquence réactionnelle d’un des procédés de synthèse de la frambinone sont représentées ci-après.
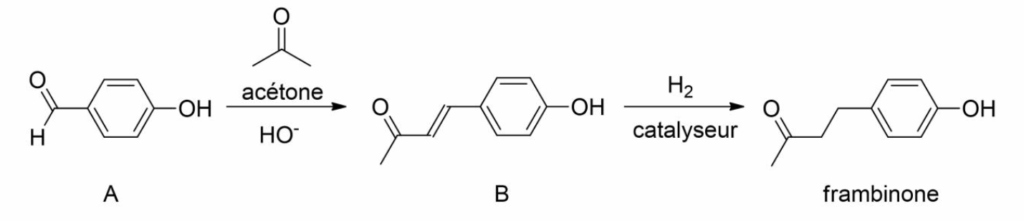
Figure 2. Étapes de la séquence réactionnelle d’obtention de la frambinone
Protocole de l’étape permettant de passer de l’espèce A à l’espèce B (A → B)
On dissout 2,50 g de 4-hydroxybenzaldéhyde (réactif A) dans 10,0 mL d’acétone. Après dissolution, on ajoute, en excès, 10 mL d’une solution aqueuse d’hydroxyde de sodium à 2,5 mol⋅L−1 : le milieu réactionnel prend alors une couleur ambre foncé. Après 24 h d’agitation à température ambiante, on observe une pâte orangée. L’espèce B obtenue est un composé intermédiaire de cette synthèse.
Données :
- masse molaire du 4-hydroxybenzaldéhyde : 122,1 g⋅mol−1 ;
- masse molaire de la frambinone : 164,2 g⋅mol−1 ;
- solubilité du 4-hydroxybenzaldéhyde dans différents solvants :
| Solvants | Eau | Alcool | Acétone | Éther diéthylique |
| Solubilité du 4- hydroxybenzaldéhyde | faible | forte | très forte | forte |
- l’acétone est totalement miscible à l’eau.
Q3. Justifier l’utilisation de l’acétone comme solvant lors de l’étape A → B de la synthèse. Le mécanisme réactionnel de l’étape A → B est donné en annexe.
Le 4-hydroxybenzaldéhyde y est très soluble dans l’acétone il y est donc dissout complètement.
De plus, l’acétone est totalement miscible à l’eau : après addition de la solution aqueuse de NaOH (hydroxyde de sodium), on obtient un milieu homogène favorisant la réaction A → B.
C’est donc un solvant à la fois adapté au réactif 4-hydroxybenzaldéhyde et compatible avec la solution basique d’hydroxyde de sodium.
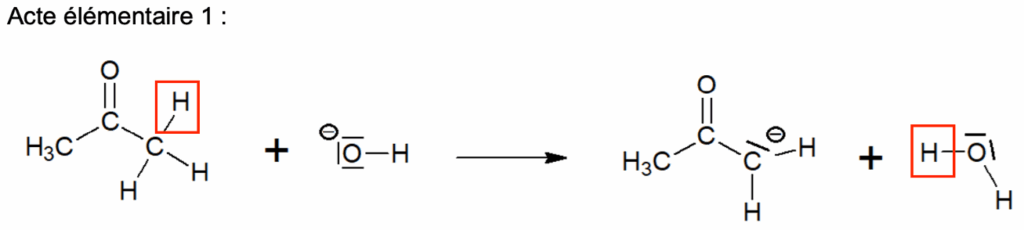
Q4. Sur le document-réponse 1 de L’ANNEXE À RENDRE AVEC LA COPIE, compléter les actes élémentaires 2 et 3 du mécanisme réactionnel en utilisant le formalisme de la flèche courbe.
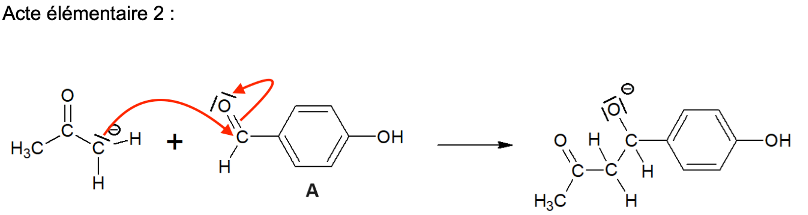
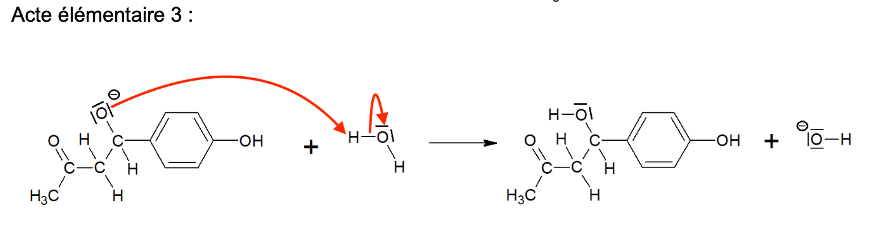
Q5. Préciser la catégorie de réaction (acido-basique, oxydo-réduction, élimination, addition, substitution) de l’acte élémentaire 1 du mécanisme réactionnel donné en annexe.
L’acte élémentaire 1 du mécanisme réactionnel donné en annexe représente un transfert de proton H+ : c’est donc une réaction acido-basique.
Q6. Sachant que la deuxième étape de la séquence réactionnelle (figure 2) est réalisée avec un excès de dihydrogène et que la masse de frambinone obtenue est 𝑚exp = 2,19 g, montrer que la valeur du rendement 𝑟 de la synthèse est proche de 65 %.
Première étape de la séquence réactionnelle.
Calculons les quantités initiales des réactifs :
$n_A=\frac{m_A}{M_A}$
$n_A=\frac{2,50}{122,1}$
$n_A=2,05\times 10^{-2}\ mol$
La une solution aqueuse d’hydroxyde de sodium est ajoutée en excés.
$x_{max1}=\frac{n_A}{1}=\frac{2,0\times 10^{-2}}{1}=2,05\times 10^{-2}\ mol$
$n_B^{th}=x_{max1}=2,05\times 10^{-2}\ mol$
Deuxième étape de la séquence réactionnelle.
$n_B^{th}=x_{max1}=2,05\times 10^{-2}\ mol$
Le dihydrogène est introduit en excès.
${x\prime}_{max1}=\frac{n_B^{th}}{1}=\frac{2,05\times 10^{-2}}{1}=2,05\times 10^{-2}\ mol$
$r=\frac{m_{frambinone}^{exp}}{m_{frambinone}^{th}}$
Avec :
$m_{frambinone}^{th}=n_{frambinone}^{th}\times M_{frambinone}^{th}$
$m_{frambinone}^{th}=x_{max}\times M_{frambinone}^{th}$
$m_{frambinone}^{th}=2,05\times 10^{-2}\times 164,2$
$m_{frambinone}^{th}=3,37\ g$
$r=\frac{m_{frambinone}^{exp}}{m_{frambinone}^{th}}$
$r=\frac{2,19}{3,37}$
$r=0,650$
$r=65,0%$
Ainsi, la valeur du rendement 𝑟 de la synthèse est proche de 65 %.
Partie 2 : Détartrage de la bouilloire.
La préparation de l’infusion à la framboise nécessite au préalable le détartrage de la bouilloire. Plusieurs fabricants d’électroménager recommandent d’utiliser des détartrants à base d’acide lactique ; en plus d’être efficace contre le tartre, cet acide est biodégradable et non corrosif pour les pièces métalliques des appareils électroménagers.
Étude de la solution d’acide lactique
Données :
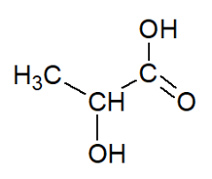
- formule semi-développée de l’acide lactique :
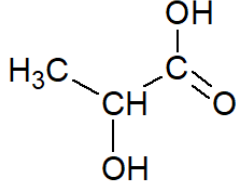
- valeur du p𝐾A à 25°C du couple formé par l’acide lactique et l’ion lactate : 3,86 ;
- électronégativité de quelques atomes : 𝜒(H) = 2,1 ; 𝜒(C) = 2,5 ; 𝜒(O) = 3,5.
Le détartrant à base d’acide lactique est conditionné sous forme liquide dans un petit flacon de 100 mL. La notice d’utilisation indique qu’il faut verser la totalité de son contenu dans le réservoir de la bouilloire et qu’il faut ajouter de l’eau. On prépare ainsi une solution aqueuse d’acide lactique de pH mesuré de valeur égale à 2,1.
Q7. Définir un acide selon Brönsted. Justifier le caractère acide de l’acide lactique.
Un acide est une espèce capable de céder un proton H+.
L’acide lactique possède un groupe COOH capable de céder un proton H+ : l’acide lactique est donc un acide.
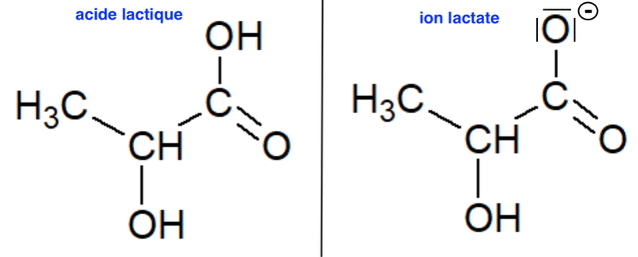
Q8. Représenter le schéma de Lewis de l’ion lactate, base conjuguée de l’acide lactique.
Q9. On note AH la molécule d’acide lactique. Écrire l’équation de la réaction modélisant la transformation chimique entre l’acide lactique et l’eau.
${\rm AH}{(aq)}+H_2O{(aq)}\rightleftarrows A_{(aq)}^-+H_3O_{(aq)}^+$
Q10. Exprimer, à l’équilibre, la constante d’acidité associée à cette réaction.
$K_A=\frac{[A^-]{eq}\times [H_3O^+]{eq}}{[HA]_{eq}\times c_0}$
Q11. À partir d’un diagramme de prédominance, justifier que l’acide lactique prédomine dans la solution détartrante dans la bouilloire.
Diagramme de prédominance :
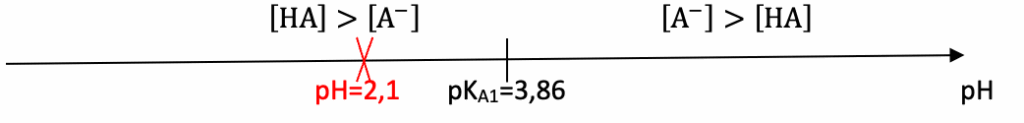
La solution aqueuse d’acide lactique de pH mesuré de valeur égale à 2,1.
Pour pH=2,1 : l’acide lactique est prédominant.
Ainsi, l’acide lactique prédomine dans la solution détartrante dans la bouilloire.
Titrage de la solution d’acide lactique
Au laboratoire, un élève décide de vérifier la concentration en acide lactique de la solution commerciale en réalisant un titrage.
Le document ci-dessous précise quelques informations présentes sur l’étiquette de la solution commerciale d’acide lactique utilisée pour le détartrage.
Étiquette commerciale d’un détartrant à base d’acide lactique.
•Pourcentage (ou titre) massique en acide lactique de la solution : 55 % ;
• Masse molaire de l’acide lactique : 90,08 g⋅mol−1 ;
• Densité du détartrant : 1,25.
Q12. Montrer que, d’après l’étiquette, la concentration en quantité de matière, notée 𝑐com, en acide lactique dans la solution commerciale est 7,6 mol⋅L−1.
Calculons la concentration de la solution commerciale :
$c_{com}=\frac{n_{acide\ lactique}}{V_{Solution}}$
Or
$n_{acide\ lactique}=\frac{m_{acide\ lactique}}{M_{acide\ lactique}}$
Ainsi :
$c_{com}=\frac{n_{acide\ lactique}}{V_{Solution}}=\frac{m_{acide\ lactique}}{M_{acide\ lactique}\times V_{Solution}}$
Or le titre massique (pourcentage) est défini par :
$P_m=\frac{m_{acide\ lactique}}{m_{solution}}$
D’ou
$m_{acide\ lactique}=P_m\times m_{solution}$
Ainsi :
$c_{com}=\frac{m_{acide\ lactique}}{M_{acide\ lactique}\times V_{Solution}}=\frac{P_m\times m_{solution}}{M_{acide\ lactique}\times V_{Solution}}$
Or
$\rho_{solution}=\frac{m_{solution}}{V_{Solution}}$
Ainsi :
$c_{com}=\frac{P_m\times m_{solution}}{M_{acide\ lactique}\times V_{Solution}}=\frac{P_m\times \rho_{solution}}{M_{acide\ lactique}}$
Or
$d=\frac{\rho_{solution}}{\rho_{eau}}$
$\frac{\rho_{solution}}{\rho_{eau}}=d$
$\rho_{solution}=d\times \rho_{eau}$
Ainsi :
$c_{com}=\frac{P_m\times \rho_{solution}}{M_{acide\ lactique}}=\frac{P_m\times d\times \rho_{eau}}{M_{acide\ lactique}}$
$c_{com}=\frac{\frac{55}{100}\times 1,25\times 1,0\times 10^3}{90,08}$
$c_{com}=7,6\ mol.L^{-1}$
Pour réaliser le titrage, l’élève utilise une solution d’hydroxyde de sodium fraichement préparée de concentration 𝑐b = 1,00 × 10−1 mol⋅L−1. Par ailleurs, il ne titre pas directement la solution commerciale de détartrant à base d’acide lactique. Il prépare d’abord une solution, notée Sdiluée, par dilution de la solution commerciale.
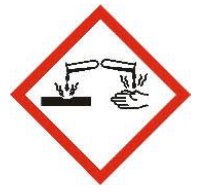
Q13. Nommer les équipements de protection nécessaires pour manipuler en toute sécurité la solution commerciale de détartrant à base d’acide lactique.
L’acide lactique est corrosif (pictogramme de sécurité).
Pour manipuler en toute sécurité la solution commerciale de détartrant à base d’acide lactique, les équipements de protection nécessaires sont :
- Gants
- Lunettes de protection
- Blouse

On souhaite préparer un volume de 200,0 mL de solution Sdiluée en diluant 100 fois la solution commerciale. La verrerie à disposition est la suivante :
- pipettes jaugées de 2,0 mL, 5,0 mL, 20,0 mL ;
- fioles jaugées de 100,0 mL, 200,0 mL, 500,0 mL.
Q14. Choisir en justifiant les deux instruments de verrerie permettant de préparer la solution Sdiluée.
D’après l’énoncé : « On souhaite préparer un volume de 200,0 mL de solution Sdiluée en diluant 100 fois la solution commerciale »
On choisit :
- une fiole jaugée V1=200,0 mL
- une pipette jaugée V0=2,0 mL
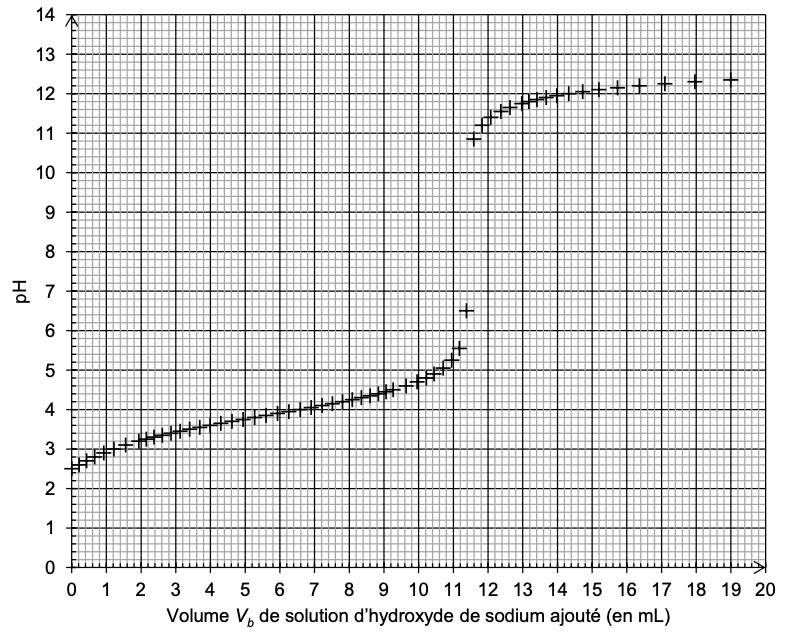
On réalise le titrage avec suivi pH-métrique d’un volume 𝑉a = 15,0 mL de la solution Sdiluée. Le document-réponse 2 de l’annexe représente l’évolution du pH en fonction du volume 𝑉b de solution d’hydroxyde de sodium ajouté de concentration 𝑐b.
Q15. Représenter le schéma légendé du dispositif de titrage.
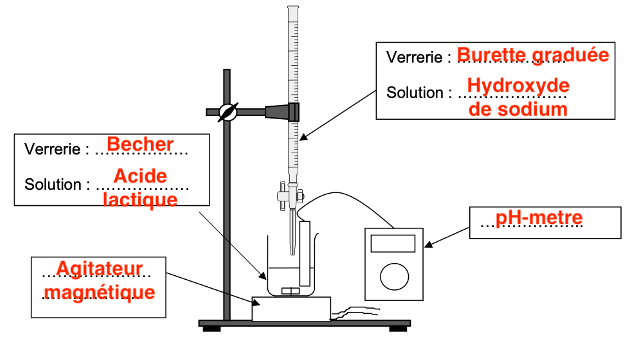
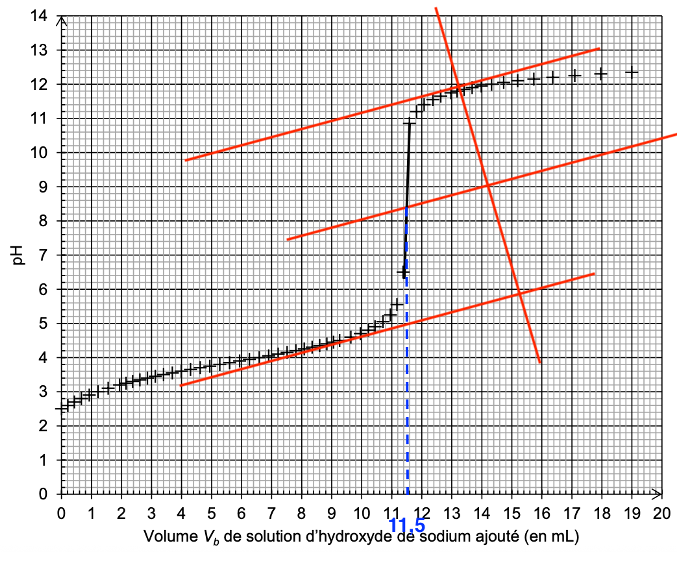
Q16. Déterminer graphiquement sur le document-réponse 2 de L’ANNEXE À RENDRE AVEC LA COPIE, la valeur du volume 𝑉bE de solution d’hydroxyde de sodium versé à l’équivalence.
On détermine graphiquement le volume à l’équivalence avec la méthode des tangentes parallèles :
VbE=11,5 mL
Q17. Exploiter les résultats pour déterminer la concentration en acide lactique de la solution Sdiluée.
Formule semi-développée de l’acide lactique :
Formule brute de l’acide lactique : $C_3H_6O_3(aq)$
A l’équivalence :
$\frac{n_{C_3H_6O_3}^i}{1}=\frac{n_{HO^-}^{eq}}{1}$
$c_{dilue}\times V_A=c_b\times V_{eq}$
$c_{dilue}=\frac{c_b\times V_{eq}}{V_A}$
$c_{dilue}=\frac{1,00\times 10^{-1}\times 11,5\times 10^{-3}}{15,0\times 10^{-3}}$
$c_{dilue}=7,7\times 10^{-2}\ mol.L^{-1}$
Pour comparer le résultat d’une mesure 𝑋mes à une valeur de référence 𝑋ref, on utilise le quotient : $ \dfrac{|X_{mes} – X_{ref}|}{u(X_{mes})}$ où 𝑢(𝑋mes) est l’incertitude-type associée au résultat. On considère que le résultat de la mesure est compatible avec la valeur de référence lorsque le quotient est inférieur ou égal à 2.
La valeur de référence correspond à la valeur de la concentration de la solution commerciale et au cours de ce titrage, on estime que 𝑢(𝑐mes) = 0,34 mol⋅L−1.
Q18. Vérifier la compatibilité entre la valeur de la concentration de la solution commerciale obtenue expérimentalement et la valeur de référence.
D’après le sujet la solution a été diluée 100 fois :
$c=100\times C_{dilue}$
$c=100\times 7,7\times 10^{-2}$
$c=7,7\ mol.L^{-1}$
Pour comparer le résultat d’une mesure 𝑋mes à une valeur de référence 𝑋ref, on utilise le quotient $\frac{\left|x_{mes}-x_{ref}\right|}{u(x)}$ où 𝑢(𝑋mes) est l’incertitude-type associée au résultat. On considère que le résultat de la mesure est compatible avec la valeur de référence lorsque le quotient est inférieur ou égal à 2.
$\frac{\left|x_{mes}-x_{ref}\right|}{u(x)}=\frac{\left|c_{mes}-c_{com}\right|}{u(c_{mes})}=\frac{\left|7,7-7,6\right|}{0,34}=0,3<2$
$\frac{\left|x_{mes}-x_{ref}\right|}{u(x)}<2$ : la valeur de la concentration de la solution commerciale obtenue expérimentalement est en accord avec la valeur de référence.
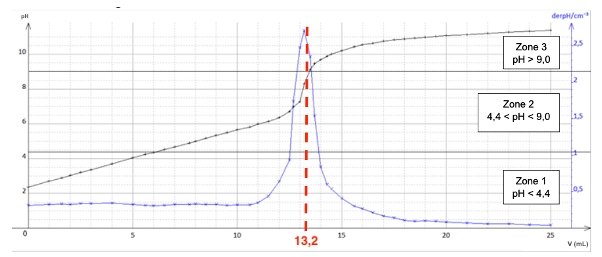
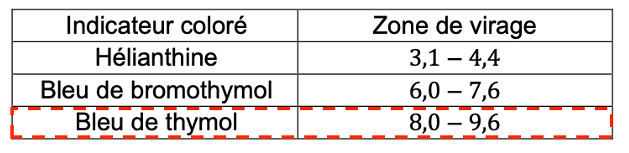
Pour vérifier les résultats obtenus par suivi pH-métrique, l’élève réalise un titrage colorimétrique. Il dispose de trois indicateurs colorés :
| Indicateur coloré | Zone de virage |
| Hélianthine | 3,1 – 4,4 |
| Bleu de bromothymol | 6,0 – 7,6 |
| Bleu de thymol | 8,0 – 9,6 |
Q19. Choisir l’indicateur coloré le plus adapté pour repérer précisément le volume équivalent.
Justifier.
Graphiquement pHeq=8,5.
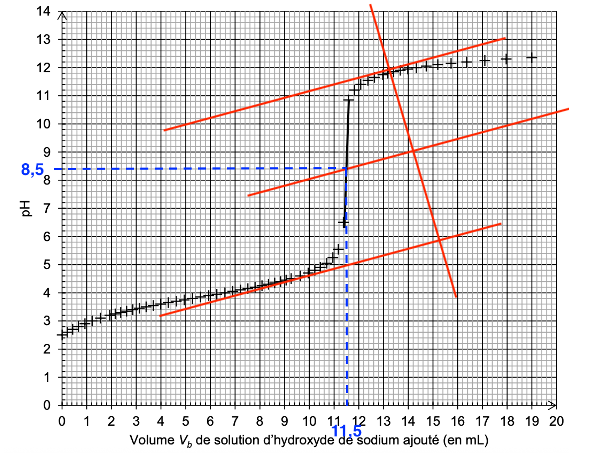
Pour choisir un indicateur coloré, il faut que le pH à l’équivalence soit compris dans sa zone de virage.
Nous choisissons le Bleu de thymol comme indicateur coloré.
ANNEXES À RENDRE AVEC LA COPIE
Document-réponse 1 (exercice 1, question Q4)
Mécanisme réactionnel de l’étape A → B dans la synthèse de la frambinone
Acte élémentaire 1 :
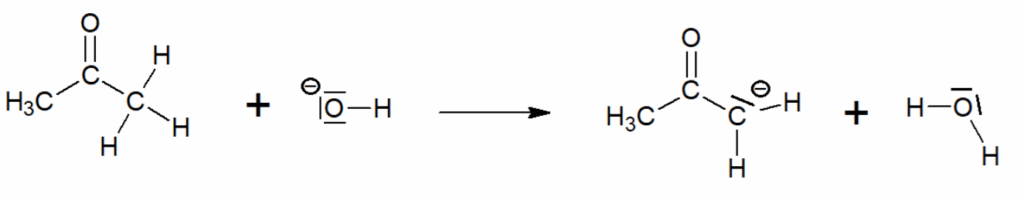
Acte élémentaire 2 :
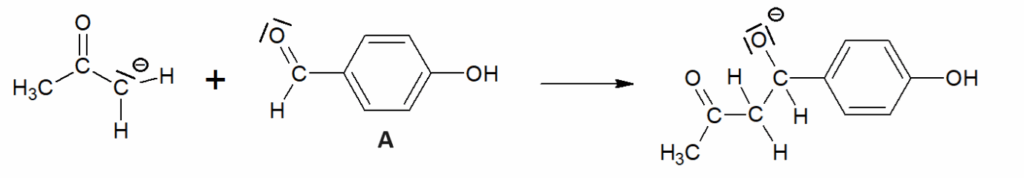
Acte élémentaire 3 :
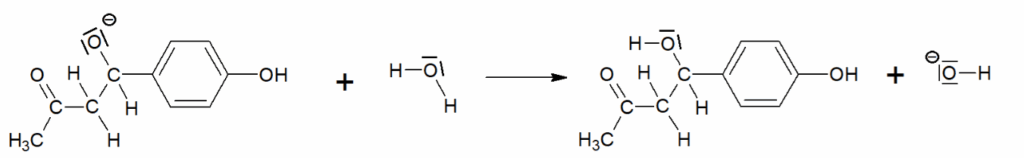
Acte élémentaire 4 :
Document-réponse 2 (exercice 1, question Q16)
Évolution du pH en fonction du volume 𝑉𝑏 de solution d’hydroxyde de sodium ajouté.