Bac Métropole Septembre 2024 Sujet 2
Exercice 2 – (4 points) – Durée 0h42 – Calculatrice autorisée
Sujet n°24-PYCJ2ME3
Sujet et corrigé
Exercice 2 – Traitement contre le varroa (4 points)
Le varroa est un acarien qui s’attaque aux colonies d’abeilles ce qui entraîne un affaiblissement important des jeunes abeilles voire la disparition complète de la colonie si l’invasion de varroas est très importante.
L’apiculteur surveille ses ruches et peut freiner la croissance de la population de varroas grâce à un traitement à base d’acide oxalique. Cependant à trop forte dose, cet acide peut être néfaste pour les abeilles. Le traitement consiste alors à laisser tomber goutte à goutte une solution sucrée d’acide oxalique dans la ruche.
L’objectif de cet exercice est de vérifier qu’une solution d’acide oxalique préparée pour traiter une ruche est conforme aux recommandations d’utilisation.
Données :
- formule brute de l’acide oxalique : C2H2O4 ;
- masse molaire de l’acide oxalique dihydraté (C2H2O4, 2 H2O) : M = 126 g∙mol–1 ;
- pKA des couples acide-base associés à l’acide oxalique, à 25 °C :
- C2H2O4(aq)/C2HO4 –(aq) : pKA1 = 1,3 ;
- C2HO4−(aq)/C2O42−(aq) : pKA2 = 4,3.
- le traitement utilisé contre le varroa nécessite une préparation préalable de la part de l’apiculteur afin de fabriquer la solution sucrée d’acide oxalique. Les recommandations sont les suivantes :
| Masse d’acide oxalique dihydraté pour 1 L de solution sucrée | 30 g | 35 g | 45 g | 60 g |
| Efficacité contre le varroa | Médiocre | Bonne | Bonne | Excellente |
| Tolérance des abeilles | Bien tolérée | Correctement tolérée | Mal tolérée | Très mal tolérée |
D’après le centre suisse des recherches apicoles 2001
À partir d’une solution S commerciale sucrée d’acide oxalique, on prépare une solution S1 en diluant 10 fois la solution S.
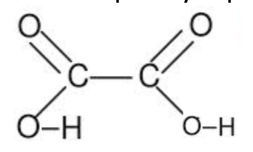
Q1. Proposer une formule développée de la molécule d’acide oxalique sachant qu’elle comporte deux fonctions acide carboxylique.
Elle comporte deux fonctions acide carboxylique : On met COOH pour chaque carbone.
Sachant qu’il n’y a que deux carbones, la formule développée de la molécule d’acide oxalique s’écrit :
Cette formule développée à pour formule brute C2H2O4 qui correspond à celle de l’acide oxalique.
Q2. Rédiger un protocole expérimental permettant de préparer un volume de 100,0 mL de solution S1 à partir de la solution S en justifiant la verrerie choisie.
D’après le sujet : « on prépare une solution S1 en diluant 10 fois la solution S. »
On souhaite diluer 10 fois, ainsi le facteur de dilution est 10 : le volume de la solution fille est 10 fois plus grand que le volume de la solution mère.
Protocole expérimental :
- On prélève le volume Vm=10,0 mL à l’aide d’une pipete jaugée de 10,0 mL
- On introduit Vm=10,0 mL dans une fiole jaugée de volume Vf=100,0 mL
- On complète avec de l’eau distillée jusqu’au trait de jauge et on homogénéise.
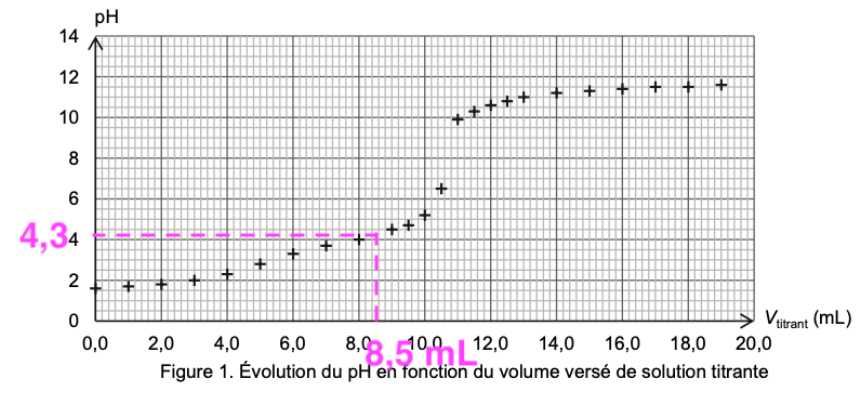
On dose par titrage avec suivi pH-métrique un volume V = 20,0 mL de solution diluée S1 par une solution aqueuse titrante d’hydroxyde de sodium de concentration c = 1,0×10-1 mol∙L-1. La figure 1 ci-dessous présente l’évolution du pH du milieu réactionnel en fonction du volume versé de solution titrante.
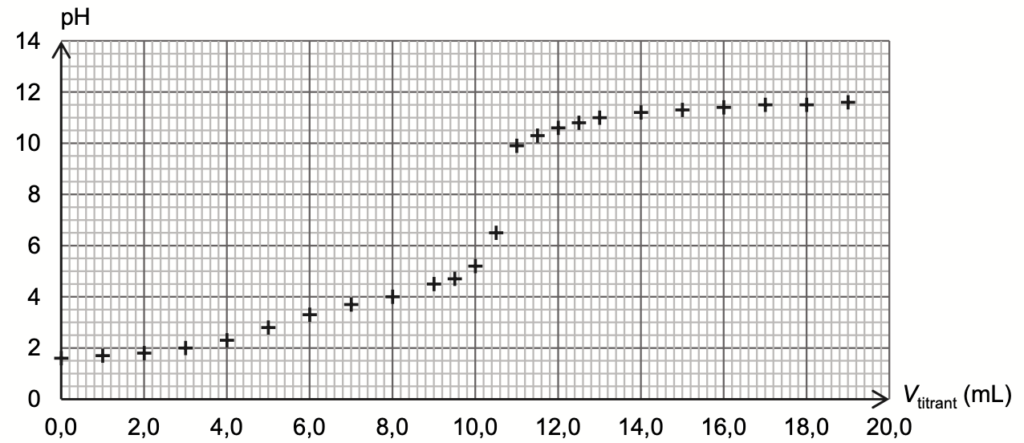
Figure 1. Évolution du pH en fonction du volume versé de solution titrante
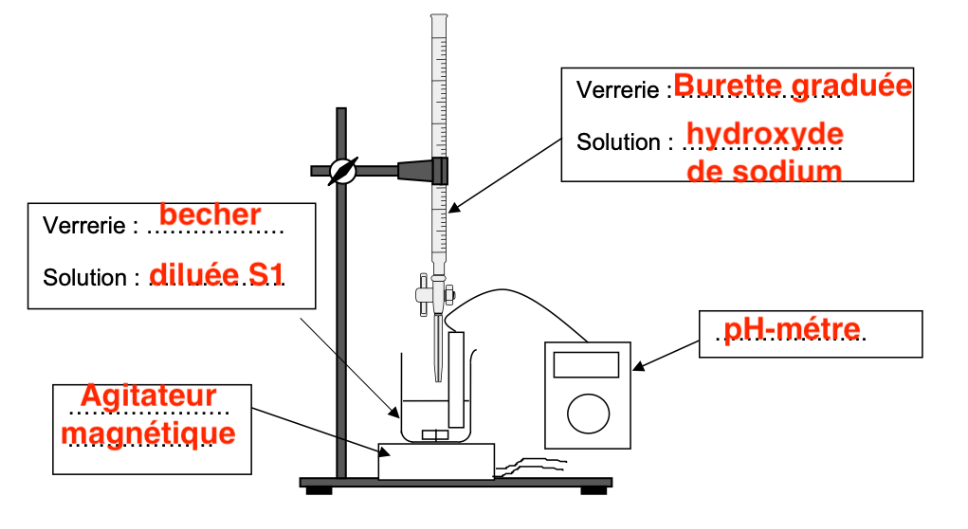
Q3. Schématiser et légender le montage du dosage par titrage avec suivi pH-métrique de la solution diluée S1 par une solution aqueuse d’hydroxyde de sodium.
Q4. À l’aide d’un diagramme de prédominance, déterminer, en justifiant, la forme acide-base associée à l’acide oxalique qui est présente en plus grande quantité dans la solution diluée S1 avant l’ajout de la solution aqueuse d’hydroxyde de sodium.
Avant l’ajout de la solution aqueuse d’hydroxyde de sodium, lorsque Vtitrant=0,0 mL, pH=1,5
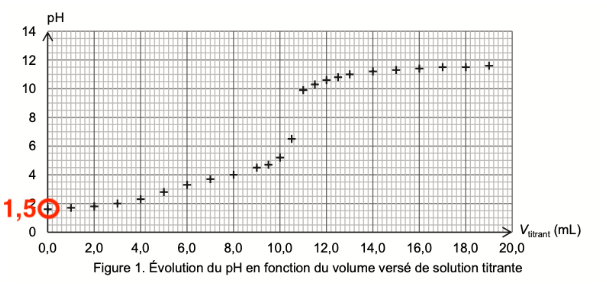
Diagramme de prédominance :
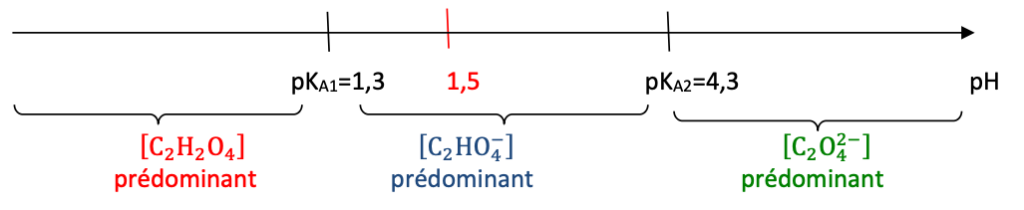
D’après le diagramme de prédominance, pour un $pH=1,5$ , l’espèce prédominante est $C_2HO_4^-$.
Ainsi, la forme acide-base associée à l’acide oxalique qui est présente en plus grande quantité dans la solution diluée S1 avant l’ajout de la solution aqueuse d’hydroxyde de sodium est $C_2HO_4^-$.
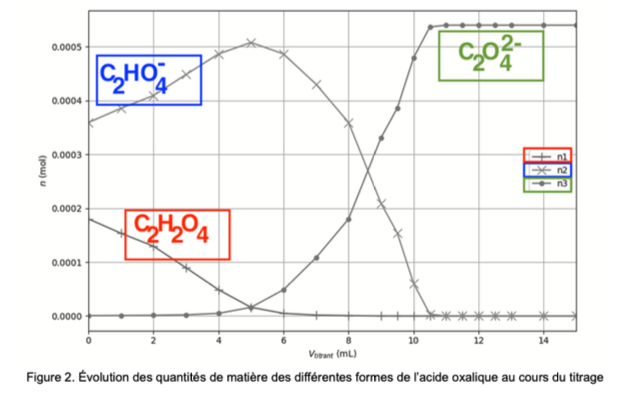
À l’aide d’un programme informatique, il est possible de tracer l’évolution des quantités de matière des différentes formes de l’acide oxalique au cours du titrage. La figure 2 ci-dessous en propose une représentation.
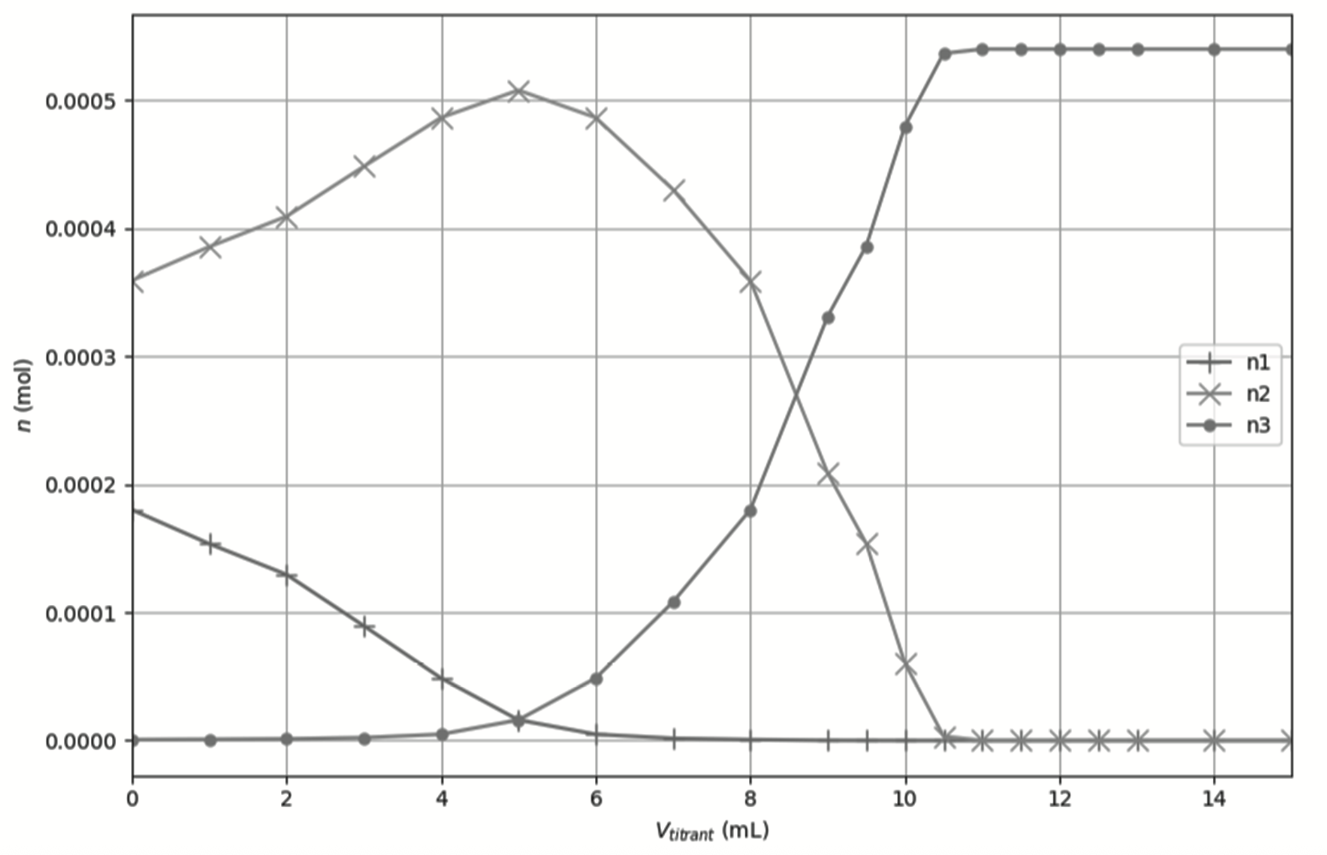
Figure 2. Évolution des quantités de matière des différentes formes de l’acide oxalique au cours du titrage
Q5. Attribuer, en justifiant, chaque courbe n1, n2 et n3 à la forme acido-basique correspondante de l’acide oxalique.
La forme acide-base associée à l’acide oxalique qui est présente en plus grande quantité dans la solution diluée S1 avant l’ajout de la solution aqueuse d’hydroxyde de sodium est $C_2HO_4^-$ (Question Q4).
Ainsi, n2 est la quantité de matière de $C_2HO_4^-$.
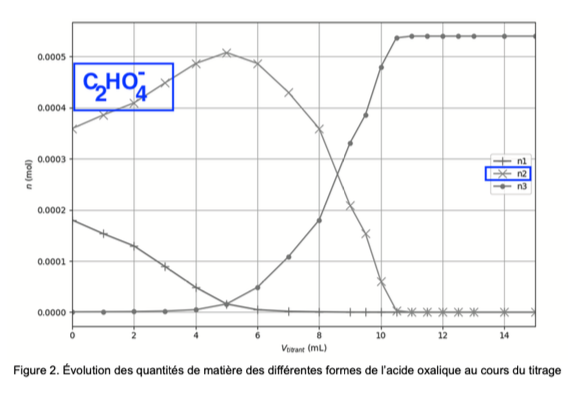
Lorsque Vtitrant=14,0 mL, pH=11
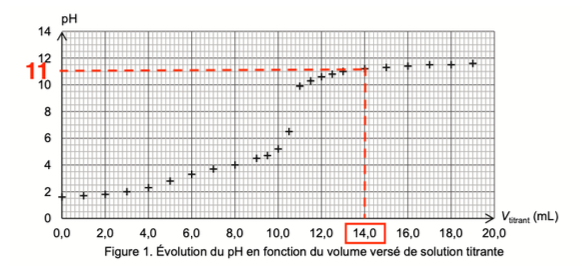
Diagramme de prédominance :
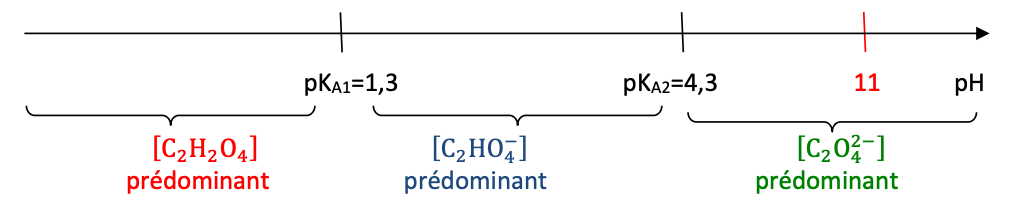
D’après le diagramme de prédominance, pour un $pH=11$ , l’espèce prédominante est $C_2O_4^{2-}$.
Ainsi, la forme acide-base associée à l’acide oxalique qui est présente en plus grande quantité dans la solution diluée S1 après un ajout de $14,0mL$ de la solution aqueuse d’hydroxyde de sodium est $C_2O_4^{2-}$ (Question Q4).
Ainsi, n3 est la quantité de matière de $C_2O_4^{2-}$.
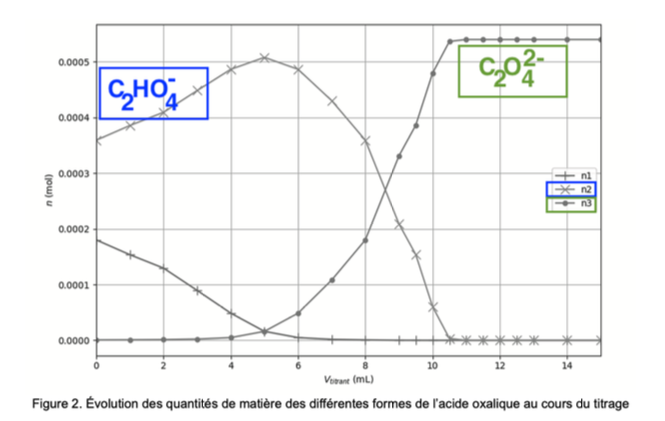
Par déduction n1 est la quantité de matière de $C_2H_2O_4$.
Q6. En utilisant les figures 1 et 2, expliquer comment on peut retrouver la valeur du pKA2.
$pKA2$ est obtenu lorsque la concentration des espèces $C_2HO_4^-$ et $C_2O_4^{2-}$ sont égales soit à l’intersection de n2 et n3.
On lit sur la figure 2 : $Vtitrant=8,5\ mL$
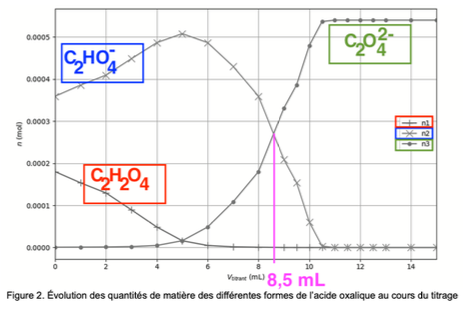
Pour Vtitrant=8,5 mL, pH=4,3
Ainsi : pKA2 = 4,3 .
La transformation chimique mise en jeu lors du titrage est modélisée par la réaction d’équation :
C2H2O4(aq) + 2 OH–(aq) → C2O42–(aq) + 2 H2O(𝘗)
Q7. Exploiter les résultats du titrage pour déterminer la valeur de la concentration en masse en acide oxalique dihydraté de la solution commerciale S. Commenter en vous appuyant sur les recommandations d’utilisation de l’acide oxalique pour un traitement des ruches par goutte à goutte.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche suivie est évaluée et nécessite donc d’être correctement présentée.
$C_2H_2O_4\left(aq\right)+2{\rm HO}^-\left(aq\right)\longrightarrow C_2O_4^{2-}\left(aq\right)+2H_2O\left(l\right)$
A l’équivalence, les réactifs sont introduits dans les proportions stœchiométriques :
$\frac{n_1\left(C_2H_2O_4\left(aq\right)\right)}{1}=\frac{n_{eq}\left({\rm HO}^-\left(aq\right)\right)}{2}$
$C_{acide,\ dilue}\times V=\frac{c\times V_e}{2}$
$C_{acide,\ dilue}=\frac{c\times V_e}{2\times V}$
$C_{acide,\ dilue}=\frac{1,0\times {10}^{-1}\times 10,6\times {10}^{-3}}{2\times 20,0\times {10}^{-3}}$
$C_{acide,\ dilue}=2,7\times {10}^{-2}\ mol\cdot L^{-1}$
D’après le sujet : « on prépare une solution S1 en diluant 10 fois la solution S. »
Le facteur de dilution est 10 : la concentration de la solution mère est 10 fois plus grande que la concentration de la solution fille.
$C_{acide}=10\times C_{acide,\ dilue}$
$C_{acide}=10\times 2,7\times {10}^{-2}$
$C_{acide}=2,7\times {10}^{-1}\ mol\cdot L^{-1}$
Calculons la concentration massique :
$C_m=C_{acide}\times M$
$C_m=2,7\times {10}^{-1}\times 126$
$C_m=34\ g.L^{-1}$
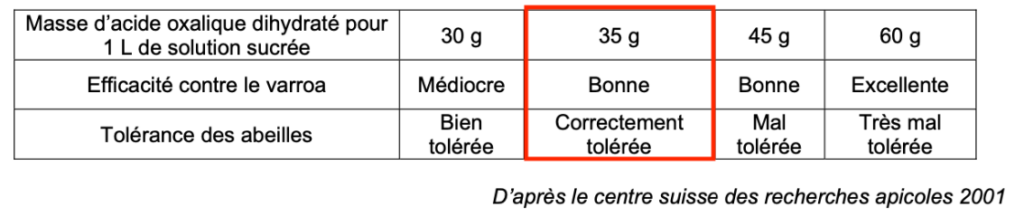
Ce résultat est conforme aux recommandations car très proche de $35\ g.L^{-1}$. Ainsi, l’efficacité contre le varroa est bonne et est correctement toléré par les abeilles.
