Bac Amérique du nord 2023 Sujet 2
Exercice 3 – (4 points) – Durée 0h42 – Calculatrice autorisée
Sujet n°23-PYCJ2AN1
Sujet et corrigé
EXERCICE 3 : FABRICATION DE LA BIÈRE (4 POINTS)
De l’orge, de l’eau, du houblon et de la levure… Ces quatre ingrédients permettent de fabriquer des milliers de types de bières différentes.
Le schéma ci-dessous représente de manière simplifiée quelques étapes du processus de fabrication de la bière.
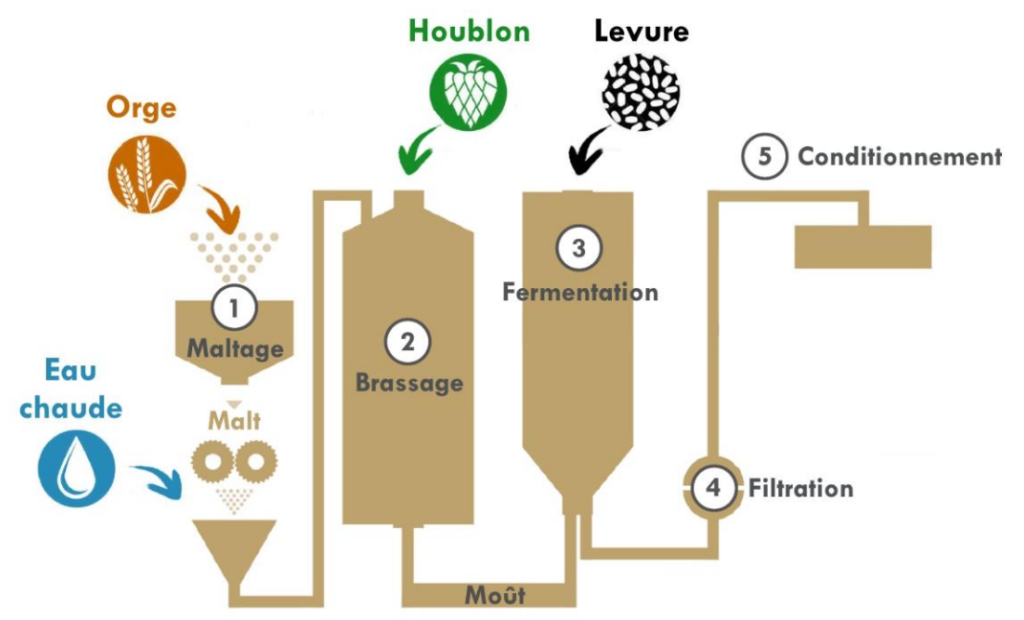
L’objectif de cet exercice est d’étudier certaines des transformations chimiques mises en jeu dans la fabrication de la bière.
A. Hydrolyse de l’amidon
L’orge concassée est la matière première dans la fabrication de la bière. L’orge constitue une source d’amidon qui est un polymère de formule :
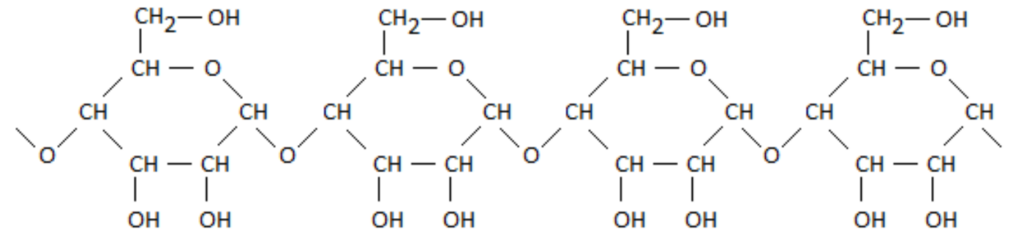
Après une étape appelée maltage, l’amidon est plongé dans de l’eau chaude, ce qui rend actives des enzymes sensibles à la température. Ces enzymes sont des catalyseurs d’une transformation chimique appelée hydrolyse de l’amidon. Au cours de cette transformation, l’amidon se transforme en glucose, de formule C6H12O6.
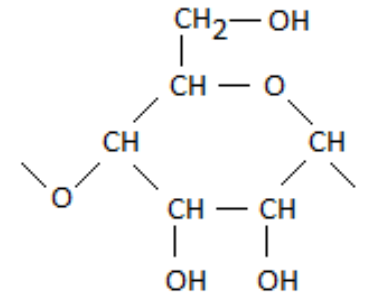
Q.1. À l’aide de la formule de l’amidon, identifier le motif de ce polymère.
Motif de ce polymère :
La capacité des enzymes à dégrader l’amidon est influencée par la concentration en ions oxonium [H3O+].
L’activité des enzymes est optimale lorsque 1,3×10-6 ≤ [H3O+] ≤ 3,2×10-6 mol∙L-1. Lors d’un contrôle, on mesure un pH = 5,6.
Q.2. Vérifier que l’activité des enzymes est optimale.
$$\left[H_3O^+\right]=c^0\times {10}^{-pH}$$
$$\left[H_3O^+\right]=1,0\times {10}^{-5,6}$$
$$\left[H_3O^+\right]=2,5\times {10}^{-6}\ mol.L^{-1}$$
La concentration en ions oxonium est comprise entre 1,3×10-6 et 3,2×10-6 mol∙L-1 : L’activité des enzymes est donc optimale.
B. Fermentation alcoolique
Lors du brassage, on ajoute du houblon au liquide obtenu précédemment contenant des sucres, en particulier le glucose. Le houblon libère des espèces chimiques qui confèrent à la bière son amertume et son arôme. Le mélange ainsi obtenu est appelé « moût ».
À l’issue du brassage, on ajoute la levure qui entraîne une transformation appelée fermentation. Celle-ci produit de l’éthanol et du dioxyde de carbone à partir des sucres. En particulier, le glucose est transformé en éthanol. Cette transformation est modélisée par l’équation de réaction suivante :
C6H12O6(aq) → 2 C2H5OH(aq) + 2 CO2(g)
Données :
- masse molaire atomique en g·mol-1 : MH = 1,0 ; MC = 12,0 ; MO = 16,0 ;
- constante des gaz parfaits : R = 8,314 J·K-1·mol-1 ;
- conversion entre les échelles de température : T(K) = θ(°C) + 273 ;
- pression atmosphérique : patm = 1,013×105 Pa.
On considère un « moût » de concentration en masse de glucose égale à 92,7 g·L-1.
On fait l’hypothèse que la température de fermentation est égale à 20 °C, que la transformation est totale et que le gaz produit se comporte comme un gaz parfait.
Q.3. Déterminer la valeur du volume de dioxyde de carbone gazeux maximum dégagé à la pression atmosphérique au cours de la fermentation d’un volume V = 1,0 L de moût.
La démarche suivie devra être clairement exposée et les calculs devront être détaillés.
$$PV=nRT$$
$$PV_{{\rm CO}2}=n_{{\rm CO}2}RT$$
$$V_{{\rm CO}2}=\frac{n_{{\rm CO}_2}RT}{P}$$
C6H12O6(aq) → 2 C2H5OH(aq) + 2 CO2(g)
D’après l’équation :
$$\frac{n_{{\rm CO}2}}{2}=\frac{n_{C_6H_{12}O_6}}{1}$$
$$n_{{\rm CO}2}=2n{C_6H_{12}O_6}$$
D’ou
$$V_{{\rm CO}2}=\frac{2n_{C_6H_{12}O_6}RT}{P}$$
Or
$$n_{C_6H_{12}O_6}=\frac{m_{C_6H_{12}O_6}}{M_{C_6H_{12}O_6}}$$
Or
$$C_m=\frac{m_{C_6H_{12}O_6}}{V_{sol}}$$
$$m_{C_6H_{12}O_6}=C_m\times V_{sol}$$
$$n_{C_6H_{12}O_6}=\frac{C_m\times V_{sol}}{M_{C_6H_{12}O_6}}$$
D’ou
$$V_{{\rm CO}2}=\frac{2\frac{C_m\times V{sol}}{M_{C_6H_{12}O_6}}RT}{P}$$
$$V_{{\rm CO}2}=\frac{2C_m\times V{sol}RT}{P\times M_{C_6H_{12}O_6}}$$
$$V_{{\rm CO}2}=\frac{2\times 92,7\times 1,0\times 8,314\times \left(20+273\right)}{1,013{\times 10}^5\times \left(6\times 12,0+12\times 1,0+6\times 16,0\right)}$$
$$V_{{\rm CO}2}=2,47{\times 10}^{-2}m^3$$
$$V_{{\rm CO}2}=2,47{\times 10}^{-2}{\times 10}^3L$$
$$V_{{\rm CO}_2}=24,7\ L$$
En réalité, le volume de gaz dégagé est de 22 L.
Q.4. Proposer une hypothèse permettant d’expliquer cette différence.
En réalité, le volume de gaz dégagé est de 22 L.
Cette différence peut s’expliquer par :
- Le fait que nous avons considéré que le gaz produit se comporte comme un gaz parfait peut être il ne l’est pas
- Nous avons considéré que tout le gaz s’est échappé, peut être qu’une partie est dissout dans la solution.
- Nous avons considéré que la réaction est totale, peut être est elle limitée.
C. Saveur de la bière
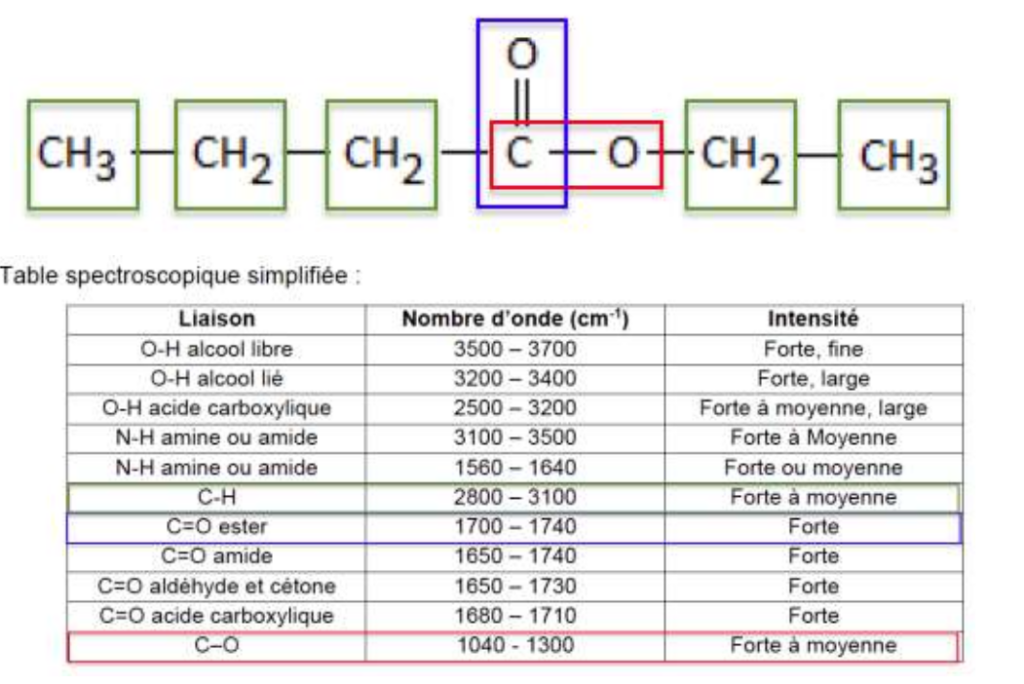
Le houblon renferme de nombreuses espèces chimiques organiques qui réagissent avec l’éthanol issu de la fermentation pour donner naissance à une large variété d’espèces chimiques odorantes. Parmi eux, le butanoate d’éthyle, de formule brute C6H12O2, apporte à la bière une agréable saveur de fruit tropical.
La formule semi-développée du butanoate d’éthyle est la suivante :
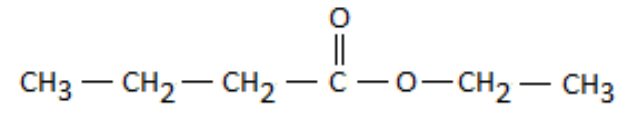
Après avoir isolé un composé présent dans un échantillon de bière, un laboratoire d’analyse réalise un spectre infrarouge de ce composé :
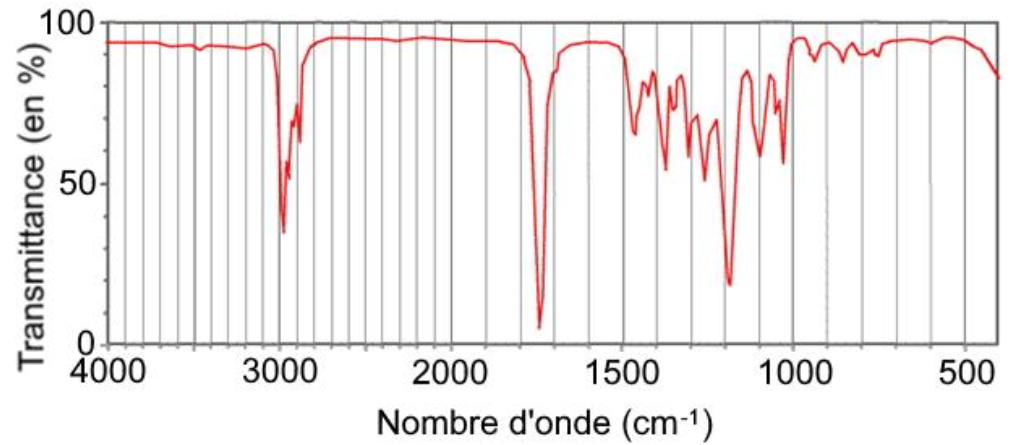
d’après www.unice.fr.
Table spectroscopique simplifiée :
| Liaison | Nombre d’onde (cm-1) | Intensité |
| O-H alcool libre | 3500 – 3700 | Forte, fine |
| O-H alcool lié | 3200 – 3400 | Forte, large |
| O-H acide carboxylique | 2500 – 3200 | Forte à moyenne, large |
| N-H amine ou amide | 3100 – 3500 | Forte à Moyenne |
| N-H amine ou amide | 1560 – 1640 | Forte ou moyenne |
| C-H | 2800 – 3100 | Forte à moyenne |
| C=O ester | 1700 – 1740 | Forte |
| C=O amide | 1650 – 1740 | Forte |
| C=O aldéhyde et cétone | 1650 – 1730 | Forte |
| C=O acide carboxylique | 1680 – 1710 | Forte |
| C–O | 1040 – 1300 | Forte à moyenne |
Q.5. Vérifier que le spectre infrarouge obtenu peut correspondre au butanoate d’éthyle.
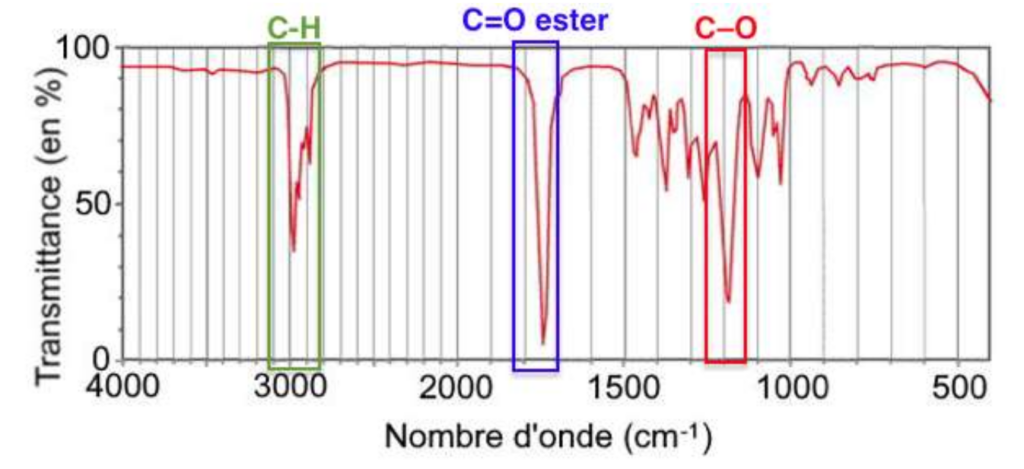
Le spectre infrarouge comporte des bandes d’absorption correspondant aux liaisons :
- C-O
- C=O (ester)
- C-H
Ainsi, le spectre infrarouge obtenu peut correspondre au butanoate d’éthyle.
Q.6. Expliquer si ce spectre infrarouge suffit ou pas pour affirmer que le composé isolé est le butanoate d’éthyle.
Le spectre infrarouge indique que le produit est un ester mais il ne suffit pas pour affirmer que le composé isolé est le butanoate d’éthyle.
