Bac La Réunion 2023 Sujet 2
Exercice 2 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°23-PYCJ2LR1
Sujet et corrigé
EXERCICE II – L’ACIDE BUTYRIQUE (5 points)
Tous les automnes, sur l’avenue Pasteur à Rouen, une odeur intense très désagréable apparaît, dérangeant les étudiants des facultés à proximité ainsi que les riverains. Les responsables : des arbres plantés en 2001, des ginkgos biloba. La variété femelle produit chaque automne des ovules contenant des acides gras, dont l’acide butyrique responsable de cette mauvaise odeur.
Les parties A et B sont indépendantes.
Données :
- Caractéristiques d’espèces chimiques :
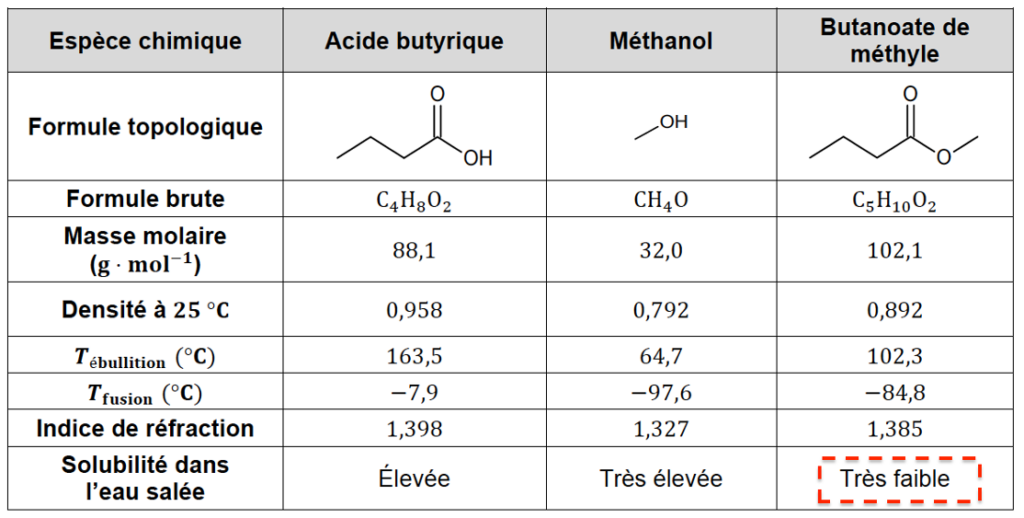
| Espèce chimique | Acide butyrique | Méthanol | Butanoate de méthyle |
| Formule topologique | 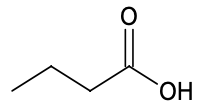 | 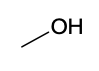 | 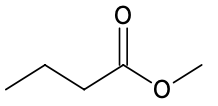 |
| Formule brute | C4H8O2 | CH4O | C5H10O2 |
| Masse molaire (𝐠 ⋅ 𝐦𝐨𝐥−𝟏) | 88,1 | 32,0 | 102,1 |
| Densité à 𝟐𝟓 °𝐂 | 0,958 | 0,792 | 0,892 |
| 𝑻é𝐛𝐮𝐥𝐥𝐢𝐭𝐢𝐨𝐧 (°𝐂) | 163,5 | 64,7 | 102,3 |
| 𝑻𝐟𝐮𝐬𝐢𝐨𝐧 (°𝐂) | −7,9 | −97,6 | −84,8 |
| Indice de réfraction | 1,398 | 1,327 | 1,385 |
| Solubilité dans l’eau salée | Élevée | Très élevée | Très faible |
- Densité de l’eau salée : 1,03
- Table de données de spectroscopie IR :
| Famille | Liaison | Nombre d’onde (𝐜𝐦−𝟏) |
| Cétone | C = O | 1705 − 1725 |
| Aldéhyde | Ctri − H C = O | 2700 − 3000 1720 − 1740 |
| Acide carboxylique | O − H C = O | 2500 − 3200 1740 − 1800 |
| Ester | Ctri − H C = O | 2700 − 3000 1730 − 1750 |
| Alcool | O − Hlié O − Hlibre | 3200 − 3450 3600 − 3700 |
PARTIE A : Étude d’une solution aqueuse d’acide butyrique
On notera dans cette partie, pour simplifier, l’acide butyrique AH(aq) et sa base conjuguée A−(aq).
On considère un volume 𝑉 = 100 mL d’une solution d’acide butyrique de concentration en quantité de matière 𝐶 = 1,0 × 10−4 mol ⋅ L−1. La mesure du 𝑝𝐻 de la solution donne 𝑝𝐻 = 4,5.
L’acide butyrique réagit avec l’eau selon l’équation de réaction suivante :
AH(aq) + H2O(l) ⇄ A−(aq) + H3O+(aq)
A.1. Donner l’expression du taux d’avancement final 𝜏 de la réaction étudiée en fonction de l’avancement final 𝑥𝑓 et de l’avancement maximal 𝑥max.
$$\tau=\frac{x_f}{x_{max}}$$
A.2. Exprimer l’avancement maximal 𝑥max en fonction de 𝐶 et 𝑉.
| $$\rm AH_{(aq)}$$ | $$\ H_2O_{(l)}$$ | $$\rightleftarrows\ A^-{(aq)}\ $$ | $$+\ H_3O^+{(aq)}$$ | |
| Etat initial | $$CV$$ | Solvant | 0 | 0 |
| Etat intermédiaire | $$CV-x$$ | Solvant | x | x |
| Etat final | $$CV-x_{max}=0$$ | Solvant | $x_f$ | $x_f$ |
$$-x_{max}=-CV$$
$$x_{max}=CV$$
A.3. Exprimer la valeur de l’avancement final 𝑥𝑓 en fonction du 𝑝𝐻 et de 𝑉.
$$x_f=n_{H_3O^+}=\left[H_3O^+\right]\times V$$
$$x_f=\left[H_3O^+\right]\times V$$
$$x_f=c^0\times {10}^{-pH}\times V$$
A.4. Calculer le taux d’avancement final 𝜏 et justifier que l’acide butyrique est un acide faible.
$$\tau=\frac{x_f}{x_{max}}$$
$$\tau=\frac{c^0\times {10}^{-pH}\times V}{CV}$$
$$\tau=\frac{c^0\times {10}^{-pH}}{C}$$
$$\tau=\frac{1,0\times {10}^{-4,5}}{1,0\times {10}^{-4}}$$
$$\tau=0,32$$
$\tau\neq 1$ : la réaction entre l’acide butyrique et l’eau est limitée : l’acide butyrique est donc un acide faible.
On montre que les concentrations en quantité de matière à l’équilibre peuvent s’exprimer de la manière suivante :
[AH(aq) ]eq = 𝐶 × (1 − 𝜏) pour l’acide butyrique,
[A−(aq)]eq = 𝐶 × 𝜏 pour sa base conjuguée.
A.5.1. Exprimer la constante d’acidité 𝐾𝐴 de la réaction en fonction de 𝜏 et 𝐶.
$$K_A=\frac{\left[A^-\right]{eq}\times \left[H_3O^+\right]{eq}}{\left[AH\right]_{eq}\times c^0}$$
D’après l’énoncé :
$$\left[AH\right]{eq}=C\left(1-\tau\right)$$
$$\left[A^-\right]{eq}=C\times \tau$$
$$K_A=\frac{C\times \tau\times \left[H_3O^+\right]{eq}}{C\left(1-\tau\right)\times c^0}$$
$$K_A=\frac{\tau\times \left[H_3O^+\right]{eq}}{\left(1-\tau\right)\times c^0}$$
Or
$$\tau=\frac{c^0\times {10}^{-pH}}{C}$$
et
$$\left[H_3O^+\right]{eq}=c^0\times {10}^{-pH}$$
Donc
$$\tau=\frac{\left[H_3O^+\right]{eq}}{C}$$
$$\frac{\left[H_3O^+\right]{eq}}{C}=\tau$$
$$\left[H_3O^+\right]{eq}=\tau\times C$$
Ainsi :
$$K_A=\frac{\tau\times \left[H_3O^+\right]_{eq}}{\left(1-\tau\right)\times c^0}$$
$$K_A=\frac{\tau\times \tau\times C}{\left(1-\tau\right)\times c^0}$$
$$K_A=\frac{\tau^2\times C}{\left(1-\tau\right)\times c^0}$$
A.5.2. En déduire la valeur du 𝑝𝐾A de l’acide butyrique.
$${\rm pK}_A=-log\left(K_A\right)$$
$${\rm pK}_A=-log\left(\frac{\tau^2\times C}{\left(1-\tau\right)\times c^0}\right)$$
$${\rm pK}_A=-log\left(\frac{{0,32}^2\times 1,0\times {10}^{-4}}{\left(1-0,32\right)\times 1,0}\right)$$
$${\rm pK}_A=4,8$$
PARTIE B : Synthèse d’un ester à l’odeur de pomme à partir de l’acide butyrique
Même si l’acide butyrique possède une odeur désagréable, certains esters issus de cet acide ont une odeur agréable souvent fruitée. C’est le cas du butanoate de méthyle qui a une odeur de pomme.
La synthèse du butanoate de méthyle est réalisée selon le protocole suivant :
- verser dans un ballon à fond rond 20 mL de méthanol, 20 mL d’acide butyrique et 4 mL d’acide sulfurique concentré ;
- ajouter quelques grains de pierre ponce ;
- chauffer à reflux pendant 15 min ;
- laisser refroidir en enlevant le chauffe-ballon ;
- verser le contenu du ballon dans un bécher contenant 40 mL de solution saturée en NaCl(s) ;
- transvaser ensuite dans l’ampoule à décanter et laisser décanter ;
- séparer les deux phases ;
- recueillir la phase organique et la sécher sur du sulfate de magnésium anhydre ;
- purifier l’ester obtenu par distillation.
L’équation de réaction de la synthèse est la suivante :
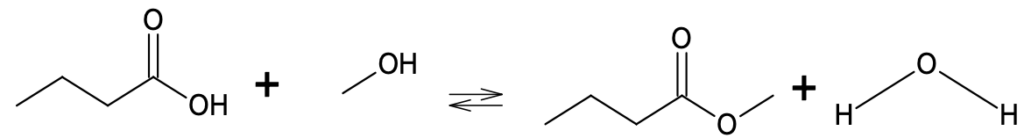
B.1. Donner la formule semi-développée de l’acide butyrique.
Formule semi-développée de l’acide butyrique : $CH_3-CH_2-CH_2-COOH$
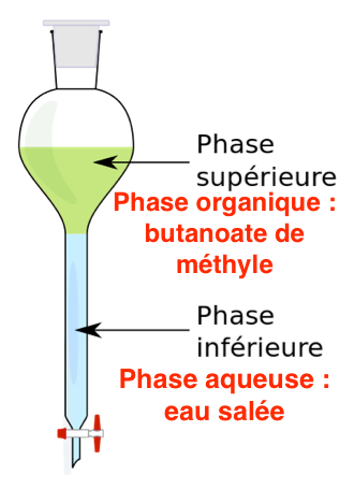
B.2. Préciser la phase dans laquelle se trouve le butanoate de méthyle.
Le butanoate de méthyle est très peu soluble dans l’eau salée. Le butanoate de méthyle se trouve donc dans la phase organique
B.3. Schématiser l’ampoule à décanter après décantation. Justifier la position des deux phases.
La densité de l’eau salée : 1,03 est supérieure à la densité du Butanoate de méthyle 0,892.
L’eau salée est en bas et le Butanoate de méthyle en haut.
Le spectre du produit synthétisé est fourni figure 1 :
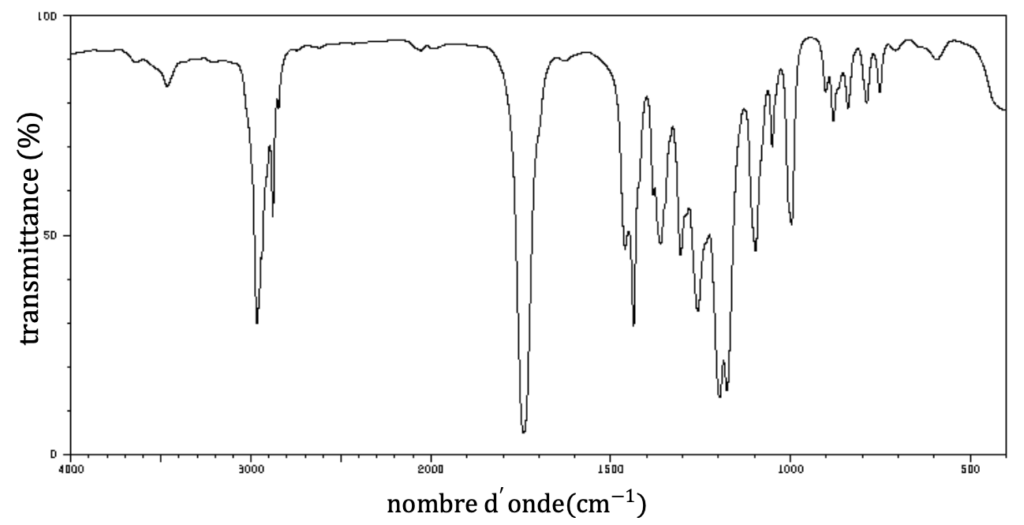
Figure 1 : Spectre IR du produit synthétisé
Source : d’après Spectral Database for Organic Compounds SDBS
B.4. Attribuer un groupe d’atomes à chacun des pics entre les valeurs de nombre d’onde comprises entre 1600 cm−1 et 4000 cm−1. Indiquer si ce spectre IR est compatible avec le produit de réaction attendu.
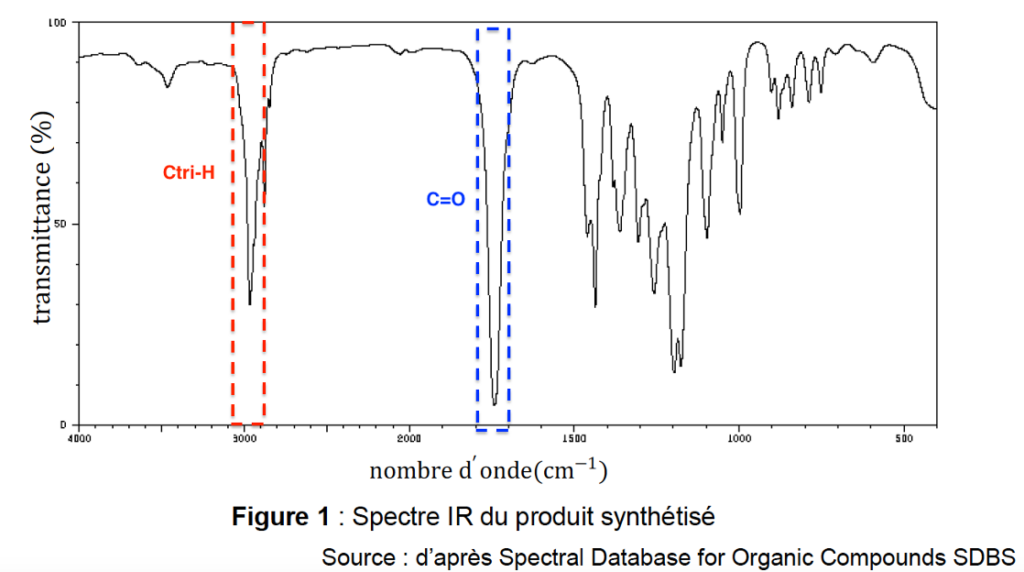

- Pic à 3000 cm−1 :Ctri-H Nombre d’onde entre 2700 − 3000 cm−1
- Pic à 1740 cm−1: C=O Nombre d’onde entre 1730 – 1750 cm−1
Ce spectre IR est celui d’un ester, il est compatible avec le produit de réaction attendu qui est un ester.
