Bac Liban 2023 Sujet 1
Exercice 2 – (5 points) – Durée 1h45 – Calculatrice autorisée
Sujet n°23-PYCJ1LI1
Sujet et corrigé
EXERCICE 2 : UN ASSOUPLISSANT « FAIT MAISON » (5 POINTS)
Les produits ménagers commerciaux sont une source importante de déchets qu’on cherche à réduire.
Dans cet exercice, on s’intéresse à la fabrication d’un assouplissant « fait maison » à partir de vinaigre commercial et de bicarbonate de soude.
A. Vinaigre commercial
Un vinaigre commercial à 8 % est une solution aqueuse d’acide éthanoïque de formule CH3COOH contenant 8 g d’acide éthanoïque pour 100 g de solution. Pour vérifier la valeur de ce pourcentage, appelé pourcentage massique, on réalise un dosage par titrage à l’aide d’un suivi pH-métrique. La solution commerciale est diluée 10 fois. On obtient une solution notée S dont on prélève 10,0 mL que l’on titre par une solution aqueuse d’hydroxyde de sodium de concentration CB égale à 0,10 mol·L-1.
Données :
- masse volumique à T = 20 °C du vinaigre commercial : ρ = 1,01 g·mL-1 ;
- couple acide éthanoïque / ion éthanoate : pKA (CH3COOH(aq)/ CH3COO–(aq)) = 4,8 à 25 °C ;
- couple eau / ion hydroxyde : H2O(ℓ)/ HO–(aq) ;
- masses molaires atomiques : MH = 1,0 g·mol-1 ; MC = 12,0 g·mol-1 ; MO = 16,0 g·mol-1.
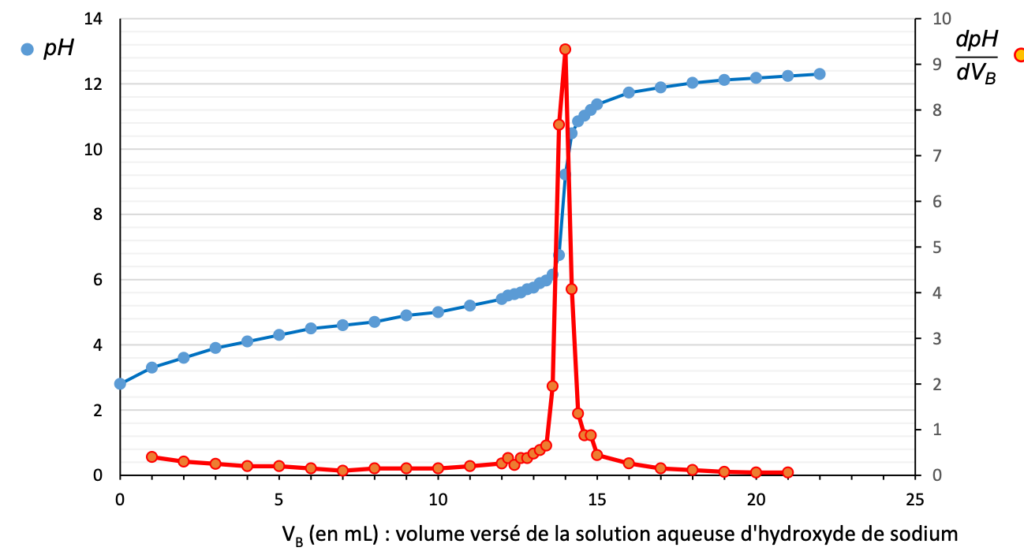
Figure 1. courbe de suivi pH-métrique du titrage de la solution S
Q.1. Indiquer la verrerie nécessaire pour préparer 50,0 mL de solution S par dilution du vinaigre commercial.
D’après l’énoncé : « La solution commerciale est diluée 10 fois. »
$$F=\frac{V_1}{V_0}$$
$$V_0=\frac{V_1}{F}$$
$$V_0=\frac{50,0\times{10}^{-3}}{10}$$
$$V_0=5,00\times{10}^{-3}L$$
$$V_0=5,00\ mL$$
On choisit :
une fiole jaugée V1=50,0 mL
une pipette jaugée V0=5,00 mL
Q.12 Écrire l’équation de la réaction support du titrage entre l’ion hydroxyde et l’acide éthanoïque.
$$\ {CH_3COOH}{(aq)}\ +\ HO{(aq)}^-\ \ \rightarrow CH_3COO_{(aq)}^-+\ H_2O_{(\ell)}$$
Q.3. À l’aide de la figure 1, montrer que la concentration Ccom en quantité de matière d’acide éthanoïque apportée dans le vinaigre commercial est égale à 1,4 mol·L-1.
A l’équivalence :
$$\frac{n_{CH_3COOH}^i}{1}=\frac{n_{HO^-}^{eq}}{1}$$
$$C_SV_S=C_BV_{eq}$$
$$C_S=\frac{C_BV_{eq}}{V_S}$$
On détermine graphiquement $V_{eq}$ qui se repère au maximum de la courbe $\frac{dpH}{dV}$ :
$$V_{eq}=14,0\ mL$$
$$C_S=\frac{C_BV_{eq}}{V_S}$$
$$C_S=\frac{0,10\times14,0\times{10}^{-3}}{10,0\times{10}^{-3}}$$
$$C_S=0,14\ mol{.L}^{-1}$$
Or d’après l’énoncé : « La solution commerciale est diluée 10 fois. »
$$C_{com}=10\times C_S$$
$$C_{com}=10\times0,14$$
$$C_{com}=1,40\ mol{.L}^{-1}$$
Q.4. En déduire le pourcentage massique en acide éthanoïque obtenu expérimentalement et le comparer à la valeur annoncée par le fabricant, sachant que l’incertitude-type du titrage sur le pourcentage massique vaut u(%) = 0,2 %.
On souhaite revenir maintenant à l’étude de la solution S de départ de concentration en quantité de matière notée CS. On va déterminer le pH de cette solution S.
L’équation de la réaction modélisant la transformation entre l’acide éthanoïque et l’eau est :
CH3COOH(aq) + H2O(l) ⇌ CH3COO–(aq) + H3O+(aq)
Q.5. En utilisant éventuellement un tableau d’avancement, montrer qu’à l’équilibre la constante d’acidité du couple CH3COOH(aq)/ CH3COO–(aq) peut s’exprimer de la manière suivante :
relation 1 : $$K_A=\frac{[H_3O^+]{\mathrm{eq}}^{2}}{(C_S-[H_3O^+]{\mathrm{eq}})\times c^\circ}$$ avec c° = 1 mol·L-1
| $$\ {CH_3COOH}{(aq)}\ $$ | $$+H_2O{(l)}\ $$ | $$\rightleftarrows\ {CH_3COO}{(aq)}^-$$ | $$+{H_3O}{(aq)}^+$$ | |
| État initial | $$C_S \times V$$ | Solvant | 0 | 0 |
| État intermédiaire | $$C_S \times V-x$$ | Solvant | x | x |
| État final | $$C_S \times V-x_{eq}$$ | Solvant | $x_{eq}$ | $x_{eq}$ |
$$K_A=\frac{[CH_3COO^-]{eq}\times[H_3O^+]{eq}}{[CH_3COOH]_{eq}\times c^0}$$
$$[CH_3COO^-]{eq}=\frac{x{eq}}{V}$$
$$\left[H_3O^+\right]{eq}=\frac{x{eq}}{V}$$
$$[CH_3COOH]{eq}=\frac{C_SV-x{eq}}{V}=C_S-\frac{x_{eq}}{V}$$
Ainsi :
$$K_A=\frac{\frac{x_{eq}}{V}\times\frac{x_{eq}}{V}}{\left(C_S-\frac{x_{eq}}{V}\right)\times c^0}$$
Or
$$\frac{x_{eq}}{V}=\left[H_3O^+\right]{eq}$$
$$K_A=\frac{\left[H_3O^+\right]{eq}\times\left[H_3O^+\right]{eq}}{\left(C_S-\left[H_3O^+\right]{eq}\right)\times c^0}$$
$$K_A=\frac{{\left[H_3O^+\right]{eq}}^2}{\left(C_S-\left[H_3O^+\right]{eq}\right)\times c^0}$$
La relation 1 peut aussi s’écrire :
$$[H_3O^+]{\mathrm{eq}}^{2}+K_A\times c^\circ\times[H_3O^+]{\mathrm{eq}}-K_A\times C_S\times c^\circ=0$$
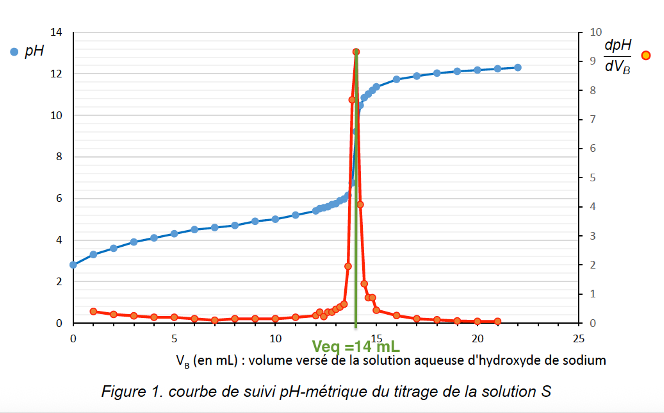
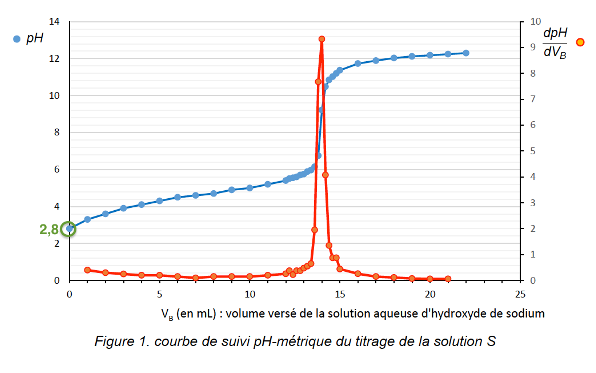
Q.6. En déduire la valeur du pH de la solution diluée S et montrer qu’elle est cohérente avec celle lue sur la courbe de titrage.
$${\left[H_3O^+\right]{eq}}^2+K_A\times c^0\times\left[H_3O^+\right]{eq}-K_A\times C_S\times c^0=0$$
$$K_A={10}^{-pK_A}={10}^{-4,8}$$
$$C_S=0,14\ mol{.L}^{-1}$$ (Question Q3.)
$$c^0=1\ mol{.L}^{-1}$$
$${\left[H_3O^+\right]{eq}}^2+{10}^{-4,8}\times1\times\left[H_3O^+\right]{eq}-{10}^{-4,8}\times0,14\times1=0$$
$${\left[H_3O^+\right]{eq}}^2+1,6\times{10}^{-5}\times\left[H_3O^+\right]{eq}-2,2\times{10}^{-6}=0$$
$$\Delta=b^2-4ac$$
$$\Delta=\left(1,6\times{10}^{-5}\right)^2-4\times1\times\left(-2,2\times{10}^{-6}\right)$$
$$\Delta=8,8\times{10}^{-6}$$
$$\left[H_3O^+\right]{eq1}=\frac{-1,6\times{10}^{-5}+\sqrt{8,8\times{10}^{-6}}}{2\times1}$$
$$\left[H_3O^+\right]{eq1}=1,5\times{10}^{-3}mol{.L}^{-1}$$
$$\left[H_3O^+\right]{eq2}=\frac{-1,6\times{10}^{-5}-\sqrt{8,8\times{10}^{-6}}}{2\times1}$$
$$\left[H_3O^+\right]{eq2}=-1,5\times{10}^{-3}mol{.L}^{-1}$$
On ne garde que la valeur positive car la concentration est positive :
$$\left[H_3O^+\right]{eq}=1,5\times{10}^{-3}mol{.L}^{-1}$$
$$pH=-log\left(\frac{\left[H_3O^+\right]{eq}}{c^0}\right)$$
$$pH=-log\left(\frac{1,5\times{10}^{-3}}{1}\right)$$
$$pH=2,8$$
Sur la courbe de titrage la valeur du pH de la solution diluée S est lue lorsque le titrage n’a pas débuté pour VB=0 mL : pH=2,8
La valeur du pH de la solution diluée S est cohérente avec celle lue sur la courbe de titrage.
B. Bicarbonate de soude
Le bicarbonate de soude acheté dans le commerce est un solide aussi appelé hydrogénocarbonate de sodium, de formule NaHCO3. C’est un ingrédient de base de nombreux cosmétiques ou produits ménagers « faits maison ».
On peut l’associer au vinaigre commercial afin de réaliser une solution d’assouplissant pour le linge. Une recette possible est la suivante :
- Verser deux cuillères à soupe de bicarbonate de soude.
- Ajouter 300 mL de vinaigre commercial. Attention à la réaction effervescente : verser doucement.
- Ajouter 300 mL d’eau tiède.
- Une fois la transformation chimique terminée, compléter avec de l’eau pour obtenir 1 L de produit. Ajouter quelques gouttes d’huile essentielle de votre choix.
Données :
- couple acide éthanoïque / ion éthanoate : pKA (CH3COOH(aq)/ CH3COO–(aq)) = 4,8 ;
- couple dioxyde de carbone aqueux / ion hydrogénocarbonate : pKA (CO2(g),H2O(ℓ)/ HCO3– (aq)) = 6,4 ;
- couple ion hydrogénocarbonate / ion carbonate : pKA (HCO3– (aq) / CO32-(aq)) = 10,3.
Dans les conditions de la recette, le bicarbonate de soude est introduit en large excès.
Lorsque la concentration maximale en dioxyde de carbone dissous dans l’eau est atteinte, celui-ci s’échappe de la solution sous forme gazeuse.
Q.7. Expliquer l’effervescence observée après l’ajout du vinaigre. Une équation de réaction est attendue.
Réaction entre l’hydrogénocarbonate $HCO_{3(aq)}^-$ et le vinaigre ${CH_3COOH}{(aq)}$
$$\ {CH_3COOH}{(aq)}\ +\ HCO_{3(aq)}^-\ \ \rightarrow CH_3COO_{(aq)}^-+CO_{2(g)}+\ H_2O_{(\ell)}$$
La réaction produit du dioxyde de carbone gazeux $CO_{2(g)}$ responsable de l’effervescence observée après l’ajout du vinaigre.
Le calcaire, de formule CaCO3, contribue à diminuer progressivement les espaces entre les fibres textiles, lorsqu’il est présent en grande quantité. Il réduit ainsi la souplesse du tissu. Les fibres deviennent rigides et la surface perd de sa douceur initiale. Pour l’éviter, il faut faire en sorte que calcaire ne précipite pas et donc éviter la présence d’ions carbonate CO32- et d’ions calcium Ca2+ libres en grande quantité. D’ailleurs, dans un assouplissant, des espèces chimiques anioniques telles que l’ion éthanoate CH3COO– peuvent « capter » des ions calcium.
L’ajout d’assouplissant permet d’obtenir une eau de rinçage dont le pH vaut environ 8.
Q.8. Indiquer l’espèce chimique prédominante parmi celles des couples HCO3– (aq) / CO32-(aq) et CO2(g),H2O(ℓ)/ HCO3– (aq) dans l’eau de rinçage. Indiquer également celle qui prédomine au sein du couple CH3COOH(aq)/ CH3COO–(aq). Justifier.
Diagramme de prédominance des couples HCO3– (aq) / CO32-(aq) et CO2(g),H2O(ℓ)/ HCO3– (aq)
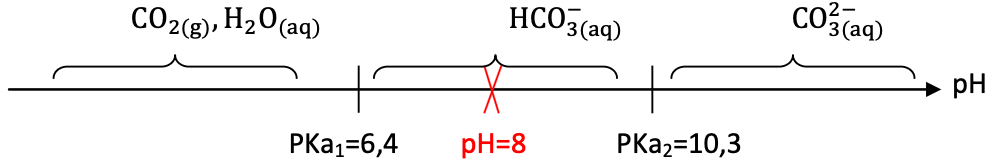
Pour pH=8 , HCO3– (aq) est prédominant.
Diagramme de prédominance du couple CH3COOH(aq)/ CH3COO–(aq)
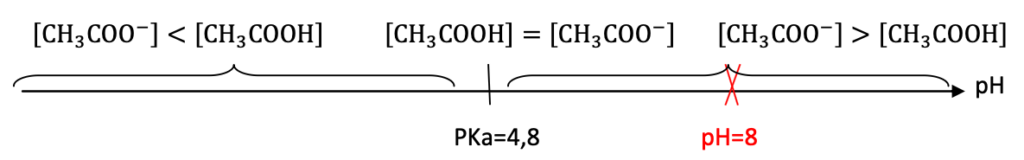
Pour pH=8 : CH3COO–(aq) est prédominant
Q.9. En déduire comment l’assouplissant joue son rôle.
D’après le texte : « Le calcaire, de formule CaCO3, contribue à diminuer progressivement les espaces entre les fibres textiles. Pour l’éviter, il faut éviter la présence d’ions carbonate CO32- et d’ions calcium Ca2+. Des espèces chimiques anioniques telles que l’ion éthanoate CH3COO–( peuvent « capter » des ions calcium. »
Dans l’eau de rinçage, pour pH=8 : HCO3– (aq) et CH3COO–( sont prédominants.
Ainsi, d’une part l’assouplissant évite la présence d’ions carbonate CO32-car HCO3– prédomine et d’autre part les ions éthanoate CH3COO–« captent » des ions calcium Ca2+ .
