Bac Liban 2023 Sujet 2
Exercice 3 – (4 points) – Durée 0h43 – Calculatrice autorisée
Sujet n°23-PYCJ2LI1
Sujet et corrigé
Exercice 3 : préparation du chlorure de tertiobutyle (4 points)
Les halogénoalcanes sont des espèces chimiques très réactives et très utilisées comme agents de synthèse. Les halogénoalcanes existants peu à l’état naturel, la grande majorité doit être synthétisée.
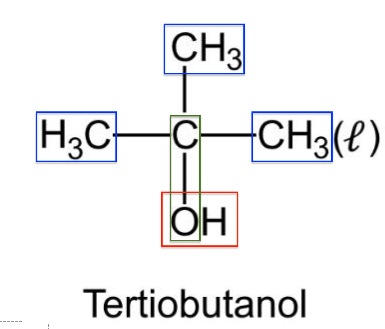
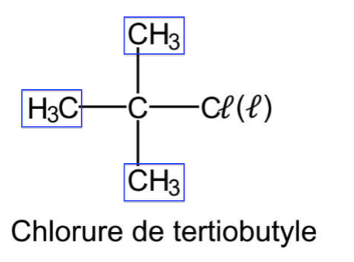
On s’intéresse à la préparation du chlorure de tertiobutyle (ou 2-chloro-2-méthylpropane) à partir du tertiobutanol (ou 2-méthylpropan-2-ol).
En effet, le tertiobutanol réagit avec de l’acide chlorhydrique pour former le chlorure de tertiobutyle et de l’eau selon la réaction d’équation :
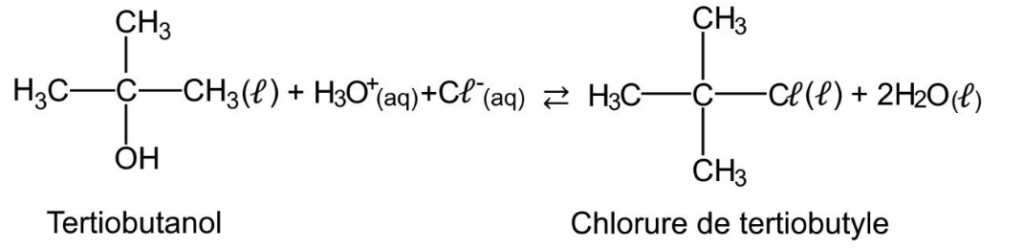
Données :
| M (g·mol–1) | Température d’ébullition (°C) | Température de fusion (°C) | Densité d | Miscibilité à l’eau | |
| Tertiobutanol | 74,0 | 83 | 26 | 0,775 | oui |
| Chlorure de tertiobutyle | 92,5 | 52 | -25 | 0,851 | non |
- acide chlorhydrique commercial concentré HCℓ(aq) :
- pourcentage massique : w = 37 %
- densité à 20 °C : d = 1,19
- masse molaire de l’acide chlorhydrique : M = 36,5 g·mol-1 ;
- masse volumique de l’eau à 20 °C : reau = 1,00 × 103 g·L-1 ;
- couples acide/base : CO2,H2O(aq) / HCO3−(aq) ; HCO3−(aq)/ CO32−(aq) ; H3O+(aq) / H2O(l) ; H2O(l) / HO−(aq) .
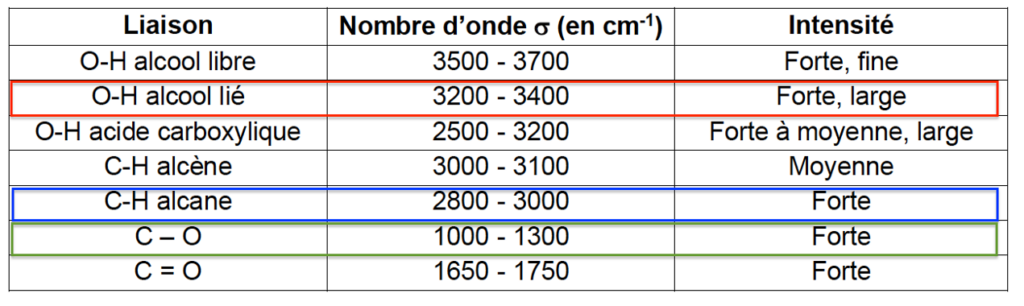
- extrait d’une table de spectroscopie infrarouge :
| Liaison | Nombre d’onde σ (en cm-1) | Intensité |
| O-H alcool libre | 3500 – 3700 | Forte, fine |
| O-H alcool lié | 3200 – 3400 | Forte, large |
| O-H acide carboxylique | 2500 – 3200 | Forte à moyenne, large |
| C-H alcène | 3000 – 3100 | Moyenne |
| C-H alcane | 2800 – 3000 | Forte |
| C – O | 1000 – 1300 | Forte |
| C = O | 1650 – 1750 | Forte |
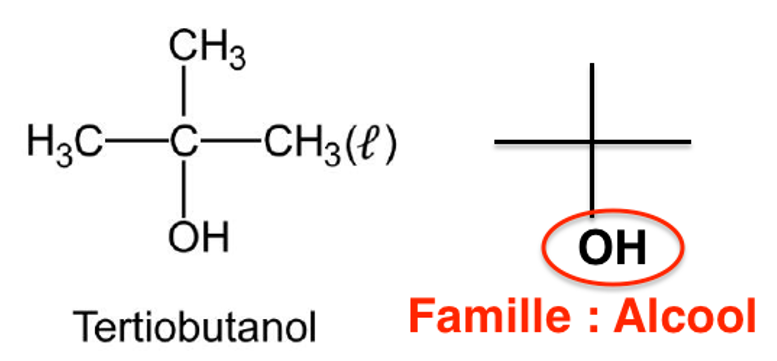
Q.1. Représenter la formule topologique du tertiobutanol. Entourer le groupe caractéristique et nommer la famille fonctionnelle correspondante.
À partir d’acide chlorhydrique commercial concentré à 37 % en masse, on prépare un volume V = 250,0 mL d’une solution d’acide chlorhydrique S à la concentration C = 2,4 mol·L-1.
Q.2. Présenter la démarche à mettre en œuvre pour préparer la solution S, en indiquant la verrerie utilisée parmi la liste suivante :
- Béchers : 50 mL ; 100 mL ; 250 mL
- Éprouvettes graduées : 50 mL ; 100 mL ; 250 mL ; 500 mL
- Pipettes jaugées de 5,0 mL ;10,0 mL ; 20,0 mL ; 50,0 mL
- Fioles jaugées de 50,0 mL ; 100,0 mL ; 250,0 mL ; 500,0 mL
Calculons la concentration $C_0$ de la solution mère d’acide chlorhydrique commercial concentré à 37 % en masse :
$$
C_0=\frac{n_{acide}}{V_{Solution}}
$$
Or
$$
n_{acide}=\frac{m_{acide}}{M_{acide}}
$$
Ainsi :
$$
C_0=\frac{n_{acide}}{V_{Solution}}=\frac{m_{acide}}{M_{acide}\times V_{Solution}}
$$
Or le pourcentage est défini par :
$$
w=\frac{m_{acide}}{m_{solution}}
$$
D’ou
$$
m_{acide}=w\times m_{solution}
$$
Ainsi :
$$
C_0=\frac{m_{acide}}{M_{acide}\times V_{Solution}}=\frac{w\times m_{solution}}{M_{acide}\times V_{Solution}}
$$
Or
$$
\rho_{solution}=\frac{m_{solution}}{V_{Solution}}
$$
Ainsi :
$$
C_0=\frac{w\times m_{solution}}{M_{acide}\times V_{Solution}}=\frac{w\times\rho_{solution}}{M_{acide}}
$$
Or
$$
d_{solution}=\frac{\rho_{solution}}{\rho_{eau}}
$$
$$
\rho_{solution}=d_{solution}\times\rho_{eau}
$$
$$
C_0=\frac{w\times\rho_{solution}}{M_{acide}}=\frac{w\times d_{solution}\times\rho_{eau}}{M_{acide}}
$$
$$
C_0=\frac{w\times d_{solution}\times\rho_{eau}}{M_{acide}}
$$
$$
C_0=\frac{\frac{37}{100}\times1,19\times1,00\times{10}^3}{36,5}
$$
$$
C_0=12\ mol.L^{-1}
$$
Lors d’une dilution la quantité de matière se conserve :
$$
n_0=n
$$
$$
C_0\times V_0=C\times V
$$
$$
V_0=\frac{C\times V}{C_0}
$$
$$
V_0=\frac{2,4\times250\times{10}^{-3}}{12}
$$
$$
V_0=5,0\times{10}^{-2}\ L
$$
$$
V_0=50\times{10}^{-3}\ L
$$
$$
V_0=50\ \ mL
$$
Protocole de dilution :
On verse la solution mère dans un bécher de 100 mL
On prélève 50,0 mL de la solution mère à l’aide d’une pipette jaugée de 50,0 mL
On verse ce prélèvement dans la fiole jaugée de 250,0 mL.
On complète avec de l’eau distillée jusqu’au trait de jauge
On homogénéise
Verrerie utilisée :
bécher de 100 mL
pipette jaugée de 50,0 mL
fiole jaugée de 250,0 mL.
Protocole de synthèse du chlorure de tertiobutyle à partir du tertiobutanol :
Étape 1 : dans un erlenmeyer de 250 mL, introduire successivement une masse mA = 5,00 g de tertiobutanol, préalablement fondu au bain-marie et un volume V = 100 mL d’acide chlorhydrique S à une concentration C = 2,4 mol·L-1, réactif en excès. Boucher et porter sous agitation magnétique pendant 10 minutes.
Étape 2 : introduire le mélange dans une ampoule à décanter. Effectuer un premier lavage en introduisant, dans l’ampoule à décanter, 150 mL d’une solution aqueuse d’hydrogénocarbonate de sodium Na+(aq) + HCO3−(aq). Agiter en dégazant le contenu de l’ampoule, laisser décanter et séparer la phase aqueuse. Effectuer un second lavage de la phase organique en ajoutant 25 mL d’eau déminéralisée. Agiter, laisser décanter et recueillir la phase organique dans un erlenmeyer bien sec.
Étape 3 : sécher la phase organique avec du chlorure de calcium anhydre. Filtrer et récupérer le filtrat dans un ballon de 100 mL. Effectuer une distillation afin de recueillir le chlorure de tertiobutyle pur.
Étape 4 : identifier le chlorure de tertiobutyle obtenu par spectroscopie infra-rouge.
Le premier lavage, à l’aide de la solution aqueuse d’hydrogénocarbonate de sodium, permet d’éliminer les ions oxonium.
Q.3. Écrire l’équation de la réaction acide-base qui modélise la transformation chimique ayant lieu dans l’ampoule à décanter (étape 2) et préciser le nom du gaz formé.
Étape 2 : en introduisant, une solution aqueuse d’hydrogénocarbonate de sodium Na+(aq) + HCO3−(aq).
L’acide chlorhydrique réagit donc avec HCO3−(aq).
Couples :
$CO_2,H_2O\left(aq\right)/HCO_3^-\left(aq\right)$
$H_3O^+\left(aq\right)/H_2O$
$$
H_3O^+\left(aq\right)+HCO_3^-\left(aq\right)\rightleftarrows H_2O\left(l\right)+CO_2,H_2O\left(aq\right)
$$
Le gaz formé est le CO2 : dioxyde de carbone.
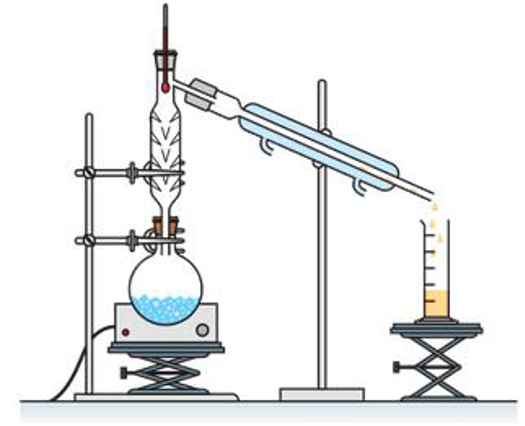
Q.4. Parmi les montages ci-après, indiquer celui utilisé pour purifier le chlorure de tertiobutyle par distillation.
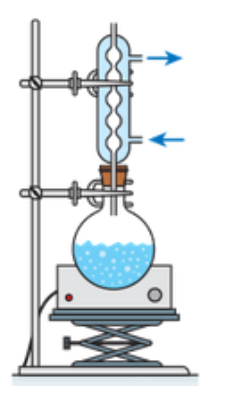 |  | 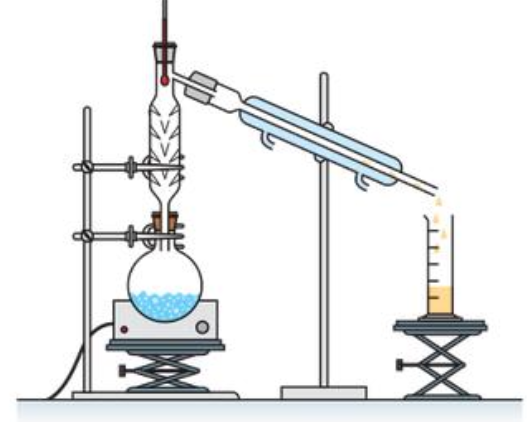 |
| Montage A | Montage B | Montage C |
Distillation : Montage C
Q.5. La figure 1 fournit les spectres IR du tertiobutanol et du chlorure de tertiobutyle. Attribuer chaque spectre à une espèce chimique en explicitant le raisonnement.
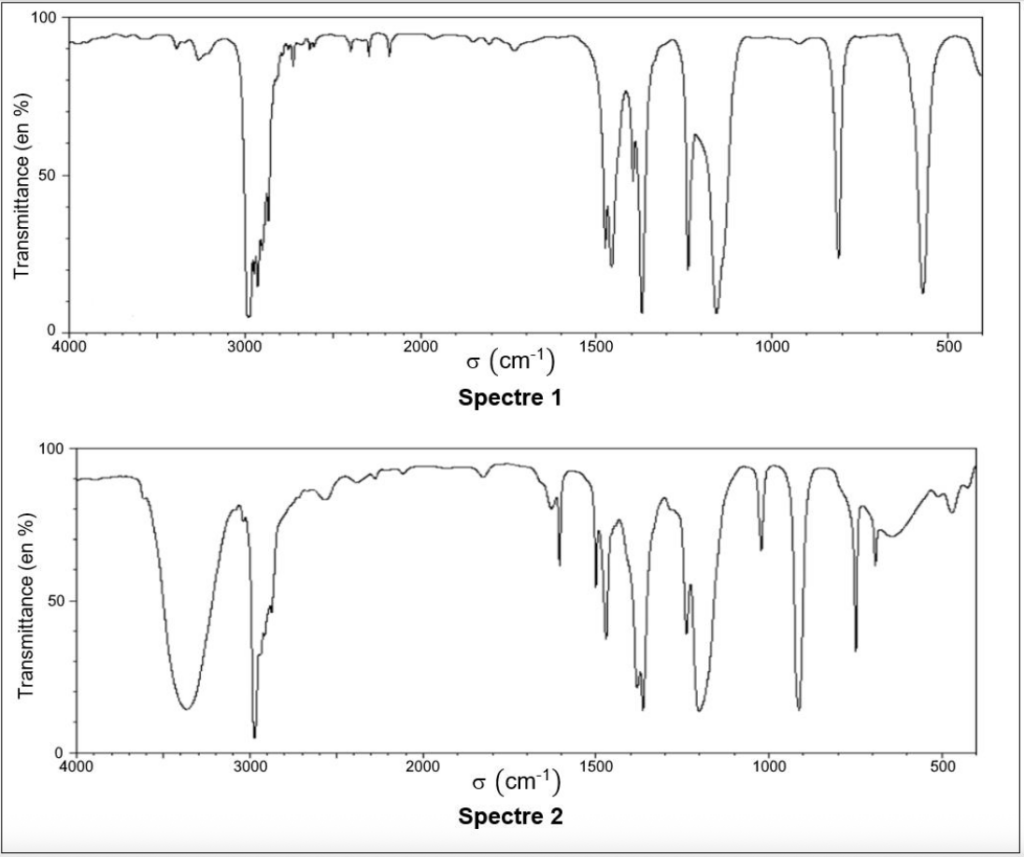
Figure 1. Les spectres IR
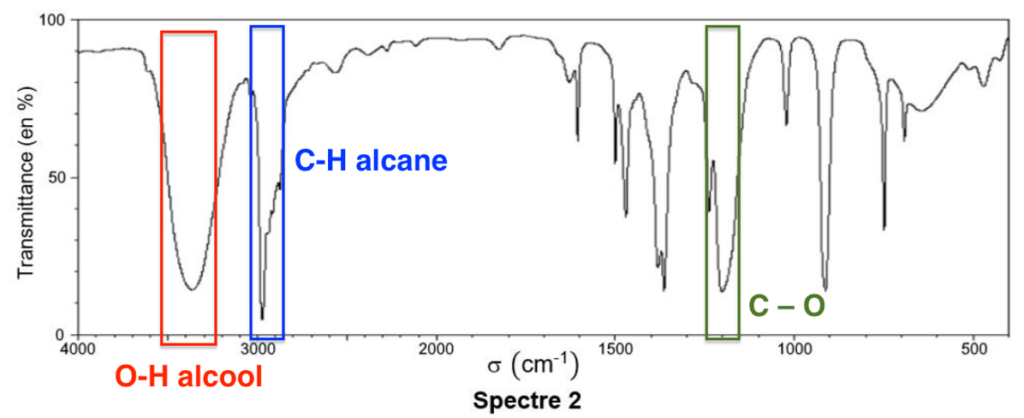

Le chlorure de tertiobutanol comporte des liaisons :
O-H alcool lié : 3200 – 3400 cm-1 (Forte, large)
C – O : 1000 – 1300 cm-1 (Forte)
C-H alcane : 2800 – 3000 cm-1 (Forte)
Le spectre 2 ces bandes, il est donc est celui du chlorure de tertiobutanol.
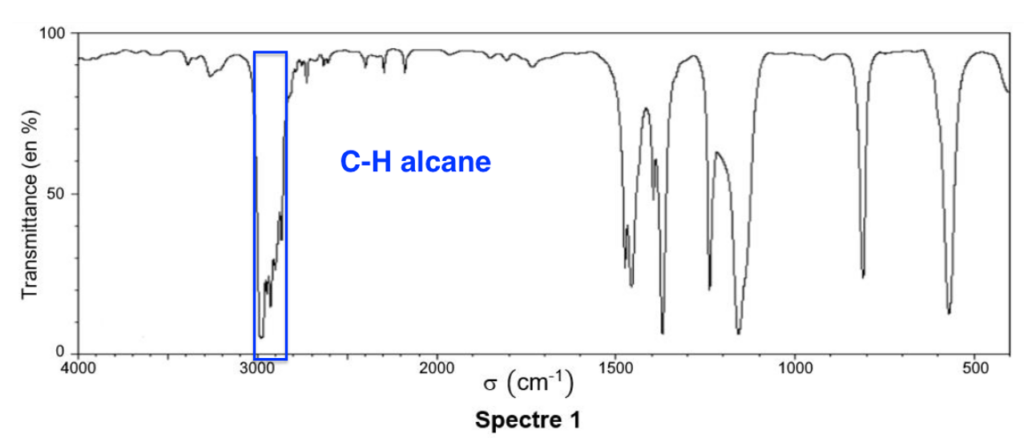
Le chlorure de tertiobutyle comporte des liaisons :
C-H alcane: 2800 – 3000 cm-1 (Forte)
Le spectre 1 cette bande, il est donc est celui du chlorure de tertiobutyle.
Q.6. À l’issue de la distillation, on recueille une masse m = 4,45 g de chlorure de tertiobutyle. Déterminer la valeur du rendement de la synthèse.
Le candidat est invité à présenter la démarche suivie même si elle n’a pas abouti.
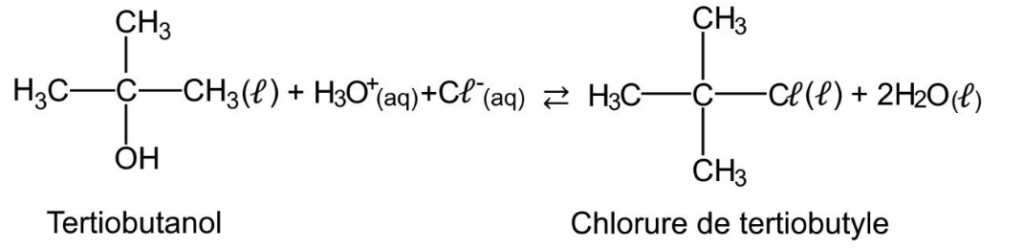
$$
n_{tertiobutanol}=\frac{m_{tertiobutanol}}{M_{tertiobutanol}}
$$
$$
n_{tertiobutanol}=\frac{5,00}{74,0}
$$
$$
n_{tertiobutanol}=6,76\times{10}^{-2}mol
$$
$$
n_{acide\ chlorhydrique}=C\times V
$$
$$
n_{acide\ chlorhydrique}=2,4\times100\times{10}^{-3}
$$
$$
n_{acide\ chlorhydrique}=2,4\times{10}^{-1}\ mol
$$
$$
x_{max1}=n_{tertiobutanol}
$$
$$
x_{max1}=6,76\times{10}^{-2}\ mol
$$
$$
x_{max2}=n_{acide\ chlorhydrique}
$$
$$
x_{max2}=2,4\times{10}^{-1}\ mol
$$
$$
x_{max1}<x_{max2}
$$
$$
x_{max}=x_{max1}=6,76\times{10}^{-2}\ mol
$$
Calculons la masse théorique maximale de chlorure de tertiobutyle produite :
$$
n_{tertiobutyle\ théorique}=\frac{m_{tertiobutyle\ théorique}}{M_{tertiobutyle}}
$$
$$
\frac{m_{tertiobutyle\ théorique}}{M_{tertiobutyle}}=n_{tertiobutyle\ théorique}
$$
$$
m_{tertiobutyle\ théorique}=n_{tertiobutyle\ théorique}\times M_{tertiobutyle}
$$
$$
m_{tertiobutyle\ théorique}=x_{max}\times M_{tertiobutyle}
$$
$$
m_{tertiobutyle\ théorique}=6,76\times{10}^{-2}\times92,5
$$
$$
m_{tertiobutyle\ théorique}=6,25\ g
$$
Rendement de la synthèse :
$$
r=\frac{m_{tertiobutyle\ experimentale}}{m_{tertiobutyle\ théorique}}
$$
$$
r=\frac{4,45}{6,25}
$$
$$
r=0,712
$$
$$
r=71,2%
$$
Le rendement de la synthèse est de 71,2 %.
