Bac Métropole mars 2023 Sujet 1
Exercice 3 – (4 points) – Durée 0h43 – Calculatrice autorisée
Sujet n°23-PYCJ1ME1
Sujet et corrigé
EXERCICE 3 – UNE FORMULATION DE L’ASPIRINE (4 points)
L’aspirine est le nom commercial de l’acide acétylsalicylique. L’aspirine est utilisée depuis le début du XXe siècle comme principe actif analgésique (antidouleur) et antipyrétique (contre la fièvre). Il s’agit encore aujourd’hui d’un des médicaments les plus consommés au monde.
Cet exercice a pour objectif d’étudier un sachet de médicament contenant de l’acide acétylsalicylique.
Données :
- extrait de la notice d’un sachet de médicament contenant de l’acide acétylsalicylique :
Utilisation : sachet dose de 1,0 g à dissoudre dans l’eau
Principe actif : ion acétylsalicylate
Composition : 900 mg d’acétylsalicylate de DL-lysine équivalent à un apport de 500 mg en acide acétylsalicylique
- en dissolvant un sachet de médicament dans 40 mL d’eau, on obtient une solution de pH = 5,0 ;
- couple acide-base (acide acétylsalicylique / ion acétylsalicylate) : pKA = 3,5 à 25 °C ;
- propriétés de quelques espèces chimiques :
| Acide acétylsalicylique | DL-Lysine | |
| Formule topologique | 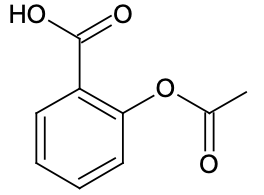 | 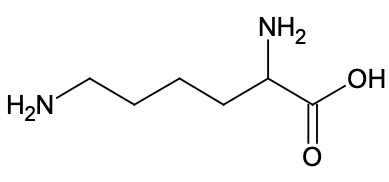 |
| Formule brute | C9H8O4 | C6H14N2O2 |
| Masse molaire (g·mol–1) | 180,2 | 146,2 |
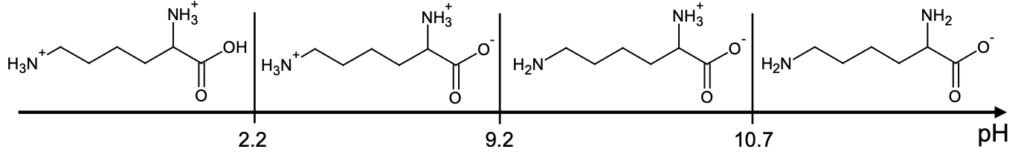
- diagramme de prédominance (sans souci d’échelle) de la DL-Lysine :
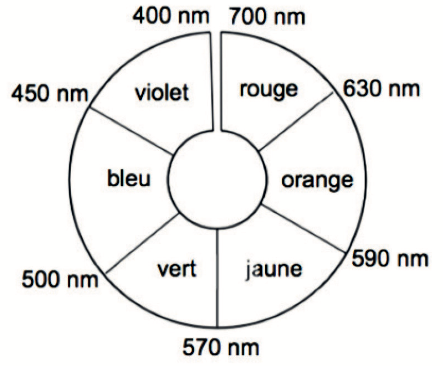
- cercle chromatique :
- pour décider si le résultat d’une mesure est en accord avec une valeur de référence, on utilise le quotient $\frac{\left|x-x_{\mathrm{ref}}\right|}{u(x)}$ avec x, la valeur mesurée ; xref la valeur de référence et u(x), l’incertitude-type associée à la valeur mesurée x.
Le sachet de médicament étudié contient de l’aspirine sous la forme d’un composé ionique, l’acétylsalicylate de DL-lysine.
Q1. Représenter la formule semi-développée de l’ion acétylsalicylate.
Acide acétylsalicylique :
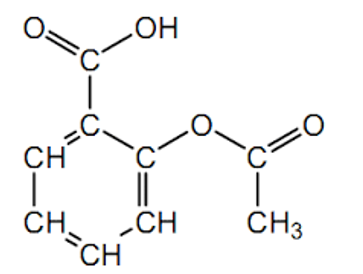
L’acide acétylsalicylique se transforme en ion acétylsalicylate en perdant un H+ provenant du groupe carboxyle :
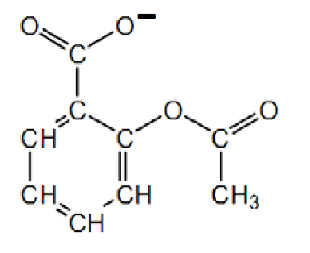
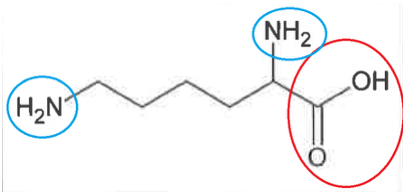
Q2. La DL-lysine appartient à la famille des acides aminés. Proposer une explication.
La DL-lysine comporte une fonction acide carboxylique et une fonction amine
La DL-lysine appartient donc à la famille des acides aminés.
Q3. Indiquer la forme prédominante des espèces associées à l’acide acétylsalicylique et à la DL-lysine présentes dans la solution de médicament obtenue après dissolution du contenu du sachet dans l’eau.
D’après l’énoncé : « En dissolvant un sachet de médicament dans l’eau on obtient un pH=5,0 »
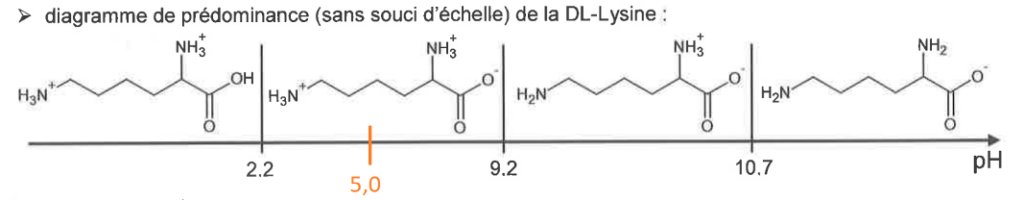
D’après le diagramme de prédominance, la forme prédominante de la DL-lysine est donc :
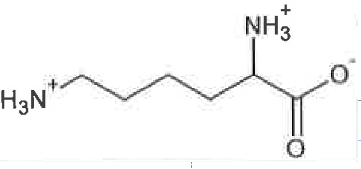
Diagramme de prédominance de l’acide acétylsalicylique :
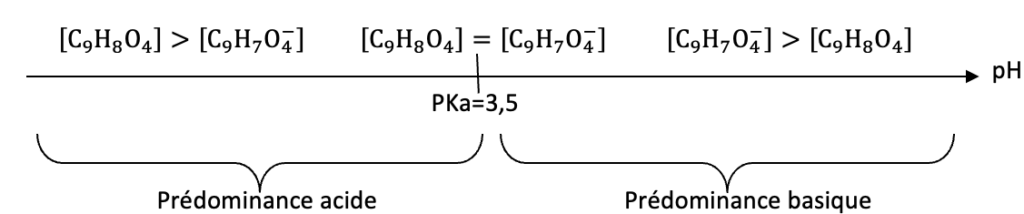
Avec ${C_9H}_8O_4$ l’acide acétylsalicylique
Avec ${{C_9H}_7O}_4^-$ l’ion acétylsalicylate
D’après le diagramme de prédominance ${{C_9H}_7O}_4^-$, l’ion acétylsalicylate, est prédominant pour pH=5,0 .
Q4. Justifier alors que le titrage acide-base de cette solution aqueuse de médicament par une solution d’acide fort ne permet pas de déterminer directement la quantité de matière de l’ion acétylsalicylate en solution.
Cette solution aqueuse de médicament, contient l’ion acétylsalicylate et une des formes de DL-lysine.
L’ajout d’un acide fort conduirait à une réaction entre l’ion acétylsalicylate et la forme de DL-lysine présente.
Ainsi, le titrage acide base de cette solution aqueuse de médicament ne permet pas de déterminer directement la quantité de matière de l’ion acétylsalicylate.
On souhaite vérifier l’indication « équivalent à un apport de 500 mg en acide acétylsalicylique » figurant sur la notice du médicament. Pour cela, on réalise le protocole suivant :
- étape 1 : placer le contenu d’un sachet dans une fiole jaugée de volume V1 = 250 mL, ajouter 10 mL d’une solution d’hydroxyde de sodium concentrée, homogénéiser le mélange et attendre 20 minutes, puis compléter jusqu’au trait de jauge avec de l’eau distillée ;
- étape 2 : prélever un volume V2 = 5,0 mL de cette solution, l’introduire dans une fiole jaugée de volume V3 = 50,0 mL et compléter jusqu’au trait de jauge avec une solution acidifiée de nitrate de fer (Fe3+(aq) ; 3 NO3–(aq)). On note S la solution obtenue, dans laquelle a été formée une espèce colorée, notée B.
Lors de la mise en œuvre de ce protocole, les transformations chimiques mises en jeu sont toutes modélisées par des réactions considérées comme totales. La figure 1 en représente les étapes simplifiées.
Les nombres stœchiométriques associés aux espèces représentées sont tous égaux à 1 :
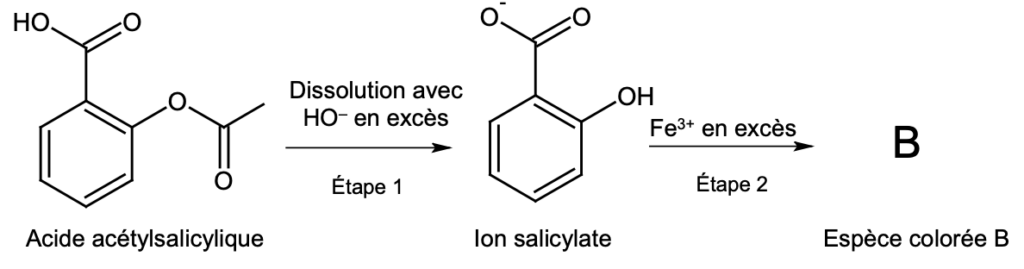
Figure 1 : étapes simplifiées de la synthèse de l’espèce colorée B
On souhaite réaliser le dosage spectrophotométrique par étalonnage de l’espèce colorée B obtenue à l’issue de l’étape 2. On admet que seule l’espèce B absorbe dans le domaine du visible.
Pour cela, on utilise une solution mère de l’espèce colorée B, à partir de laquelle on prépare par dilution 6 solutions étalons de concentrations connues. L’une de ces solutions étalons permet de réaliser le spectre d’absorption donné sur la figure 2. On mesure l’absorbance, à la longueur d’onde λ appropriée, de chaque solution étalon. Les résultats sont donnés en figure 3.
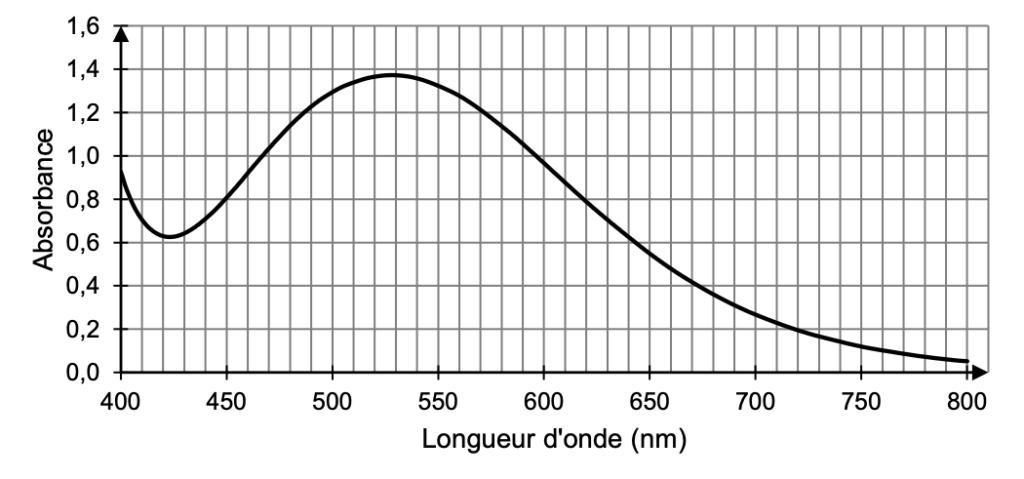
Figure 2. Spectre d’absorption d’une solution aqueuse de l’espèce colorée B à la concentration 1,74 mmol.L–1
Q5. Proposer une valeur de la longueur d’onde appropriée pour le dosage par étalonnage et en déduire la couleur de la solution contenant l’espèce B.
On choisit la longueur d’onde correspondante au maximum de l’absorbance :
$\lambda_m=530\ nm$
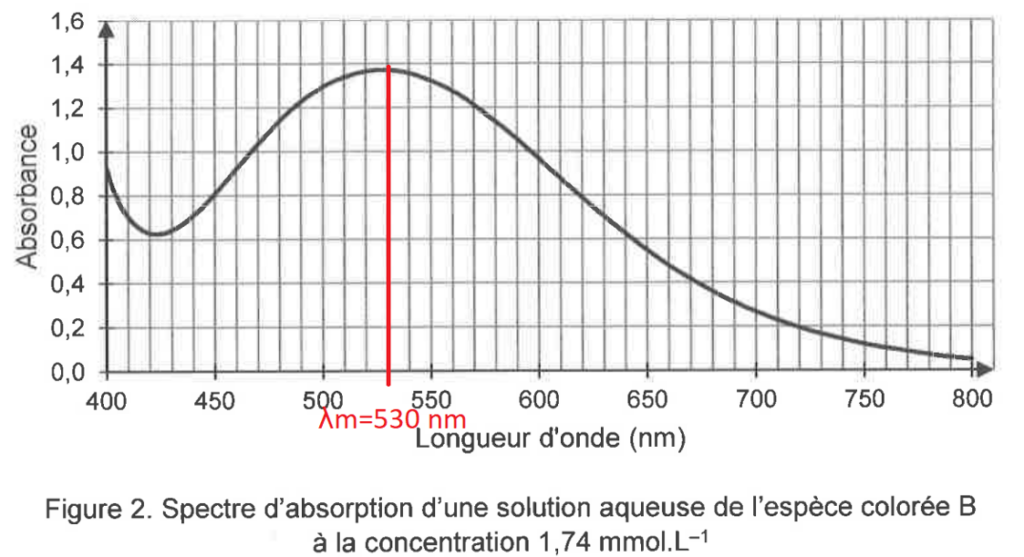
$\lambda_m=530\ nm$ : la couleur absorbée est le vert.
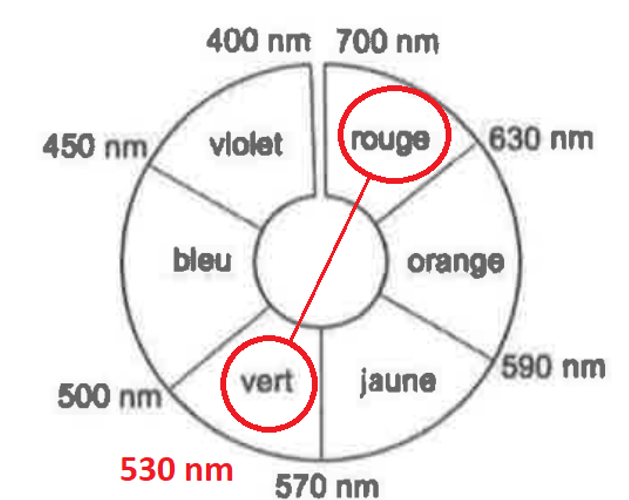
La couleur de la solution contenant l’espèce B est la couleur complémentaire. La couleur complémentaire est celle opposée sur le cercle chromatique.
La couleur de la solution contenant l’espèce B est le rouge.
Figure 3. Absorbance en fonction de la concentration en espèce B
La mesure de l’absorbance de la solution S obtenue à partir du sachet de médicament donne A = 0,80.
Q6. En considérant que l’incertitude-type associée à la détermination de la masse a pour valeur u(m) = 30 mg, vérifier si la masse équivalente mexp d’acide acétylsalicylique présente dans le sachet est en accord avec les informations présentes sur la notice.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et doit être correctement présentée.
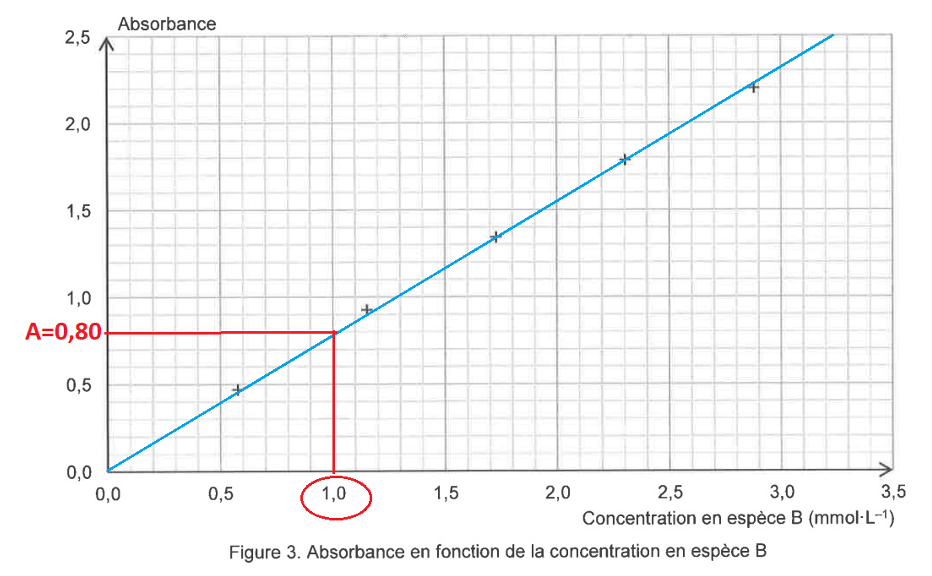
Graphiquement pour $A=0,80$ : $c=1,0\ mmol.L^{-1}$
Or il s’agit de la concentration de S qui à été obtenue par dilution.
$c_B\times V_2=c\times V_3$
$c_B=\frac{c\times V_3}{V_2}$
$c_B=\frac{1,0\times10^{-3}\times50,0\times10^{-3}}{5,0\times10^{-3}}$
$c_B=1,0\times10^{-2}\ mol.L^{-1}$
$c_B=\frac{n_B}{V}=\frac{n_{Acide}}{V}$
$\frac{n_{Acide}}{V}=c_B$
$n_{Acide}=c_B\times V$
Or
$n_{Acide}=\frac{m_{Acide}}{M_{Acide}}$
D’où
$\frac{m_{Acide}}{M_{Acide}}=c_B\times V$
$m_{Acide}=c_B\times V\times M_{Acide}$
$m_{Acide}=1,0\times10^{-2}\times250\times10^{-3}\times180,2$
$m_{Acide}=0,45\ g$
Calculons le z-score
$z=\frac{\left|x-x_{ref}\right|}{u\left(x\right)}=\frac{\left|m-m_{ref}\right|}{u\left(m\right)}=\frac{\left|0,45-500\times10^{-3}\right|}{30\times10^{-3}}=1,7$
$z\le2$ : Le résultat de la mesure est compatible avec la valeur de référence.
La masse équivalente $m_{exp}$ d’acide acétylsalicylique présente dans le sachet est en accord avec les informations présentes sur la notice.
