Bac Métropole Septembre 2023 Sujet 1
Exercice 3 – (5 points) – Durée 0h53 – Calculatrice autorisée
Sujet n°23-PYCJ1ME3
Sujet et corrigé
EXERCICE 3 – UN SAVON FAIT MAISON (5 points)
Le savon est un produit d’hygiène connu depuis l’Antiquité. Concurrencé de nos jours par les savons liquides, le savon solide reste très utilisé pour se laver les mains et peut être fabriqué à la maison. La transformation chimique qui en permet la fabrication est la saponification : un corps gras, comme l’huile d’olive, est hydrolysé en milieu basique pour former le savon et du glycérol.
L’objectif de cet exercice est d’analyser un protocole de saponification à froid proposé par un site internet et de le comparer à un protocole de saponification artisanale historique.
Données :
- dans tout l’exercice, on considère que l’huile d’olive est uniquement constituée d’oléine ;
- masse volumique de l’huile d’olive : ρ = 0,91 g·mL–1 ;
- caractéristiques des espèces chimiques utilisées :
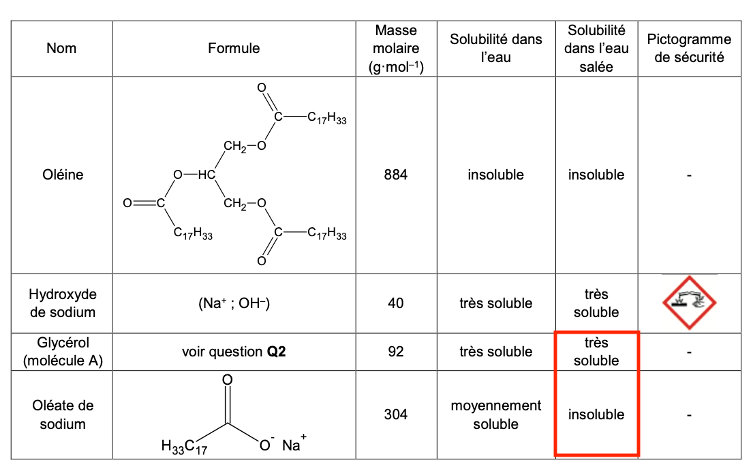
| Nom | Formule | Masse molaire (g·mol–1) | Solubilité dans l’eau | Solubilité dans l’eau salée | Pictogramme de sécurité |
| Oléine | 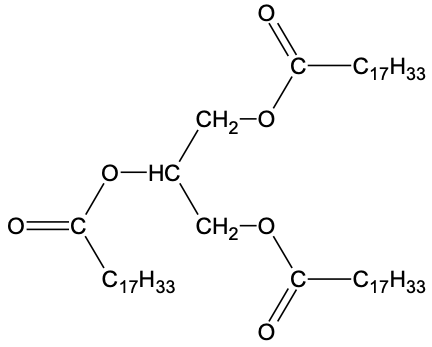 | 884 | insoluble | insoluble | – |
| Hydroxyde de sodium | (Na+ ; OH–) | 40 | très soluble | très soluble |  |
| Glycérol (molécule A) | voir question Q2 | 92 | très soluble | très soluble | – |
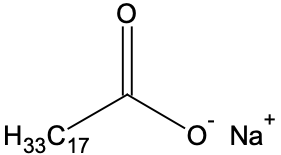
| Oléate de sodium |  | 304 | moyennement soluble | insoluble | – |
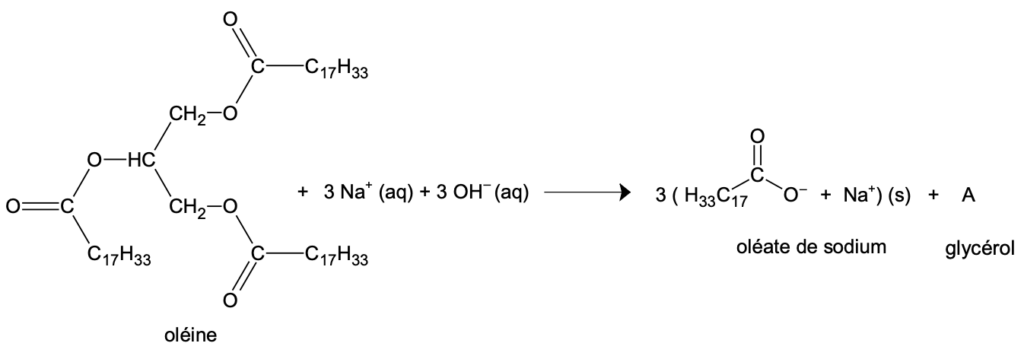
- la saponification de l’oléine est considérée comme totale. L’équation de la réaction modélisant cette transformation est donnée ci-dessous :
1. Un savon surgras fait maison
Q1. Nommer la famille chimique à laquelle appartient la molécule d’oléine et préciser son groupe caractéristique.
Oléine :
Famille : Ester
Groupe caractéristique : carboxyle ou ester
Q2. Donner la formule brute du glycérol, noté A dans l’équation de saponification de l’oléine.
| Réactifs | Produits | ||
| Oléine : C57H104O6 | 3 Na+ et 3OH– | 3 Oléate de sodium : 3C18H33O2– et 3 Na+ | Glycérol |
| Bilan d’atomes : 56 C – 107 H – 9 O – 3 Na Charge : nulle | Bilan d’atomes : 54 C – 99 H – 6 O – 3 Na Charge : nulle | ||
A est constitué de :
57-54= 3 atomes de carbone
107-99= 8 atomes d’hydrogène
9-6= 3 atomes d’oxygène
Formule brute du glycérol : C3H8O3
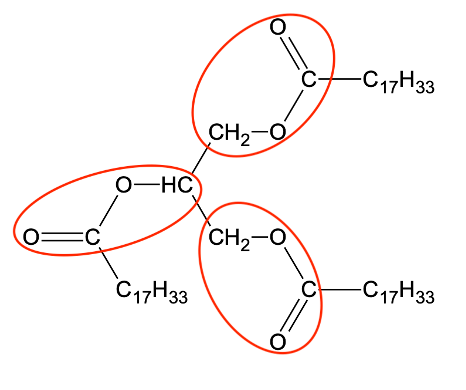
On donne sur la figure 1 ci-dessous la formule topologique de l’ion oléate, qui possède des propriétés lavantes. Cette molécule est amphiphile : elle possède une partie hydrophile, entourée sur la figure 1, et une partie lipophile qui correspond à la chaîne carbonée. Une représentation schématique de cette molécule est également donnée sur la figure 1.
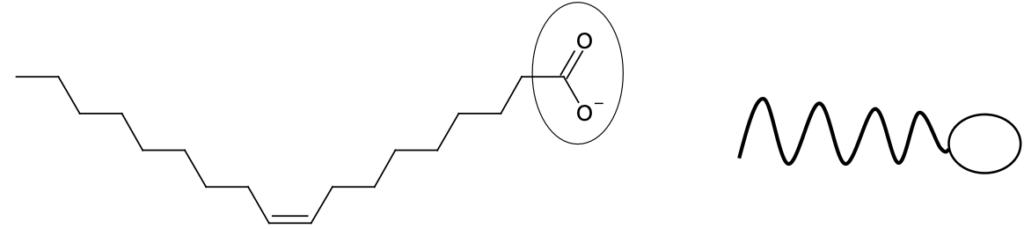
Figure 1. Formule topologique et représentation schématique de l’ion oléate
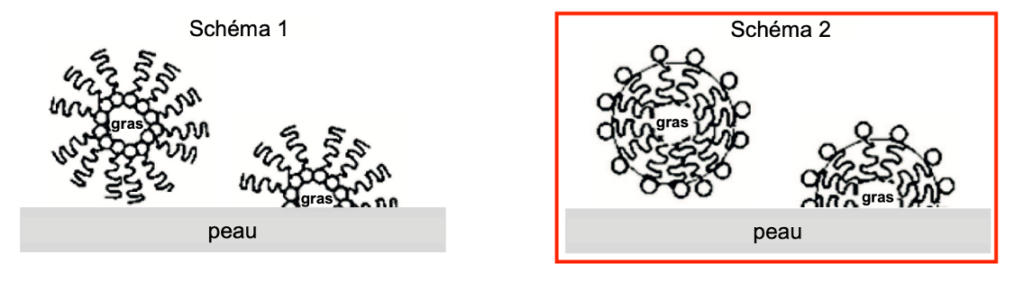
Q3. Choisir parmi les deux schémas ci-dessous, celui qui illustre les propriétés lavantes des savons. Justifier ce choix.
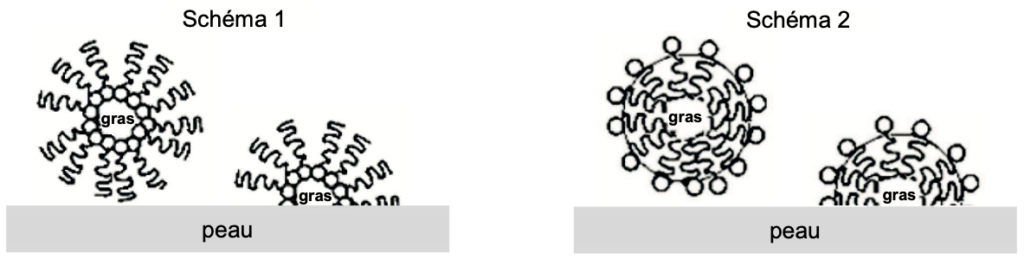
La partie hydrophile, entourée sur la figure 1, s’entourera d’eau.
La partie lipophile qui correspond à la chaîne carbonée s’entourera de gras.
Le schéma 2 illustre les propriétés lavantes des savons.
On donne ci-dessous un protocole de fabrication d’un savon à base d’huile d’olive élaboré à partir d’un site internet :
- introduire 50 mL d’eau dans un bécher et ajouter très doucement 25 g d’hydroxyde de sodium solide en agitant régulièrement jusqu’à dissolution complète ;
- verser doucement 220 mL d’huile d’olive en agitant pendant une heure pour obtenir une pâte épaisse ;
- couler la pâte dans un moule, recouvrir hermétiquement de film alimentaire ;
- après 48 h, démouler le solide et laisser à l’air libre au moins 6 semaines pour obtenir le savon.
Ce protocole est accompagné d’une consigne importante : « la saponification est dangereuse et nécessite de porter une blouse, des lunettes de protection et des gants ».
Q4. Déterminer la concentration en quantité de matière de la solution d’hydroxyde de sodium préparée dans la première étape du protocole en supposant que la dissolution s’effectue sans variation de volume. Commenter.
Concentration en quantité de matière de la solution d’hydroxyde de sodium :
$C=\frac{n}{V}$
Or
$n=\frac{m}{M}$
Donc
$C=\frac{\frac{m}{M}}{V}$
$C=\frac{m}{M\times V}$
$C=\frac{25}{40\times50\times{10}^{-3}}$
$C=13\ mol.L^{-1}$
C’est une concentration très élevée. D’où la consigne importante : « la saponification est dangereuse et nécessite de porter une blouse, des lunettes de protection et des gants ».
Q5. Indiquer, en justifiant, l’évolution attendue du pH du milieu au cours de la fabrication du savon.
Les ions HO– sont responsable du caractère basique de la solution.
Les ions HO– sont des réactifs, ainsi la concentration des ions HO– diminue au cours de la fabrication du savon : la solution devient moins basique, le pH diminue.
Q6. Déterminer la masse restante d’oléine à l’état final. On peut par exemple s’appuyer sur un tableau d’avancement.
Calculons les quantités initiales des réactifs :
$n_{{\rm Na}^+}=n_{{\rm HO}^-}=C\times V$
$n_{{\rm Na}^+}=n_{{\rm HO}^-}=13\times50\times{10}^{-3}$
$n_{{\rm Na}^+}=n_{{\rm HO}^-}=0,65\ mol$
$n_{C_{57}H_{104}O_6}=\frac{m_{C_{57}H_{104}O_6}}{M_{C_{57}H_{104}O_6}}$
Or
$\rho_{C_{57}H_{104}O_6}=\frac{m_{C_{57}H_{104}O_6}}{V_{C_{57}H_{104}O_6}}$
$\frac{m_{C_{57}H_{104}O_6}}{V_{C_{57}H_{104}O_6}}=\rho_{C_{57}H_{104}O_6}$
$m_{C_{57}H_{104}O_6}=\rho_{C_{57}H_{104}O_6}\times V_{C_{57}H_{104}O_6}$
Donc
$n_{C_{57}H_{104}O_6}=\frac{\rho_{C_{57}H_{104}O_6}\times V_{C_{57}H_{104}O_6}}{M_{C_{57}H_{104}O_6}}$
$n_{C_{57}H_{104}O_6}=\frac{0,91\times220}{884}$
$n_{C_{57}H_{104}O_6}=0,23\ mol$
| $C_{57}H_{104}O_6$ | $+3{\rm Na}^+(aq)$ | $+3{\rm HO}^-(aq) \longrightarrow$ | $ 3\ (C_{18}H_{33}O_2^-+{\rm Na}^+)(s)\ $ | $+C_3H_8O_3$ | |
| État initial | 0,23 | 0,65 | 0,65 | 0 | 0 |
| État intermédiaire | $0,23-x$ | $0,65\ -3x $ | $0,65\ -3x$ | $3x$ | $x$ |
| État final | $0,23-x_f$ | $0,65\ -3x_f $ | $0,65\ -3x_f$ | $3x_f $ | $x_f$ |
Calculons $x_{max}$ :
$0,23-x_{max1}=0$
$-x_{max1}=-0,23$
$x_{max1}=0,23\ mol$
$0,65\ -3x_{max2}=0$
$-3x_{max2}=-0,65$
$x_{max2}=\frac{-0,65}{-3}$
$x_{max2}=0,22\ mol$
$0,65\ -3x_{max3}=0$
$-3x_{max3}=-0,65$
$x_{max3}=\frac{-0,65}{-3}$
$x_{max3}=0,22\ mol$
Ainsi $x_{max}=0,22\ mol$
En considérant la réaction totale : $x_f=x_{max}$
$n_{C_{57}H_{104}O_6}^f=0,23-x_f$
$n_{C_{57}H_{104}O_6}^f=0,23-0,22$
$n_{C_{57}H_{104}O_6}^f=0,01\ mol$
Calculons la masse restante d’huile à l’état final :
$n_{C_{57}H_{104}O_6}^f=\frac{m_{C_{57}H_{104}O_6}^f}{M_{C_{57}H_{104}O_6}}$
$\frac{m_{C_{57}H_{104}O_6}^f}{M_{C_{57}H_{104}O_6}}=n_{C_{57}H_{104}O_6}^f$
$m_{C_{57}H_{104}O_6}^f=n_{C_{57}H_{104}O_6}^f\times M_{C_{57}H_{104}O_6}$
$m_{C_{57}H_{104}O_6}^f=0,01\times884$
$m_{C_{57}H_{104}O_6}^f=9\ g$
Remarque : les résultats trouvés au cours des questions donnent lieu à des arrondis. En gardant les expressions littérales et en calculant la masse nous trouvons :
$$m_{C_{57}H_{104}O_6}^f=n_{C_{57}H_{104}O_6}^f\times M_{C_{57}H_{104}O_6}$$
$$m_{C_{57}H_{104}O_6}^f=\left(n_{C_{57}H_{104}O_6}^i-x_f\right)\times M_{C_{57}H_{104}O_6}$$
$$m_{C_{57}H_{104}O_6}^f=\left(\frac{\rho_{C_{57}H_{104}O_6}\times V_{C_{57}H_{104}O_6}}{M_{C_{57}H_{104}O_6}}-x_{max}\right)\times M_{C_{57}H_{104}O_6}$$
$$m_{C_{57}H_{104}O_6}^f=\left(\frac{\rho_{C_{57}H_{104}O_6}\times V_{C_{57}H_{104}O_6}}{M_{C_{57}H_{104}O_6}}-\frac{n_{{\rm HO}^-}}{3}\right)\times M_{C_{57}H_{104}O_6}$$
$$m_{C_{57}H_{104}O_6}^f=\left(\frac{\rho_{C_{57}H_{104}O_6}\times V_{C_{57}H_{104}O_6}}{M_{C_{57}H_{104}O_6}}-\frac{m_{NaOH}}{3\times M_{NaOH}}\right)\times M_{C_{57}H_{104}O_6}$$
$$m_{C_{57}H_{104}O_6}^f=\left(\frac{0,91\times 220}{884}-\frac{25}{40}\right)\times 884$$
$$m_{C_{57}H_{104}O_6}^f=16\ g$$
Le résultat est très éloigné du résultat trouvé avec les calculs intermédiaires. Nous calculerons le surgraissage également avec ce résultat dans la question suivante.
On appelle surgraissage le pourcentage en masse d’huile non saponifiée lors de la fabrication du savon. La plupart des savons ont un surgraissage compris entre 5 % et 10 %.
Q7. Déterminer le surgraissage du savon obtenu par cette méthode.
Calculons la masse initiale d’huile utilisée :
$$m_{C_{57}H_{104}O_6}^i=n_{C_{57}H_{104}O_6}^i\times M_{C_{57}H_{104}O_6}$$
$$m_{C_{57}H_{104}O_6}^i=0,23\times 884$$
$$m_{C_{57}H_{104}O_6}^i=2,0\times {10}^2\ g$$
Calculons le surgraissage (pourcentage en masse d’huile non saponifiée) :
$$P=\frac{m_{C_{57}H_{104}O_6}^f}{m_{C_{57}H_{104}O_6}^i}\times 100$$
$$P=\frac{9}{2,0\times {10}^2}\times 100$$
$$P=5\ %$$
Remarque : les résultats trouvés au cours des questions donnent lieu à des arrondis. En gardant les expressions littérales et en calculant la masse nous trouvons :
$$P=\frac{m_{C_{57}H_{104}O_6}^f}{m_{C_{57}H_{104}O_6}^i}\times 100$$
$$P=\frac{16}{2,0\times {10}^2}\times 100$$
$$P=8 \% $$
2. Fabrication artisanale du savon
Le procédé historique de fabrication du savon de Marseille est décrit dans le Traité complet de la fabrication des savons écrit par G. Eugène Lormé en 1859.
On donne ci-dessous les étapes décrites dans le traité :
- le mélange d’un excès de soude et d’huile d’olive est porté à ébullition pendant une dizaine d’heures ;
- de l’eau salée est ajoutée au milieu réactionnel (relargage) ;
- de la soude est ajoutée au savon très chaud pour qu’il gagne en consistance et en pureté, puis il est lavé plusieurs fois à l’eau, le savon est enfin laissé à l’air libre plusieurs semaines pour sécher.
Q8. Expliquer, en utilisant les données, l’intérêt du relargage.
Le relargage consiste à ajouter de l’eau salée au milieu réactionnel.
Le savon (oléate de sodium) est insoluble dans l’eau salée contrairement au glycérol.
Ainsi le relargage permet de séparer les produits de la saponification.
Q9. Identifier dans le protocole de la partie ci-dessus, la stratégie choisie permettant d’optimiser le procédé par rapport à celle de la fabrication maison du savon de la partie 1.
La stratégie choisie permettant d’optimiser le procédé par rapport à celle de la fabrication maison du savon de la partie 1 consiste à augmenter la vitesse de réaction grâce à différents facteurs cinétiques :
Température : on chauffe pendant une dizaine d’heure
Réactif en excès : la soude est en excès
On donne ci-dessous la copie d’un extrait du Traité complet de la fabrication des savons et son adaptation.
- Extrait :

Ce « savon épuré » a pour composition massique :
| % massique moyen | |
| oléate de sodium | 50,2 |
| hydroxyde de sodium | 4,6 |
| eau | 45,2 |
| total | 100,0 |
Q10. Après avoir calculé la masse d’oléate de sodium présente dans le « savon épuré », déterminer le rendement maximal de la fabrication du savon obtenu par le procédé artisanal.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et doit être correctement présentée.
Masse d’oléate de sodium présente dans le « savon épuré » :
$$m_{\text{oléate de sodium}}^{\text{finale}}=P\times m_{\text{savon}}$$
$$m_{\text{oléate de sodium}}^{\text{finale}}=\frac{50,2}{100}\times1350$$
$$m_{\text{oléate de sodium}}^{\text{finale}}=678\ g$$
Calculons les quantités initiales des réactifs :
$$n_{C_{57}H_{104}O_6}=\frac{m_{C_{57}H_{104}O_6}}{M_{C_{57}H_{104}O_6}}$$
$$n_{C_{57}H_{104}O_6}=\frac{1000}{884}$$
$$n_{C_{57}H_{104}O_6}=1,13\ mol$$
| $$C_{57}H_{104}O_6 $$ | $$+3{\rm Na}^+(aq)$$ | $$ +3{\rm HO}^-(aq) \longrightarrow $$ | $$3\ (C_{18}H_{33}O_2^-+{\rm Na}^+)(s)\ $$ | $$+C_3H_8O_3$$ | |
| État initial | 1,13 | excés | excés | 0 | 0 |
| État intermédiaire | $$1,13\ -x$$ | excés | excés | $3x$ | x |
| État final | $$1,13\ -x_f$$ | excés | excés | $3x_f$ | $x_f$ |
Calculons la masse maximale théorique d’oléate de sodium :
$$n_{\text{oléate de sodium}}^{\text{théorique}}=\frac{m_{\text{oléate de sodium}}^{\text{théorique}}}{M_{\text{oléate de sodium}}}$$
$$\frac{m_{\text{oléate de sodium}}^{\text{théorique}}}{M_{\text{oléate de sodium}}}=n_{\text{oléate de sodium}}^{\text{théorique} }$$
$$m_{\text{oléate de sodium}}^{\text{théorique}}=n_{\text{oléate de sodium}}^{\text{théorique}}\times M_{\text{oléate de sodium}}$$
Avec :
$$n_{\text{oléate de sodium}}^{\text{théorique}}=3x_{\max}$$
$$m_{\text{oléate de sodium}}^{\text{théorique}}=3x_{\max}\times M_{\text{oléate de sodium}}$$
$$m_{\text{oléate de sodium}}^{\text{théorique}}=3\times1,13\times304$$
$$m_{\text{oléate de sodium}}^{\text{théorique}}=1,03\times10^3\ g$$
Calculons le rendement :
$$\eta=moléate\ de\ sodiumfinalemoléate\ de\ sodiumthéorique$$
$$\eta=\frac{678}{1,03\times {10}^3}$$
$$\eta=0,658$$
Le rendement maximal de la fabrication du savon obtenu par le procédé artisanal à pour valeur 0,658 soit 65,8%.
