Bac Nouvelle Calédonie 2023 Sujet 1
Exercice 1 – (9 points) – Durée 1h35 – Calculatrice autorisée
Sujet n°23-PYCJ1NC1
Sujet et corrigé
EXERCICE I – UN POLYMÈRE BIODÉGRADABLE, LE PLA (9 points)
Données :
Masse molaire de l’acide lactique : 𝑀 = 90,1 g · mol−1
Calculs d’incertitudes :
- Dans les conditions de l’expérience, les incertitudes-type sur la concentration de la solution (S2) d’hydroxyde de sodium et sur la valeur de 𝑉eq sont les suivantes :
𝑢(𝐶2) = 0,02 × 10−1 mol ∙ L−1 𝑢(𝑉eq) = 0,25 mL
- Incertitudes-type de quelques éléments de verrerie, à 20 °C :
| Pipette jaugée | Burette graduée | Fiole jaugée |
| 10,00 ± 0,02 mL | 25,00 ± 0,05 mL | 100,0 ± 0,1 mL |
| 20,00 ± 0,03 mL | 50,00 ± 0,10 mL | 200,0 ± 0,2 mL |
| 25,00 ± 0,05 mL |
- L’incertitude-type sur la concentration de la solution (S0) d’acide lactique peut être obtenue grâce à la relation suivante : $u(C_0)=C_0\times\sqrt{\left(\frac{u(C_2)}{C_2}\right)^2+\left(\frac{u(V_{eq})}{V_{eq}}\right)^2+\left(\frac{u(V_1)}{V_1}\right)^2}$
- Afin de vérifier la compatibilité entre une valeur expérimentale 𝐶0 et une valeur de référence 𝐶0,réf, on calcule le rapport, appelé écart normalisé : $z=\frac{\left|C_0-C_{0,\mathrm{réf}}\right|}{u(C_0)}$.
Si z ≤ 2, la valeur expérimentale et la valeur de référence sont jugées compatibles.
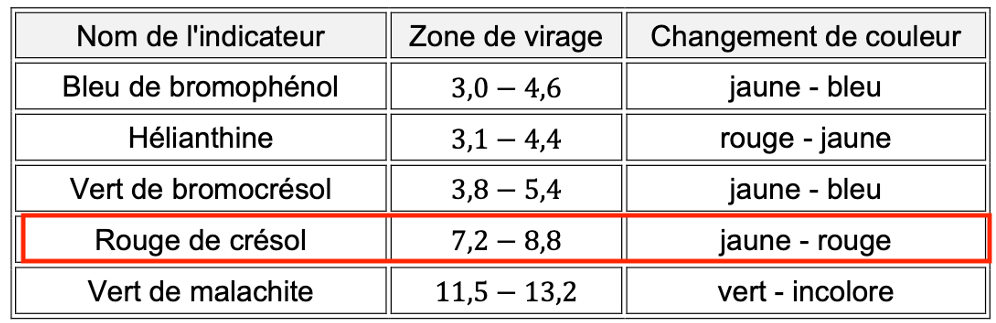
Indicateurs colorés :
| Nom de l’indicateur | Zone de virage | Changement de couleur |
| Bleu de bromophénol | 3,0 − 4,6 | jaune – bleu |
| Hélianthine | 3,1 − 4,4 | rouge – jaune |
| Vert de bromocrésol | 3,8 − 5,4 | jaune – bleu |
| Rouge de crésol | 7,2 − 8,8 | jaune – rouge |
| Vert de malachite | 11,5 − 13,2 | vert – incolore |
Table de nombres d’onde associés aux bandes des spectres infrarouge :
| Liaison | Type de composé | Nombre d’onde (en cm-1) | Commentaire |
| −C − H | 2480 – 3000 | ||
| O − H | alcool libre | 3580 – 3650 | fine |
| alcool en liaison hydrogène | 3200 – 3550 | large | |
| C − O | éther | 1000 – 1250 | |
| alcool | 970 – 1260 | ||
| époxyde | 1200 – 1250 | ||
| ester | 1050 – 1330 | ||
| C = O | cétone | 1715 | intense |
| aldéhyde | 1720 – 1740 | ||
| acide carboxylique | 1760 | ||
| ester | 1735 – 1750 |
Partie A – Dosage d’une solution d’acide lactique
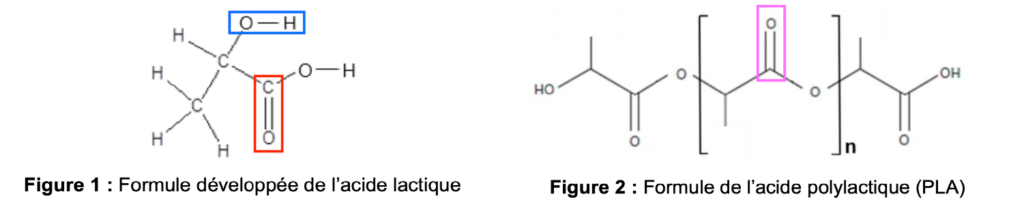
L’acide lactique est une molécule biosourcée produite à plus de 270 000 tonnes par an. Il possède un large éventail d’applications, notamment dans l’agroalimentaire, les cosmétiques, l’industrie pharmaceutique et l’emballage. La représentation développée de l’acide lactique est donnée ci- dessous (figure 1).
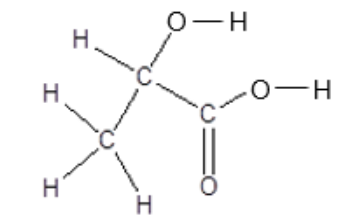
Figure 1 : Formule développée de l’acide lactique
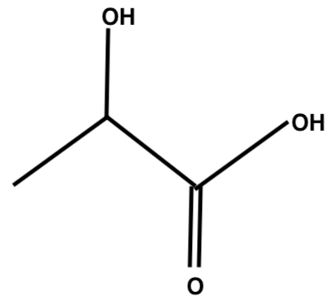
A.1. Représenter la formule topologique de l’acide lactique, puis entourer les groupes caractéristiques. Nommer les familles fonctionnelles de cette molécule.
Formule topologique de l’acide lactique :
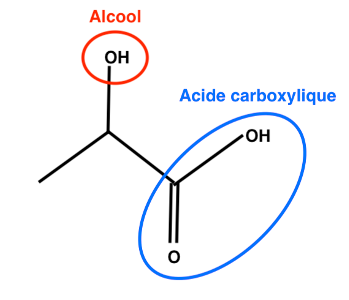
Familles fonctionnelles de l’acide lactique :
- Alcool
- Acide carboxylique
Industriellement, l’acide lactique est principalement produit par fermentation bactérienne. À l’issue de cette étape, on obtient une concentration en acide lactique comprise entre 53 g · L−1 et 85 g · L−1.
On cherche dans cette partie à vérifier par titrage la concentration en acide lactique dans une lotion utilisée en cosmétique, notée (S0), dont la concentration de référence annoncée est de C0,réf = 65 g · L−1.
L’acide lactique sera noté AH et sa base conjuguée A−.
On prépare une solution (S1) en diluant dix fois la solution (S0).
Protocole du titrage :
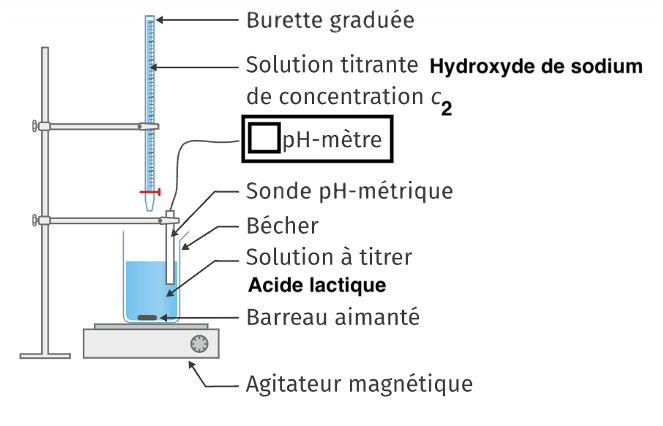
- À l’aide d’une pipette jaugée, prélever 𝑉1 = 20,00 mL de la solution (S1), les verser dans un bécher de 100 mL et y introduire un barreau aimanté.
- Placer le bécher sur un dispositif d’agitation magnétique.Remplir une burette graduée de 25,00 mL d’une solution aqueuse d’hydroxyde de sodium (S2) (Na+(aq) + OH−(aq)) de concentration 𝐶2 = 1,00 × 10−1 mol∙ L−1.
- Étalonner le 𝑝𝐻-mètre et immerger la sonde dans la solution à titrer.
- Effectuer le titrage de la solution (S1) contenue dans l’erlenmeyer par la solution (S2) contenue dans la burette graduée en suivant l’évolution du 𝑝𝐻.
A.2. Schématiser et légender le dispositif expérimental utilisé pour réaliser le titrage.
A.3. Écrire l’équation de la réaction support du titrage.
Équation de la réaction support du titrage :
$${\rm AH}{(aq)}+{\rm HO}{(aq)}^-\rightarrow A_{(aq)}^-+{H_2O}_{(l)}$$
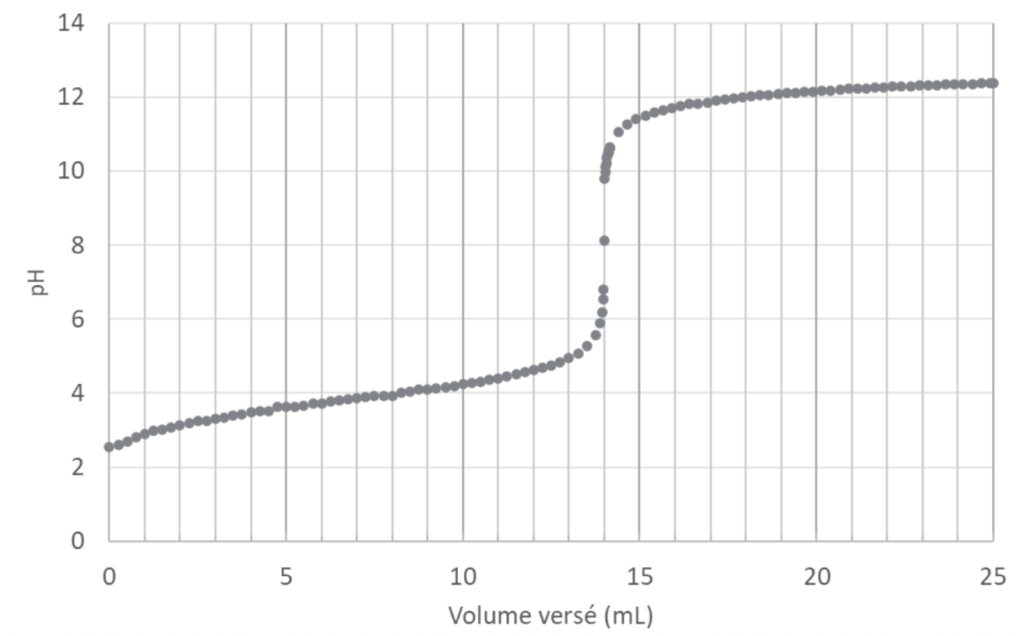
Les mesures du 𝑝𝐻 de la solution (S1) en fonction du volume de la solution titrante (S2) versé conduisent à la courbe de l’ANNEXE I À RENDRE AVEC LA COPIE (page 12/13).
A.4.1. À partir de la courbe figurant sur l’ANNEXE I À RENDRE AVEC LA COPIE (page 12/13), déterminer, en justifiant, le volume 𝑉eq de solution titrante (S2) versé à l’équivalence.
Veq trouvé à l’aide de la méthode des tangentes parallèles : Veq =14,0 mL
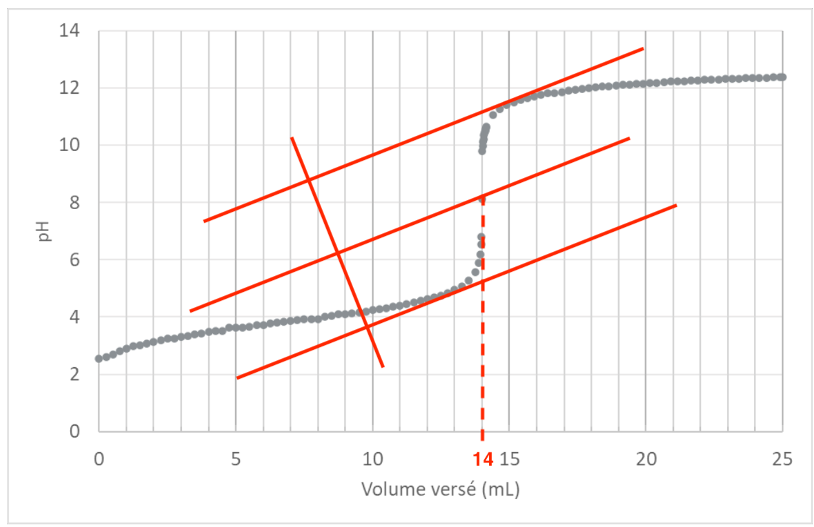
A.4.2. En déduire la concentration en quantité de matière 𝐶0 en acide lactique dans la solution (S0).
A l’équivalence :
$$\frac{n_{AH}^i}{1}=\frac{n_{{\rm HO}^-}^{eq}}{1}$$
$$C_1\times V_1=C_2\times V_{eq}$$
$$C_1=\frac{C_2\times V_{eq}}{V_1}$$
$$C_1=\frac{1,00\times {10}^{-1}\times 14,0\times {10}^{-3}}{20,00\times {10}^{-3}}$$
$$C_1=7,00\times {10}^{-2}mol.L^{-1}$$
Or « On prépare une solution (S1) en diluant dix fois la solution (S0). »
$$C_0=10\times C_1$$
$$C_0=10\times 7,00\times {10}^{-2}$$
$$C_0=7,00\times {10}^{-1}mol.L^{-1}$$
A.4.3. Calculer l’incertitude-type 𝑢(𝐶0) associée à la mesure de la concentration en acide lactique dans la solution (S0).
$$u\left(C_0\right)=C_0\times \sqrt{\left(\frac{u\left(C_2\right)}{C_2}\right)^2+\left(\frac{u\left(V_{eq}\right)}{V_{eq}}\right)^2+\left(\frac{u\left(V_1\right)}{V_1}\right)^2}$$
$$u\left(V_1\right)=0,03\ mL$$ car V1 est le volume prélevé à l’aide d’une pipette jaugée de 20,00 mL

$$u\left(C_0\right)=7,00\times {10}^{-1}\times \sqrt{\left(\frac{0,02\times {10}^{-1}}{1,00\times {10}^{-1}}\right)^2+\left(\frac{0,25}{14,0}\right)^2+\left(\frac{0,03}{20,00}\right)^2}$$
$$u\left(C_0\right)=2\times {10}^{-2}\ mol.L^{-1}$$
A.4.4. Comparer le résultat de la mesure de la concentration 𝐶0 à la valeur de référence en calculant l’écart normalisé z. Conclure.
$$C_{0,\mathrm{réf}}=65\ \mathrm{g.L^{-1}}$$
Cette concentration est une concentration massique. Pour la comparer à celle trouvée, il nous faut la concentration molaire :
$$z=\frac{\left|C_0-C_{0,\mathrm{réf}}\right|}{u\left(C_0\right)}$$
$$C_{0,\mathrm{réf,molaire}}=\frac{C_{0,\mathrm{réf,massique}}}{M}$$
$$C_{0,\mathrm{réf,molaire} }=\frac{65}{90,1}$$
$$C_{0,\mathrm{réf,molaire}}=7,2\times 10^{-1}\ \mathrm{mol.L^{-1}}$$
$$z=\frac{\left|7,00\times {10}^{-1}-7,2\times {10}^{-1}\ \right|}{2\times {10}^{-2}}$$
$$z=1$$
z ≤ 2, la valeur expérimentale et la valeur de référence sont jugées compatibles.
A.5. Proposer, en justifiant, le nom d’un indicateur coloré permettant de repérer l’équivalence du titrage de l’acide lactique.
Graphiquement : pHeq = 8,2
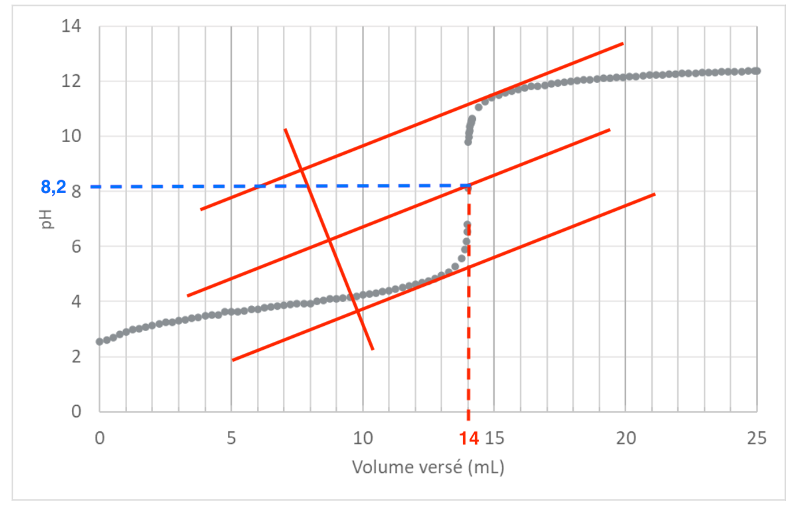
L’indicateur coloré doit changer de couleur à pHeq : il faut que pHeq soit dans sa zone de virage
On choisit le Rouge de crésol.
Partie B – Dégradation du PLA
L’acide polylactique (PLA) utilisé dans l’emballage est un polymère biodégradable et biosourcé dont la formule chimique est donnée ci-dessous (figure 2) :
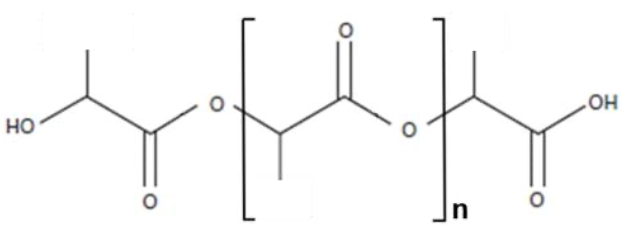
Figure 2 : Formule de l’acide polylactique (PLA)
La spectroscopie infrarouge est une méthode d’analyse fréquemment utilisée pour l’étude des polymères afin de déterminer, par exemple, la présence d’impuretés.
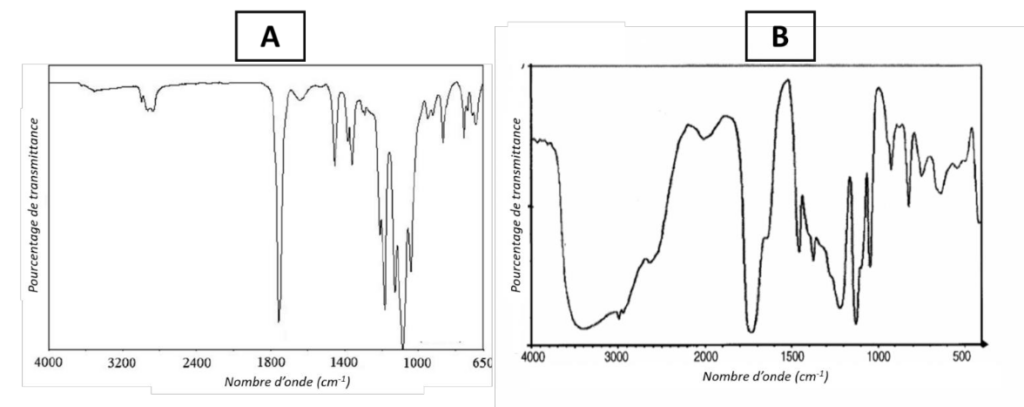
Figure 3 : Spectres infrarouge de l’acide lactique et du PLA
B.1. Attribuer chacun des deux spectres infrarouge A et B (figure 3) à une espèce chimique (acide lactique et PLA). Justifier la réponse.
Pour l’acide lactique (liaisons disponibles dans la table de nombres d’onde) :
- C=O : acide carboxylique : 1760 cm-1
- O-H : alcool en liaison hydrogène 3200 – 3550 cm-1
Pour le PLA (liaisons disponibles dans la table de nombres d’onde) :
- C=O : ester : 1735 – 1750 cm-1
Remarque : le PLA est essentiellement constitué du motif entre crochet qui se répète n fois, ainsi, les liaisons OH sur les bords de la molécule ne forment pas de lisions hydrogène.
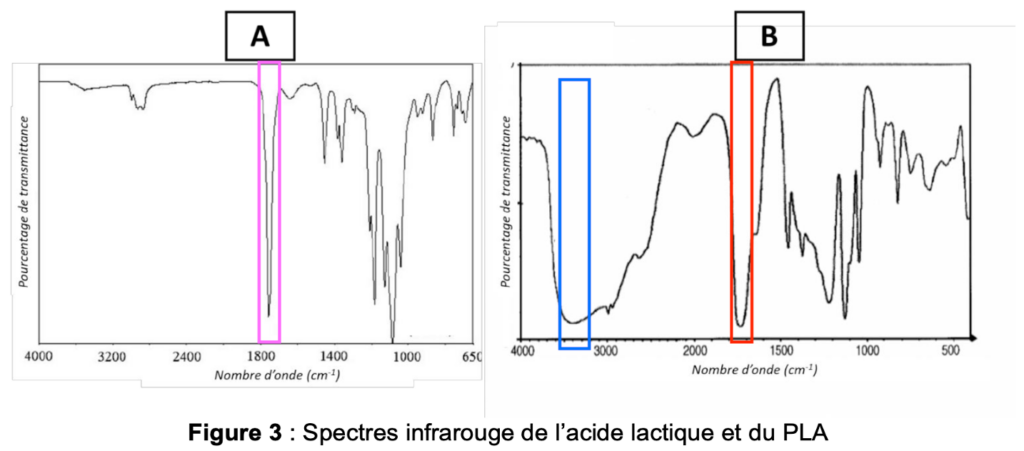
Le spectre A est celui du PLA et le spectre B celui de l’acide lactique.
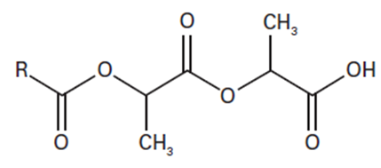
L’acide polylactique (PLA) se dégrade en présence d’eau en libérant de l’acide lactique selon la transformation modélisée par la réaction d’équation : A + H2O → B + acide lactique, avec :
A (PLA) :
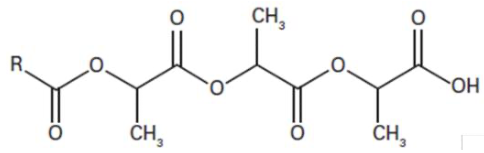
et B :
La cinétique de la transformation a été étudiée afin d’évaluer l’influence de la température (figure 4). La dégradation a été réalisée sous trois températures différentes avec une proportion en masse de PLA à l’état initial par rapport à l’eau de 10 %.
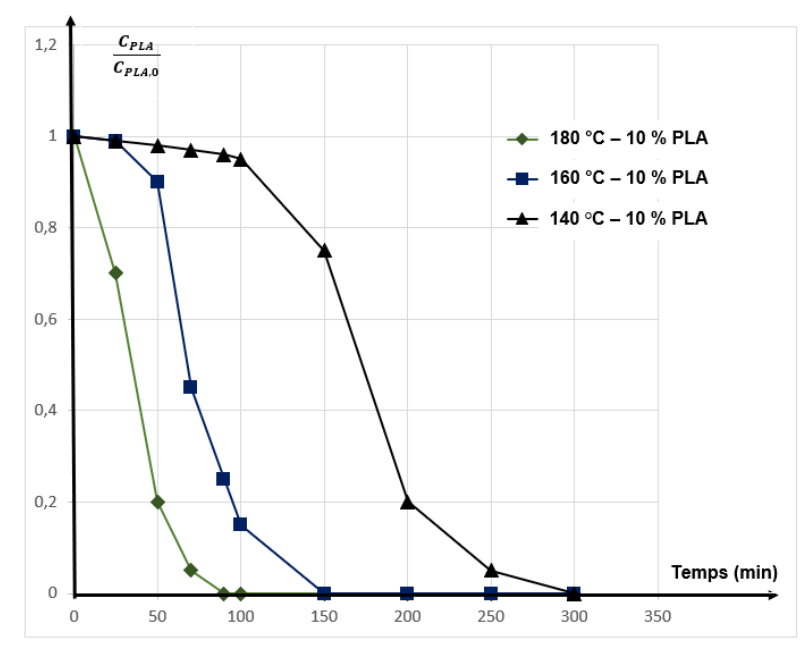
Figure 4 : Suivi de la concentration en masse de PLA au cours de la réaction
Source : d’après Kinetics of Hydrolytic Degradation of PLA, J. Polym. Environ., 2013
Le rapport $\frac{C_{PLA}}{C_{PLA,0}}$ correspond au rapport entre la concentration en masse de PLA au temps 𝑡 et la concentration en masse initiale.
B.2.1. Identifier, à partir de données expérimentales, un ou plusieurs facteurs cinétiques.
Les trois expériences ont été fait pour le même pourcentage de PLA et pour des températures différentes.
La figure 4 montre que plus la température est élevée, plus le PLA réagit rapidement.
La température est donc un facteur cinétique.
B.2.2. La vitesse de cette transformation augmente en milieu acide. En déduire le rôle joué par l’ion oxonium.
D’une part, la vitesse de cette transformation augmente en milieu acide (en présence d’ions oxoniums).
D’autre part les ions oxoniums n’apparaissent pas dans l’équation bilan de la réaction :
A + H2O → B + acide lactique.
L’ion oxonium est donc un catalyseur.
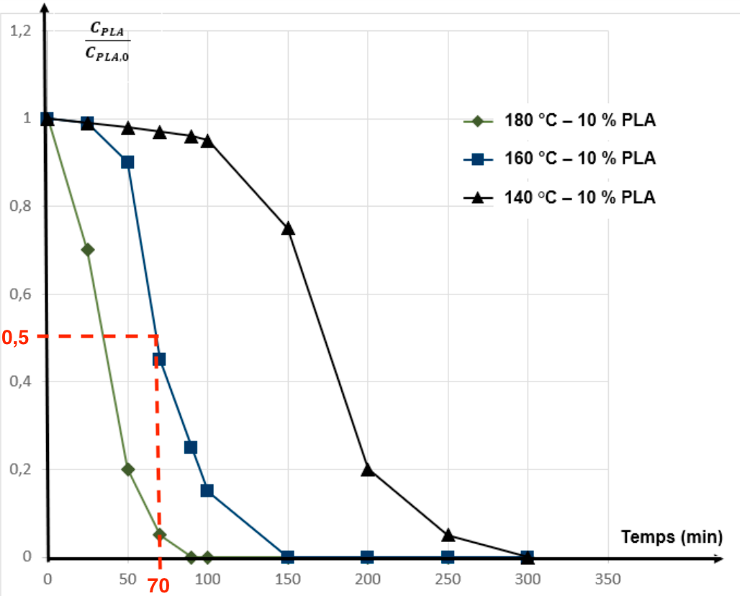
B.3.1. Évaluer le temps de demi-réaction 𝑡1/2 de cette transformation pour la température 𝜃 = 160 °C.
t1/2 est la durée nécessaire pour que l’avancement atteigne la moitié de sa valeur finale : x(t1/2) = xf/2.
On lit t1/2 lorsque : CPLA(t1/2)/CPLA,0 = 1/2.
t1/2 = 70 min
B.3.2. Indiquer qualitativement comment évolue le temps de demi-réaction pour 𝜃1 = 140 °C et pour 𝜃2 = 180 °C.
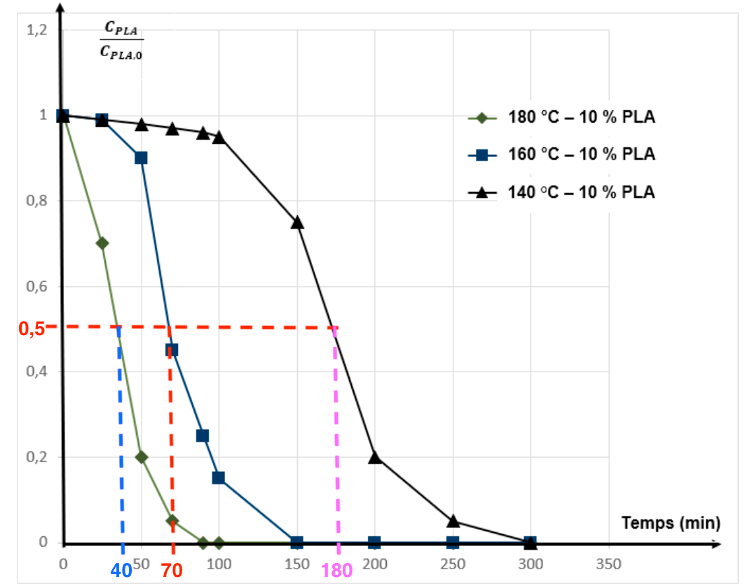
Pour 140°C : t1/2 = 180 min
Pour 180°C : t1/2 = 40 min
Le temps de demi réaction diminue lorsque la température augmente.
Le temps de demi réaction augmente lorsque la température diminue.
ANNEXE I À RENDRE AVEC LA COPIE (même non complétée)
EXERCICE I
Évolution du 𝒑𝑯 de la solution (S1) en fonction du volume de solution titrante (S2) versé
