E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02694
Télécharger l’exercice en PDF :
Le rayonnement solaire est indispensable à la synthèse de la vitamine D, essentielle pour la croissance, et il a des effets antidépressifs, mais son caractère nocif en cas d’exposition prolongée est aussi reconnu. La photoprotection désigne tous les moyens de protection contre les effets néfastes du rayonnement solaire.
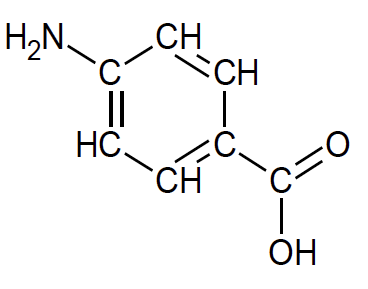
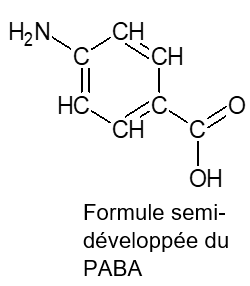
L’acide para-aminobenzoïque ou acide 4-aminobenzoïque, représenté ci-contre, a des propriétés de photoprotecteur. Il est nommé PABA (pour « para-aminobenzoic acid »).
Le rayonnement solaire qui atteint la Terre est composé de rayonnements infrarouges, de lumière visible et de rayonnements ultraviolets potentiellement nocifs, comme l’indique le tableau ci-après. Les crèmes de protection solaire qui contiennent des substances actives appelées filtres organiques agissent par absorption d’une partie des rayonnements ultraviolets. Le PABA est le plus ancien filtre organique. Utilisé dès le début des années 70 dans les crèmes solaires, il est résistant à l’eau et la transpiration. Cependant, en raison de son instabilité au soleil et de son potentiel allergisant, il a été peu à peu abandonné.
- Classification des rayonnements ultraviolets (ou UV) :
| UV | UVC | UVB | UVA |
| Filtrés par la couche d’ozone | totalement | partiellement | non |
| Gamme de longueur d’onde λ (nm) | < 280 | 280 – 315 | 315 – 400 |
| Danger | Coups de soleil Facteur principal de cancers de la peau | Vue (cataracte) Vieillissement de la peau Rôle dans l’apparition de cancers de la peau |
D’après fiches pratiques du DGCCRF et cosmeticobs.com
Dans cet exercice seront étudiés le rôle de PABA comme photoprotecteur et comme réactif pour produire une autre substance active utile pour soulager des « coups de soleil ».
Données :
- Masse molaire moléculaire : M(PABA) = 137 g·mol-1 M(éthanol) = 46 g·mol-1 ; M(benzocaïne) = 165 g·mol-1 ;
- Masse volumique : ρ(éthanol) = 0,79 g·mL-1
1. Protéger sa peau
L’acide para-aminobenzoïque est préconisé dans la prévention et le traitement de certaines maladies de la peau dues au soleil ; il est alors utilisé par voie interne, sous forme de comprimés à avaler, avant une exposition solaire, mais peut aussi être utilisé par voie externe dans une crème, pendant l’exposition.

On donne ci-dessous l’allure du spectre UV-visible du PABA en solution dans l’éthanol
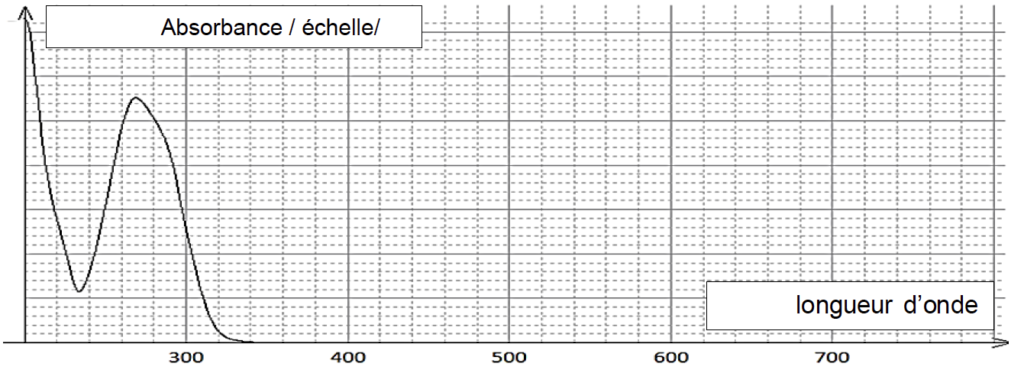
D’après J. Soc. Cosmet. Chem., 1987
1.1. Estimer la quantité de matière de PABA contenue dans un comprimé enrobé comportant 1000 mg de substance active.
$n=\frac{m}{M}$
$n=\frac{1000.10^{-3}}{137}=7,30.10^{-3}\ mol$
1.2. Indiquer si une solution de PABA dans l’éthanol est colorée. Justifier.
Le PABA n’absorbe aucun rayonnement dans le spectre visible (entre 400nm et 800nm). Ainsi elle est incolore.
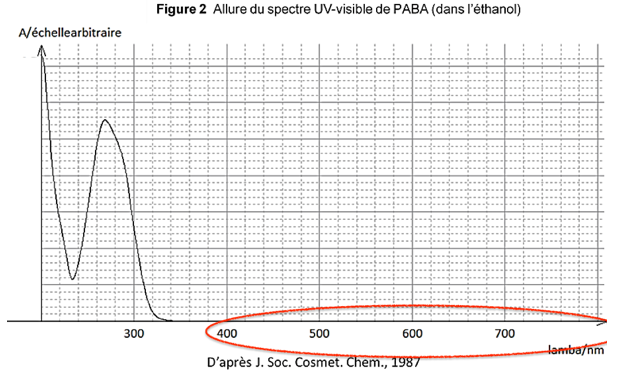
1.3. Justifier que le PABA est un filtre organique solaire.
Le PABA est une molécule organique car composée de carbone et d’hydrogène.
Le PABA absorbe des longueurs d’ondes comprissent entre 200nm et 320 nm. Cette gamme de longueur d’onde couvre les UVB. Ainsi le PABA est un filtre solaire.
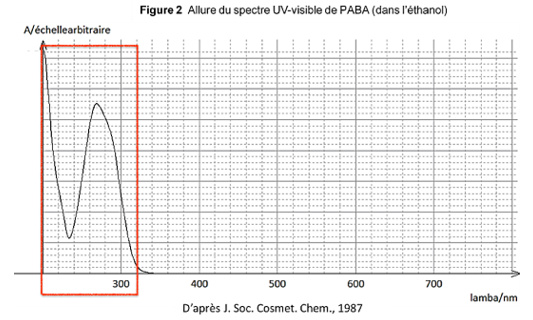
Le PABA est un donc filtre organique solaire.
2. Soulager sa peau
Le « coup de soleil » est une brûlure, généralement du premier degré, causée par une exposition prolongée au rayonnement solaire de la peau non protégée ; il peut être très douloureux. La benzocaïne est un anesthésique local pouvant être utilisé dans les médicaments soulageant les brûlures mineures.
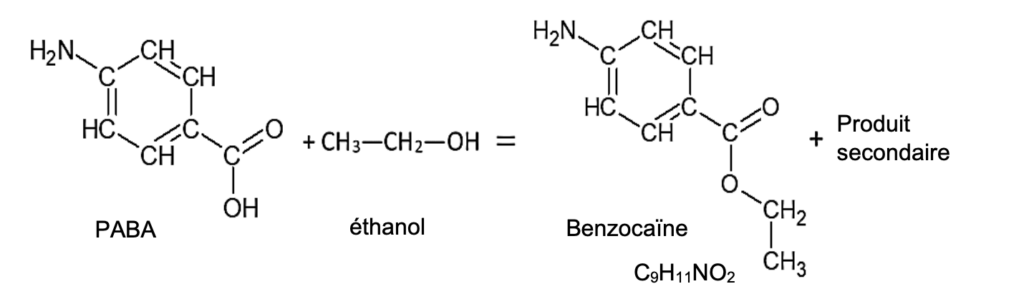
Sa synthèse au laboratoire peut s’effectuer à partir du PABA et elle est modélisée par la réaction d’équation suivante :
Le protocole expérimental mis en œuvre est le suivant.
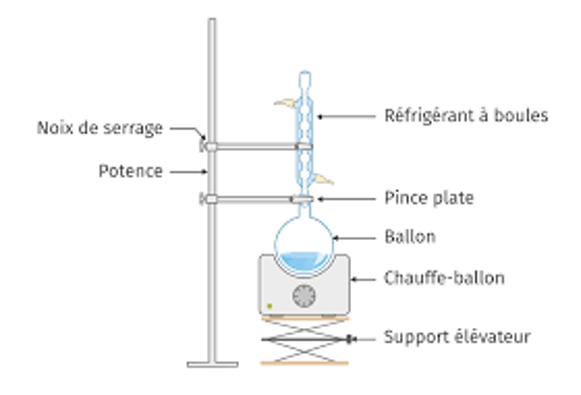
Dans un ballon de 100 mL introduire une masse mPABA= 1,50 g (10,9 mmol) de PABA et un volume V = 20 mL d’éthanol pur. Agiter jusqu’à dissolution du solide et ajouter, avec précaution, environ 2 mL d’acide sulfurique concentré. Adapter au ballon un réfrigérant à eau et porter le mélange au reflux pendant une heure. À la fin du chauffage, laisser revenir le mélange réactionnel à température ambiante […] D’après Bac2006, Bac2015 et Iftlm.fr
2.1. Réaction modélisant la synthèse de la benzocaïne
2.1.1. Justifier le nom éthanol associé au deuxième réactif.
Ethanol CH3-CH2-OH :
- éthan : 2 atomes de carbone
- ol : Présence d’un groupe OH (hydroxyle) de la famille des alcools
2.1.2. Ecrire l’équation de la synthèse de la benzocaïne en utilisant les formules brutes et en déduire quel est le produit secondaire accompagnant sa formation.

PABA : C7H7NO2
éthanol : C2H6O
Benzocaïne : C9H11NO2
C7H7NO2 + C2H6O = C9H11NO2 + Produit secondaire
Il y a conservation des éléments lors d’une réaction chimique.
| Atomes | Réactifs | Produits (sans le produit secondaire) |
| Carbone | 9 | 9 |
| Hydrogène | 13 | 11 |
| Azote | 1 | 1 |
| Oxygène | 3 | 2 |
Le produit secondaire est composé des atomes restants : 2 hydrogène et 1 oxygène.
La formule du produit secondaire est H2O.
2.1.3. Reproduire et compléter le tableau d’avancement suivant puis montrer que PABA est le réactif limitant.
| Équation de réaction | + = C9H11NO2 + | ||||
| Avancement (en mol) | Quantités de matière (en mol) | ||||
| État initial | 0 | 1,09×10-2 | 0 | ||
| État intermédiaire | X | ||||
Calculons la quantité initiale d’éthanol :
$n_{éthanol}^i=\frac{m_{éthanol}^i}{M_{éthanol}}$
Or
$m_{éthanol}^i=\rho_{éthanol}\times V_{éthanol}$
$n_{éthanol}^i=\frac{\rho_{éthanol}\times V_{éthanol}}{M_{éthanol}}$
$n_{éthanol}^i=\frac{0,79\times20}{46}=3,4.10^{-1}\ mol$
| Équation de réaction | C7H7NO2 | + C2H6O | =C9H11NO2 | + H2O | |
| Avancement (en mol) | Quantités de matière (en mol) | ||||
| État initial | 0 | 1,09.10-2 | 3,4.10-1 | 0 | 0 |
| État intermédiaire | X | 1,09.10-2-x | 3,4.10-1-x | x | x |
Pour déterminer le réactif limitant, calculons l’avancement maximal xmax :
$1,09.10^{-2}-x_{max1}=0 \Rightarrow x_{max1}=1,09.10^{-2}\ mol$
$3,4.10^{-1}-x_{max2}=0 \Rightarrow x_{max2}=3,4.10^{-1}\ mol$
$x_{max1}<x_{max2}$ , donc le PABA est le réactif limitant.
2.1.4. Déterminer la composition finale du système dans l’hypothèse d’une transformation totale.
Si la transformation est totale, $x_{max}=x_{max1}=1,09.10^{-2}\ mol$
| Équation de réaction | C7H7NO2 | + C2H6O | =C9H11NO2 | + H2O | |
| Avancement (en mol) | Quantités de matière (en mol) | ||||
| État initial | 0 | 1,09.10-2 | 3,4.10-1 | 0 | 0 |
| État intermédiaire | X | 1,09.10-2-x | 3,4.10-1-x | x | x |
| État final (si la transformation est totale) | xmax=1,09.10-2 | 1,09.10-2– xmax =1,09.10-2– 1,09.10-2 =0 | 3,4.10-1– xmax =3,4.10-1– 1,09.10-2– =3,3.10-1 | xmax=1,09.10-2 | xmax=1,09.10-2 |
2.2. Protocole et résultats
2.2.1. Schématiser et légender le schéma expérimental du montage à reflux de la photo ci-contre.

http://www.ostralo.net/materieldelabo/pages/reflux.htm
À la fin des étapes de transformation et isolement, un solide blanc qualifié de « produit brut » est obtenu. Ce solide est ensuite purifié par recristallisation, et la poudre cristallisée blanche obtenue est séchée et pesée. On obtient une masse de produit sec purifié de 0,81 g. Une chromatographie sur couche mince est effectuée et le chromatogramme obtenu après révélation est reproduit ci-après.
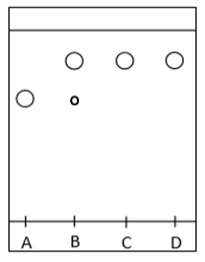
| Dépôt | Composé |
| A | PABA commercial |
| B | Produit brut |
| C | Produit recristallisé |
| D | Benzocaïne commerciale |
Mise en oeuvre de la CCM :
Les échantillons à étudier sont d’abord dissous dans l’éthanol.
Ils sont déposés sur la ligne de dépôt de la plaque recouverte de gel de silice.
La plaque est placée dans une cuve de chromatographie contenant l’éluant éthanoate d’éthyle.
La plaque est séchée puis révélée sous UV.
D’après Bac2006, Bac2015 et Iftlm.fr
2.2.2. Justifier que la recristallisation a été efficace.
| Dépôt | Composé |
| A | PABA commercial |
| B | Produit brut |
| C | Produit recristallisé |
| D | Benzocaïne commerciale |
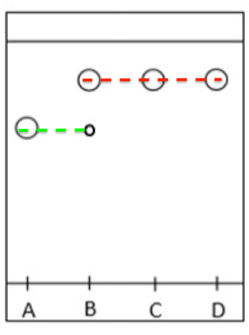
Le produit B (Produit brut) est composé de deux éléments : A (PABA) et D (Benzocaïne). Il n’est pas pur.
Le produit C (Produit recristallisé) est composé d’un seul éléments : D (Benzocaïne). Il est pur.
Ainsi la recristallisation a été efficace.
2.2.3. Déterminer la valeur du rendement de la synthèse. Commenter et proposer plusieurs hypothèses pouvant expliquer cette valeur.
Le rendement est défini par :
$\eta=\frac{m_{Experimentale}}{m_{Théorique}}$
$m_{Théorique}=n_{Théorique}\times M$
$m_{Théorique}=x_{max}\times M$
$m_{Théorique}=1,09.10^{-2}\times165=1,80\ g$
Donc
$\eta=\frac{m_{Experimentale}}{m_{Théorique}}=\frac{0,81}{1,80}=0,44=44%$
Le rendement est inferieur à 1 (ou 100%).
Voici les différentes hypothèses :
La réaction est limitée
La transformation n’est pas terminée
L’isolement du produit n’a pas été fait correctement
