E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02774, n°G1SPHCH02789 et n°G1SPHCH02806
Télécharger l’exercice en PDF :
Le menthol et la menthone sont deux espèces chimiques organiques présentes dans certaines espèces de menthe.
Le menthol (2-isopropyl-5-méthylcyclohexan-1-ol) est utilisé fréquemment dans les industries agroalimentaire, pharmaceutique et cosmétique.
La menthone (2-isopropyl-5-méthylcyclohenan-1-one) entre dans la composition de certains parfums et arômes naturels ; elle est obtenue par oxydation, en milieu acide, du menthol.
Dans cet exercice, on s’intéresse à la synthèse de la menthone à partir du menthol, réalisable au laboratoire du lycée.
| Menthol | Menthone | |
| Couleur | Blanche | Incolore |
| Masse molaire (g.mol-1) | 156 | 154 |
| Température de fusion (°C) | 43 | – 6,5 |
| Température d’ébullition (°C) | 212 | 209 |
Données :
| Solvant | Dichlorométhane | Cyclohexane | Ethanol | Eau |
| Densité | 1,33 | 0,78 | 0,79 | 1 |
| Miscibilité avec l’eau | Non miscible | Non miscible | Miscible | |
| Miscibilité avec l’éthanol | Non miscible | Non miscible | Miscible | |
| Solubilité du menthol à 25°C | Très soluble | Peu soluble | Soluble | Non soluble |
| Solubilité de la menthone à 25°C | Très soluble | Très soluble | Soluble | Non soluble |
Tableau de données de spectroscopie infrarouge (IR) :
| Liaison | Nombre d’onde (cm-1) | Intensité |
| O-H libre | 3500 – 3700 | Forte, fine |
| O-H liée | 3200-3400 | Forte, large |
| O-H acide carboxylique | 2500-3200 | Forte à moyenne, large |
| C-H | 2800-3000 | Forte |
| C=O aldéhyde et cétone | 1650-1730 | Forte |
| C=O acide carboxylique | 1680-1710 | Forte |
| C=C | 1640-1680 | Moyenne |
1. La formule semi-développée du menthol est représentée ci-après :
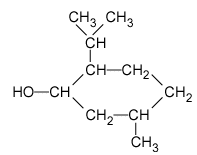
Justifier le fait que le menthol fasse partie de la famille des alcools.
Le menthol possède un groupe hydroxyle –OH, il fait donc parti de la famille des alcools.
2. Sachant que lors de l’oxydation ménagée du menthol en menthone seul le groupe caractéristique est modifié et que la menthone appartient à la famille des cétones, représenter la formule semi-développée de la molécule de menthone.
Le groupe hydroxyle -OH est modifié en carbonyle C=O (le carbone faisant 4 liaisons, il n’est plus lié à l’atome d’hydrogène)

3. L’oxydation du menthol en menthone s’effectue en milieu acide par l’ion permanganate $MnO_{4(aq)}^-$ qui appartient au couple oxydant-réducteur $MnO_{4(aq)}^-$$/Mn_{(aq)}^{2+}$. Cette oxydation est modélisée par une réaction dont l’équation est la suivante :
$2MnO_{4(aq)}^-$ $+ 5 C_9H_{18}CHOH_{(s)}$ + $6H_{(aq)}^{+}$ $\rightarrow$ $2 Mn_{(aq)}^{2+}$ $+ 5 C_9H_{18}CO_{(l)}$ $+ 8 H_2O_{(l)}$
Justifier le fait que le menthol subit une oxydation.
Menthone : C10H18O
Menthol : C10H20O
C10H20O = C10H18O + 2 e– + 2 H+
Le menthol perd des électrons, il subit donc une oxydation.
4. On réalise, au laboratoire du lycée, l’oxydation d’une masse m=15,6 g de menthol par un volume V=200 mL d’une solution aqueuse acide permanganate de potassium dont la concentration en ions permanganate est C=0,5 mol.L-1 . Le mélange est acidifié par quelques millilitres d’acide sulfurique concentré. Le dispositif expérimental utilisé est celui du chauffage à reflux.
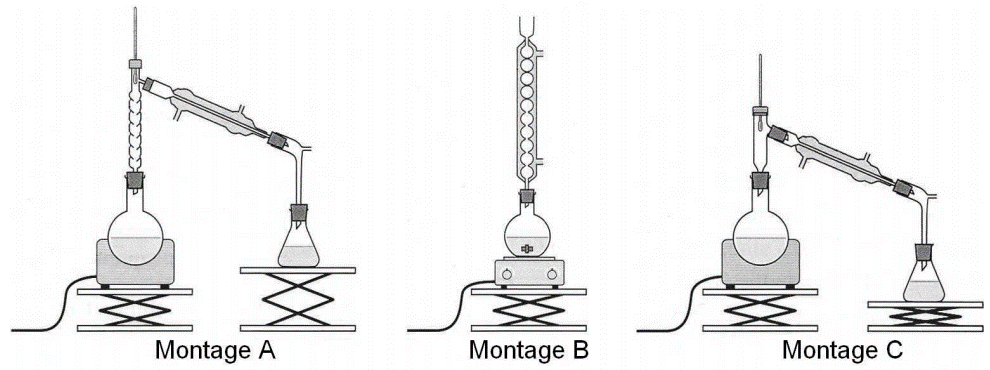
4.1. Parmi les montages A, B et C précédents, indiquer celui qu’il convient de choisir pour réaliser le chauffage à reflux.
Le chauffage à reflux est le montage B.
4.2. Expliquer le rôle des différents éléments de verrerie dans le montage à reflux.
Le ballon est le lieu où se déroule la réaction. Il est posé sur un chauffe ballon afin d’accélérer la réaction.
Le réfrigérant à boules permet de refroidir les vapeurs et ainsi les condenser (passage de gaz à liquide), ainsi la matière retourne dans le ballon : il permet de pas perdre de la matière.
4.3. En s’aidant éventuellement d’un tableau d’avancement, montrer que, lors de cette oxydation, le menthol est le réactif limitant.
Calculons les quantités initiales des réactifs :
$n_{MnO4^-}^i=C\times V=0,5\times200.10^{-3}=0,1\ mol$
$n_{menthol}^i=\frac{m}{M}=\frac{15,6}{156}=0,1\ mol$
| Équation chimique | 2MnO4–(aq) | + 5 C9H18CHOH(s) | + 6 H+(aq) | → 2 Mn2+(aq) | + 5C9H18CO(l) | +8H2O(l) | |
| État du système | Avancement (mol) | Quantités de matière | |||||
| État initial | 0 | 0,1 | 0,1 | Excès | 0 | 0 | Solvant |
| État intermédiaire | x | 0,1-2x | 0,1-5x | Excès | 2x | 5x | Solvant |
| État final | xmax | 0,1-2xmax | 0,1-5xmax | Excès | 2xmax | 5xmax | Solvant |
Calculons l’avancement maximal :
$0,1-2x_{max1}=0$
$x_{max1}=\frac{0,1}{2}=0,05\ mol$
$0,1-5x_{max2}=0$
$x_{max2}=\frac{0,1}{5}=0,02\ mol$
$x_{max}=x_{max2}=0,02\ mol$
Le menthol est le réactif limitant.
4.4. Déterminer la masse théorique maximum mth de menthone que l’on peut obtenir.
$m=n\times M$
Or d’après le tableau d’avancement de la question 4.2, $n_{Th}=5x_{max}$
$m_{Th}=5x_{max}\times M$
$m_{Th}=5\times0,02\times154=15,4 g$
5. On transvase le contenu du ballon dans une ampoule à décanter et on y ajoute 20 mL d’un solvant extracteur. On agite puis on laisse reposer. On observe la séparation de 2 phases, la phase organique surnageant.
Déterminer quel solvant, parmi le dichlorométhane, le cyclohexane, l’éthanol et l’eau, a été utilisé pour extraire la menthone du mélange réactionnel. Justifier.
Pour extraire une molécule, il faut que :
le solvant soit non miscible avec le solvant de dans laquelle la molécule est initialement présente (l’eau)
la molécule à extraire (la menthone) y soit plus soluble
Le dichlorométhane et le cyclohexane présentent ces deux caractéristiques.
Cependant « On observe la séparation de 2 phases, la phase organique surnageant », on en déduit que le solvant organique a une densité inférieure à l’eau.
C’est donc le cyclohexane qui a été utilisé.
6. La séparation de la menthone du solvant extracteur se fait en réalisant une distillation. En fin d’opération on obtient une masse mexp = 10,3 g de distillat que l’on considère être de la menthone pure. On réalise le spectre infrarouge du distillat ; il est reproduit ci-après.
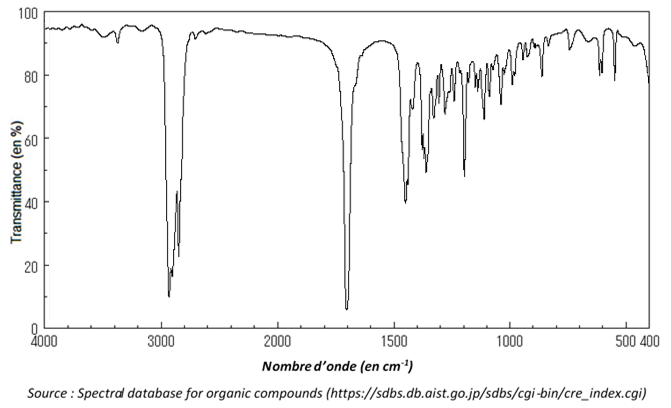
6.1. Justifier que le spectre précédent est compatible avec celui de la menthone.
La menthone possède un groupe C=O de la famille des cétones. D’après le tableau, le spectre doit présenter une bande de forte intensité entre 1650 et 1730 cm-1.
C’est le cas de notre spectre. Il est compatible avec celui de la menthone.
6.2. Déterminer le rendement de cette synthèse. Conclure.
Le rendement de cette synthèse est défini par :
$\eta=\frac{m_{exp}}{m_{Th}}$
$\eta=\frac{10,3}{15,4}=\frac{103}{154}=0,669$
$\eta=66,9%$
Conclusion : la réaction n’est pas totale
