E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02697, n°G1SPHCH02718 et n°G1SPHCH02728
Télécharger l’exercice en PDF :
Des élèves d’une classe de première réalisent la synthèse d’un savon.
Cet exercice a pour objectif d’étudier quelques caractéristiques des espèces chimiques mises en jeu lors de cette synthèse d’une part et d’analyser les différentes étapes du protocole d’autre part. Il s’intéresse enfin aux propriétés lavantes du savon.
Protocole de la synthèse d’un savon : l’oléate de sodium
Étape 1 : verser dans un ballon :
- 13,6 g d’huile d’olive (on considère que l’huile d’olive est de l’oléine pure) ;
- 20 mL d’éthanol ;
- 20,0 mL de soude à 10 mol∙L-1 (en excès) ;
- quelques grains de pierre ponce.
Étape 2 : chauffer à reflux le mélange réactionnel pendant 20 minutes environ.
Étape 3 : laisser refroidir le mélange quelques minutes puis le verser dans un bécher contenant 200 mL d’une solution aqueuse concentrée de chlorure de sodium.
Étape 4 : le précipité obtenu, l’oléate de sodium, est le savon. Il est filtré, rincé à l’eau salée, séché, puis pesé.
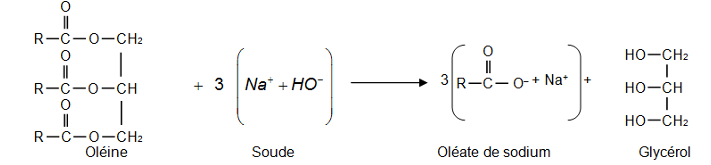
Équation de la réaction modélisant la synthèse de l’oléate de sodium
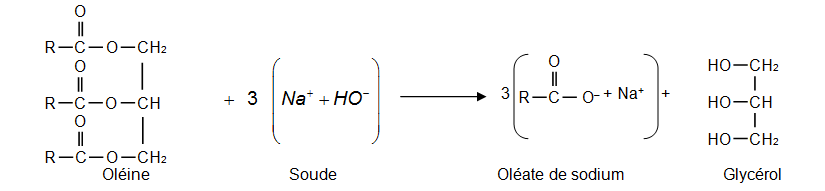
Dans les représentations semi-développées ci-dessus, les chaînes carbonées sont représentées par le symbole « R » ; R est un groupe qui contient 17 atomes de carbone reliés entre eux.
Données :
- numéro atomique Z de quelques éléments : H : 1 ; O : 8 ; Na : 11 ;
- électronégativité χ de quelques éléments selon l’échelle de Pauling : H : 2,2 ; O : 3,5 ; Na : 0,9 ;
- masses molaires en g∙mol–1 : M(oléine) = 884 ; M(hydroxyde de sodium) = 40 ;
M(oléate de sodium) = 304 ;
- L’huile est peu soluble dans les solvants polaires alors que les espèces ioniques y sont généralement très solubles :
| Oléine | Hydroxyde de sodium (soude) | Oléate de sodium (Savon) | |
| Solubilité dans l’eau | insoluble | soluble | soluble |
| Solubilité dans l’éthanol | soluble | soluble | soluble |
| Solubilité dans l’eau salée | insoluble | soluble | peu soluble |
1. Espèces chimiques mises en jeu dans la synthèse du savon
1.1. L’eau
1.1.1. Établir le schéma de Lewis de la molécule d’eau en déterminant au préalable le nombre total d’électrons de valence.
1H : 1s1 donc 1 électron de valence
8O : 1s2 2s2 2p4 donc 6 électrons de valence
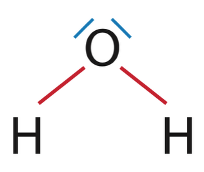
1.1.2. Interpréter la géométrie coudée de cette molécule.
Il y a 2 doublets liants et 2 doublets non liants autour de l’atome central.
Ces doublets se disposent de autour de l’atome central afin que la répulsion entre les doublets soit minimale. Cependant la répulsion entre les entre les doublets non liants étant plus importante que la répulsion entre les doublets liants. C’est pourquoi la géométrie de la molécule d’eau est coudée.
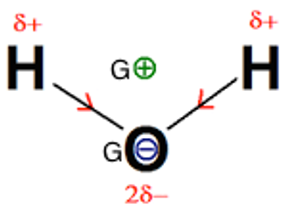
1.1.3. En déduire le caractère polaire ou apolaire de la molécule d’eau en justifiant votre réponse.
χO> χH Les liaisons OH sont polarisés.
Le barycentre (centre géométrique) des charges positives G+ est différent du barycentre des charges négatives G-.
La molécule est donc polaire
1.1.4. Justifier que l’huile ne soit pas soluble dans l’eau.
L’huile est constituée de longues chaines carbonées qui sont apolaires. La molécule est apolaire et donc n’est pas soluble dans l’eau qui est polaire.
1.2. La soude
La soude est une solution aqueuse d’hydroxyde de sodium. Elle est obtenue dans le cas de cette synthèse par dissolution dans l’eau d’un échantillon d’hydroxyde de sodium NaOH solide de masse m = 400 g pour obtenir un volume V = 1,0 L de solution.
1.2.1. Exprimer, puis calculer la concentration en quantité de matière en soluté apporté de la solution de soude.
$C=\frac{\operatorname{n}}{V}$
Or $n=\frac{\operatorname{m}}{M}$
D’ou
$C=\frac{\operatorname{m}}{M\times V}=\frac{400}{40\times1,0}=10\ \text{mol}.\operatorname{L}^{-1}$
1.2.2. Écrire l’équation de la réaction qui modélise la dissolution de l’hydroxyde de sodium solide NaOH(s) dans l’eau.
NaOH(s) → Na+(aq) + HO–(aq)
1.2.3. Exprimer puis calculer les concentrations en quantités de matière effectives des ions présents dans la solution de soude.
$\left[{\rm \operatorname{Na}}^+\right]=C=10\ \text{mol}.\operatorname{L}^{-1}$
$\left[{\rm \operatorname{HO}}^-\right]=C=10\ \text{mol}.\operatorname{L}^{-1}$
2. Analyse du protocole de synthèse du savon
2.1. Étude qualitative à partir des données fournies
2.1.1. Préciser le rôle de l’éthanol dans l’étape 1 en justifiant votre réponse.
L’éthanol joue le rôle de solvant. En effet l’oléine y est soluble et l’eau et l’éthanol sont miscibles (l’éthanol possède un groupe hydroxyde et fait donc des lisions hydrogènes avec l’eau).
2.1.2. Après le chauffage, on réalise les deux étapes suivantes décrites sur la figure 3 ci-dessous :
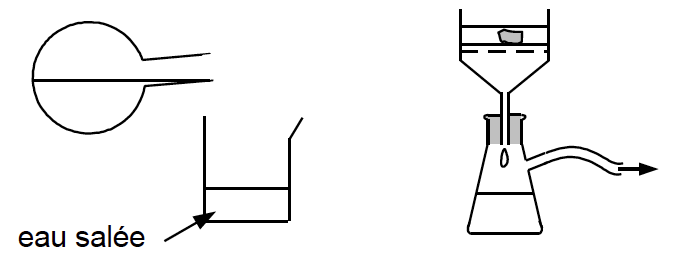
Justifier l’utilisation d’eau salée dans l’étape 3 et indiquer le nom du dispositif utilisé à l’étape 4 et son intérêt.
L’oléate de sodium (Savon) est soluble dans l’eau mais il est peu soluble dans l’eau salée. L’utilisation d’eau salée dans l’étape 3 permet son extraction.
Le dispositif utilisé à l’étape 4 est Filtration Büchner. Son intérêt est d’être plus efficace qu’une filtration simple.
2.2. Étude quantitative
On cherche à déterminer le rendement de la synthèse du savon. La masse du savon obtenu est égale à mexp = 10,5 g.
2.2.1. Vérifier que la soude est le réactif introduit en excès.
Calculons les quantités initiales des réactifs :
$n_{\text{oléine}}^i=\frac{m_{\text{oléine}}}{M_{\text{oléine}}}=\frac{13,6}{884}=1,54.10^{-2}\ \text{mol}$
$\operatorname{n}_{\operatorname{soude}}^i=C\times V=10\times20,0.10^{-3}=2,0.10^{-1}\ \text{mol}$
Calculons $x_{max}$
$\operatorname{x}_{max1}=n_{\text{oléine}}^i=1,54.10^{-2}\ \text{mol}$
$\operatorname{x}_{max2}=\frac{\operatorname{n}_{\operatorname{soude}}^i}{3}=\frac{2,0.10^{-1}}{3}=6,7.10^{-2}\ \text{mol}$
$\operatorname{x}_{max1}<\operatorname{x}_{max2}$
$\operatorname{x}_{max}=\operatorname{x}_{max1}$
La soude est le réactif introduit en excès.
2.2.2. Déterminer le rendement de cette synthèse. Commenter.
| Équation | |||||
| État initial | x=0 mol | 1,54.10-2 | 2,0.10-1 | 0 | 0 |
| État intermédiaire | x | 1,54.10-2 –x | 2,0.10-1-3x | 3x | x |
| État final | x=xf | 1,54.10-2 –xf | 2,0.10-1-3xf | 3xf | xf |
$\eta=\frac{\operatorname{m}{exp}}{\operatorname{m}{Th}}$
Or
$\operatorname{m}{Th}=\operatorname{n}{Th}\times M$
$\operatorname{m}{Th}=3\operatorname{x}{max}\times M$
$\operatorname{m}{Th}=3\times1,54.10^{-2}\times304$
$\operatorname{m}{Th}=14\ g$
$\eta=\frac{10,5}{14}=0,75=75%$
Le rendement est de 75% : la réaction est limitée.
3. Propriétés lavantes d’un savon
On s’intéresse désormais aux propriétés lavantes d’un savon.
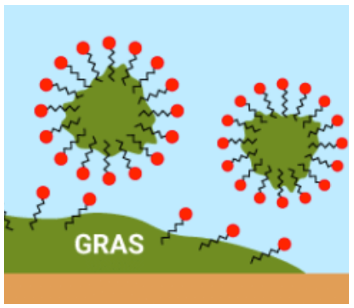
On peut représenter schématiquement l’ion oléate, l’ion actif du savon de la façon suivante :

Figure 4. Représentations schématiques de l’ion oléate
3.1 Caractériser les parties 1 et 2 des schémas de l’ion de la figure 4 à l’aide du vocabulaire suivant : hydrophile, hydrophobe, lipophile, lipophobe.
Partie 1 : hydrophobe et lipophile
Partie 2 : hydrophile et lipophobe
3.2 En déduire, parmi les schémas 5.a et 5.b de la figure 5, celui qui peut expliquer le mode d’action d’un savon. Décrire en un schéma et/ou une ou deux phrases l’étape suivante menant à l’élimination de la tache de graisse lors du lavage par du savon.
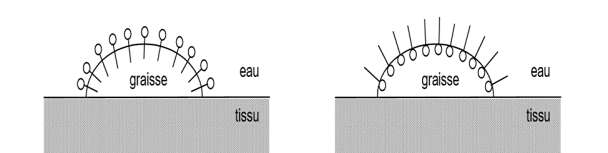
Schéma 5.a. —————————————————- Schéma 5.b.
Figure 5
La partie 1 qui est hydrophobe et lipophile elle est donc dans la graisse et la partie 2 qui est hydrophile et lipophobe est donc dans l’eau. C’est donc le Schéma 5.a.
Le savon pénètre dans la graisse par sa partie lipophile. La partie 2 se lie à l’eau et entraine avec elle la graisse. Cela conduit à l’élimination de la tache de graisse lors du lavage par du savon.