E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02709, n°G1SPHCH02721, n°G1SPHCH02732 et n°G1SPHCH02807
Télécharger l’exercice en PDF :
Communément appelée « eau oxygénée », la solution aqueuse antiseptique est utilisée, notamment pour détruire les virus, champignons et bactéries. Son principe actif est le peroxyde d’hydrogène, de formule brute H2O2.
Le but de cet exercice est de vérifier les indications figurant sur l’étiquette d’une solution commerciale d’eau oxygénée.
Etiquette d’une solution commerciale d’eau oxygénée S :

Données
- Masse Molaire Moléculaire du peroxyde d’hydrogène : M(H2O2) = 34 g.mol-1
- Le peroxyde d’hydrogène H2O2 contenu dans l’eau oxygénée peut être oxydé par les ions permanganates MnO4 – suivant la réaction d’oxydoréduction dont l’équation est la suivante :
2 MnO4 –(aq) + 6 H+(aq) + 5 H2O2(aq) -> 2 Mn2+(aq) + 8 H2O(l) + 5 O2(g)
- Couples d’oxydoréduction mis en jeu : MnO4 – (aq) / Mn2+(aq) O2 (g) / H2O2 (l)
- Le titre T d’une eau oxygénée exprime le volume de dioxygène que peut libérer un litre d’eau oxygénée en volume: En effet, l’eau oxygénée en réagissant avec elle-même, libère du dioxygène gazeux selon l’équation :
2 H2O2(aq) -> 2 H2O(l) + O2(g)
Lors de cette réaction, H2O2 joue à la fois le rôle d’oxydant et de réducteur.
Le titre T est donnée par la relation : $\frac{C.V_m}{2}$
avec T : titre, C : concentration en quantité de matière en mol.L-1 et Vm = 22,4 L.mol-1 : volume molaire d’un gaz (dans les conditions normales de température et de pression)
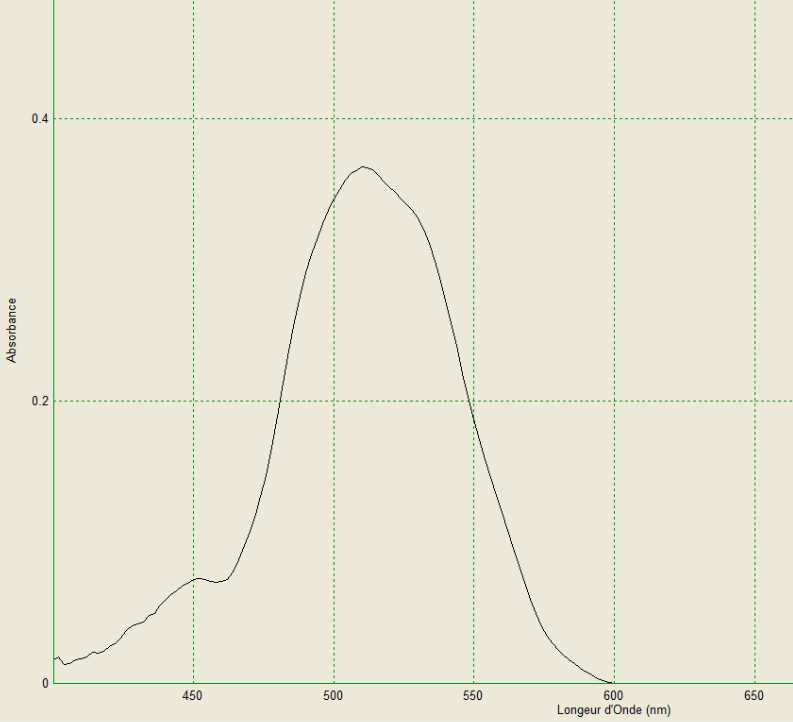
- Spectre d’absorption obtenu au laboratoire d’une solution aqueuse de permanganate de potassium :
1. Préparation de la solution à titrer
Afin de procéder au titrage du peroxyde d’hydrogène contenue dans la solution commerciale par les ions permanganate, la solution commerciale S est diluée dix fois pour obtenir la solution S’.
1.1. Rédiger précisément le protocole à suivre pour réaliser cette dilution.
Pour diluer 10 fois il faut que le volume de la solution fille soit 10 fois supérieur au volume de la solution mère.
Protocole :
- On prélève, à l’aide d’une pipette jaugée un volume de 10,0 mL
- On l’introduit dans une fiole jaugée de 100 mL
- On complète avec de l’eau distillé jusqu’au trait de jauge et on homogénéise.
1.2. Seuls les ions permanganate sont colorés en solution aqueuse. Justifier cette propriété et préciser la couleur de ces ions en solution aqueuse.
Nous remarquons sur le spectre d’absorption obtenu au laboratoire d’une solution aqueuse de permanganate de potassium que la solution absorbe dans le visible : λmax=510nm.
La couleur absorbée est le vert. La couleur de la solution est la couleur complémentaire soit le magenta.
2. Titrage du peroxyde d’hydrogène par les ions permanganate
Il est procédé au titrage d’oxydoréduction suivi par colorimétrie de V’=20,0 ± 0,05 mL de la solution S’ par une solution de permanganate de potassium de concentration en quantité de matière égale à C0 = (5,00 ± 0,2).10-2 mol.L-1. Lors de ce titrage colorimétrique, le volume obtenu à l’équivalence est de Véq = 13,7 ± 0,05 mL.
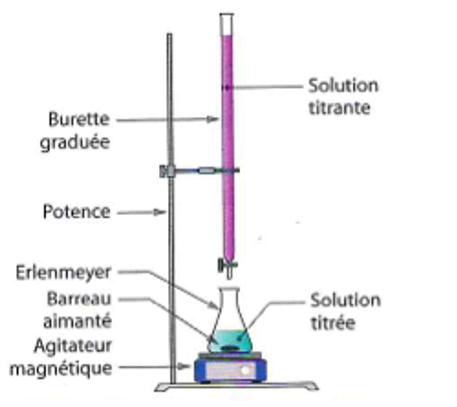
2.1. Schématiser le montage expérimental utilisé en le légendant.
2.2. Écrire les demi-équations électroniques mises en jeu lors du titrage permettant de retrouver l’équation de la réaction d’oxydoréduction support du titrage.
MnO4– (aq) / Mn2+(aq) $2\times\ {\rm MnO}_{4(aq)}^-+5\operatorname{e}^-+8\operatorname{H}^+={\rm Mn}{(aq)}^{2+}+4\operatorname{H}_2\operatorname{O}{(l)}$
O2 (g) / H2O2 (l) $5\times\operatorname{H}_2{\operatorname{O}_2}{(l)}={\operatorname{O}_2}{(g)}+2\operatorname{H}^++2\operatorname{e}^-$
$2\ \operatorname{MnO}_4\ -\ (aq)\ \ +\ \ 16\ \operatorname{H}^+(aq)\ \ +\ 5\ \operatorname{H}_2\operatorname{O}_2(aq)\ \ ->\ \ \ 2\ \operatorname{Mn}^{2+}(aq)\ \ +\ \ 8\ \operatorname{H}_2\operatorname{O}(l)\ \ +\ 5\ \operatorname{O}_2(g)\ +\ \ 10\ \operatorname{H}^+(aq)$
$2\ \operatorname{MnO}_4\ -\ (aq)\ \ +\ \ 6\ \operatorname{H}^+(aq)\ \ +\ 5\ \operatorname{H}_2\operatorname{O}_2(aq)\ \ ->\ \ \ 2\ \operatorname{Mn}^{2+}(aq)\ \ +\ \ 8\ \operatorname{H}_2\operatorname{O}(l)\ \ +\ 5\ \operatorname{O}_2(g)$
2.3. Définir l’équivalence et donner, à l’équivalence, la relation entre les quantités de matière des ions permanganate introduits n(MnO4–(aq)) et du peroxyde d’hydrogène n(H2O2(aq)) initialement présent dans l’échantillon titré.
On atteint l’équivalence, lorsqu’on a réalisé un mélange stœchiométrique des deux réactifs qui sont alors totalement consommés.
$\frac{{\operatorname{n}^i(\operatorname{H}}_2{\operatorname{O}_2}{(l)})}{5}=\frac{{\operatorname{n}^{eq}(\operatorname{MnO}}_{4(aq)}^-)}{2}$
2.4. Comment l’équivalence est-elle repérée lors de ce titrage ?
Au début de la réaction, H2O2 présent dans l’erlenmeyer constituent le réactif en excès et les ions permanganates le réactif en défaut. Avant l’équivalence, chaque goutte de permanganate de potassium est consommée, la solution reste incolore.
Cependant, une goutte après l’équivalence, la solution se teint légèrement en violet car les ions permanganate ne sont plus consommés.
2.5. Déterminer C’, la concentration en quantité de matière du peroxyde d’hydrogène de la solution S’.
$\frac{{n(\operatorname{H}}_2{\operatorname{O}_2}{(l)})}{5}=\frac{{n(\operatorname{MnO}}_{4(aq)}^-)}{2}$
$\frac{C^\prime\times V\prime}{5}=\frac{\operatorname{C}_0\times\operatorname{V}_{eq}}{2}$
$C^\prime=\frac{{5\times\operatorname{C}}_0\times\operatorname{V}_{eq}}{2\times V\prime}$
$\operatorname{C}^\prime=\frac{5\times5,00.10^{-2}\times13,7.10^{-3}}{2\times20,0.10^{-3}}=8,56.10^{-2}mol.\operatorname{L}^{-1}$
2.6. L’incertitude relative sur C vaut U(C)=0,034 mol.L-1.Proposer un encadrement de la concentration en quantité de matière C du peroxyde d’hydrogène de la solution commerciale S.
La solution S’ a été obtenue en diluant 10 fois la solution commerciale.
$C=10\ \times \operatorname{C}^\prime$
$C=10\ \times 8,56.10^{-2}=8,56.10^{-1}mol.\operatorname{L}^{-1}$
$C=0,856\pm0,034\ mol.\operatorname{L}^{-1}\ $
$0,856-0,034\ <C<0,856+0,034\ $
$0,822\ mol.\operatorname{L}^{-1}<C<0,890\ mol.\operatorname{L}^{-1}$
3. Conformité de la solution avec les indications de l’étiquette
3.1. Vérifier que la concentration Cétiquette en quantité de matière du peroxyde d’hydrogène indiquée sur l’étiquette correspond à 0,89 mol.L-1.
1ere méthode :
$C=\frac{2\operatorname{T}}{\operatorname{V}_m}=\frac{2\times10}{22,4}=0,89\ mol.\operatorname{L}^{-1}$
2nd méthode :
D’après l’étiquette : peroxyde d’hydrogène stabilisé 3,0000g pour 100mL
$C=\frac{\operatorname{n}}{V}$ or $n=\frac{\operatorname{m}}{M}$
d’ou
$C=\frac{\operatorname{m}}{M\timesV}$
$C=\frac{3,0000}{34,0\times100.10^{-3}}=0,88\ mol.\operatorname{L}^{-1}$
3.2. Les indications de l’étiquette correspondent-elles à la solution commerciale analysée ?
Les deux valeurs sont en accord. Les indications de l’étiquette correspondent à la solution commerciale analysée.
4. Efficacité d’une bouteille d’eau oxygénée ouverte depuis plusieurs mois
Une bouteille d’eau oxygénée a été ouverte depuis plusieurs mois. L’eau oxygénée peut réagir avec le dioxygène de l’air et perdre ainsi toute ou une partie de ses propriétés antiseptiques. On considère que l’eau oxygénée est encore efficace pour désinfecter les plaies si son titre est au moins égal à 0,5 volume.
Le protocole de titrage est reproduit sans diluer la solution d’eau oxygénée et le volume équivalent obtenu est alors Veq = 4,32 mL.
La solution contenue dans cette bouteille est-elle encore efficace ?
Le protocole de titrage est reproduit sans diluer la solution d’eau oxygénée. D’après la relation trouvée à la question 2.5 :
$C=\frac{{5\times \operatorname{C}}_0\times \operatorname{V}_{eq}}{2\times V}$
$C=\frac{5\times 5,00.10^{-2}\times4,32.10^{-3}}{2\times20,0.10^{-3}}=2,7.10^{-2}mol.\operatorname{L}^{-1}$
Calculons le titre :
$T=\frac{C.\operatorname{Vm}}{2}\ $
$T=\frac{2,7.10^{-2}\times22,4}{2}=0,30$
On considère que l’eau oxygénée est encore efficace pour désinfecter les plaies si son titre est au moins égal à 0,5 volume.
Donc cette eau oxygénée n’est plus efficace.
