E3C2 – 10 points – Durée 1h – calculatrice autorisée
Sujet n°G1SPHCH02787, n°G1SPHCH02797, n°G1SPHCH02801 et n°G1SPHCH02809
Télécharger l’exercice en PDF :
Afin d’alimenter le moteur de l’assistance d’un vélo électrique, un spécialiste propose plusieurs batteries lithium–ion. Elles délivrent toutes une tension nominale de 36 V. En revanche leurs capacités varient de 8,7 A.h à 17,4 A.h en fonction du modèle choisi.
Cette partie aborde trois thèmes :
- le fonctionnement d’une batterie lithium-ion ;
- le bilan énergétique pour une batterie de 14,5 A.h ;
- la transformation du glucose dans le muscle ;
Données :
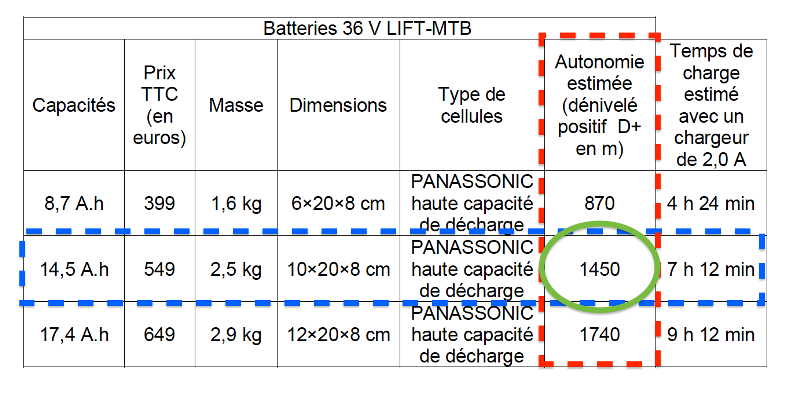
- Caractéristique de quelques batteries lithium-ion de tension nominale 36 V :
| Batteries 36 V LIFT-MTB | ||||||
| Capacités | Prix TTC (en euros) | Masse | Dimensions | Type de cellules | Autonomie estimée (dénivelé positif D+ en m) | Temps de charge estimé avec un chargeur de 2,0 A |
| 8,7 A.h | 399 | 1,6 kg | 6×20×8 cm | PANASSONIC haute capacité de décharge | 870 | 4 h 24 min |
| 14,5 A.h | 549 | 2,5 kg | 10×20×8 cm | PANASSONIC haute capacité de décharge | 1450 | 7 h 12 min |
| 17,4 A.h | 649 | 2,9 kg | 12×20×8 cm | PANASSONIC haute capacité de décharge | 1740 | 9 h 12 min |
https://www.lift-mtb.com/shop/batteries-et-chargeurs/
- Table de données pour la spectroscopie IR :
| Liaison | nombres d’onde (cm-1) | Intensité |
| C = O aldéhyde et cétone | 1650 – 1730 | Forte |
| C = O acide carboxylique | 1680 – 1710 | Forte |
| Ctri – H | 2800 -3100 | Plusieurs bandes |
| O – Hlié O – Hlibre | 3200 – 3400 3580 – 3650 | Bande large Bande fine |
| O–H acide carboxylique | 2500 – 3200 | Bande large |
- Masse du système « cycliste + vélo » : 90 kg ;
- 1 cal = 4,18 J ;
- Volume molaire dans les conditions de l’expérience (T =20°C et P = 101 325 Pa): Vm= 24,0 L.mol-1 ;
- Masse molaire du glucose : M = 180,0 g.mol-1 ;
- Intensité du champ de pesanteur : g = 9,8 m.s-2
I. Fonctionnement d’une batterie lithium-ion.
Le courant électrique à l’extérieur de la batterie lithium-ion est engendré par la circulation d’électrons entre les deux électrodes de la batterie :
- une électrode négative qui est le siège de la réaction électrochimique suivante :
Li → Li++ e–
- une électrode positive qui est le siège de la réaction électrochimique suivante:
CoO2 + Li++ e– → LiCoO2
Li symbolise l’élément lithium et Co l’élément cobalt.
Lors du fonctionnement de la batterie, les ions Li+ traversent le séparateur suivant le sens des flèches représenté dans le schéma ci-dessous.
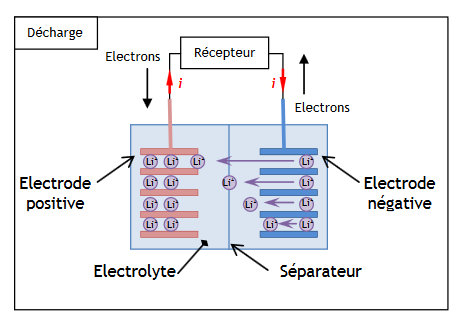
1. Quel est le couple oxydant-réducteur mis en jeu à l’électrode négative ?
« Une électrode négative qui est le siège de la réaction électrochimique suivante : Li → Li++ e– »
Un couple oxydant réducteur s’écrit : Ox/Red
Un oxydant est une espèce qui est capable de gagner des électrons.
Le couple est : Li+/Li
2. La réaction électrochimique à cette électrode est-elle une oxydation ou une réduction ? Justifier.
Lors de la réaction Li → Li++ e– le réducteur se transforme en oxydant, il y a une perte d’électron , c’est une oxydation.
II. Bilan énergétique pour une batterie de 14,5 A.h.
3. Déterminer la valeur de l’énergie potentielle de pesanteur emmagasinée par le système « vélo électrique + cycliste » lorsque le cycliste effectue le dénivelé ascensionnel positif maximal correspondant à l’autonomie de la batterie.
Pour une batterie de 14,5 A.h , le dénivelé ascensionnel positif maximal correspondant à l’autonomie de la batterie z=1450 m
$E_{pp}=mgz$
$E_{pp}=90\times9,8\times1450$
$E_{pp}=1,28.10^6J$
4. D’après les données constructeur, ce type de batterie délivre au maximum une énergie maximale Emax = 1,88.106 J.
4.1. En théorie, Emax permet-elle d’effectuer le dénivelé ascensionnel indiqué ?
Emax>Epp donc en théorie, Emax permet d’effectuer le dénivelé ascensionnel indiqué.
4.2. Dans les conditions réelles, un cycliste en forme moyenne doit fournir en pédalant 50% de l’énergie nécessaire à l’ascension. Pourquoi faut-il apporter une énergie supérieure à l’énergie potentielle de pesanteur pour réaliser l’ascension ?
Il faut apporter une énergie supérieure à l’énergie potentielle de pesanteur pour réaliser l’ascension car il y a de l’énergie dissipée : frottements de l’air, frottements du sol…
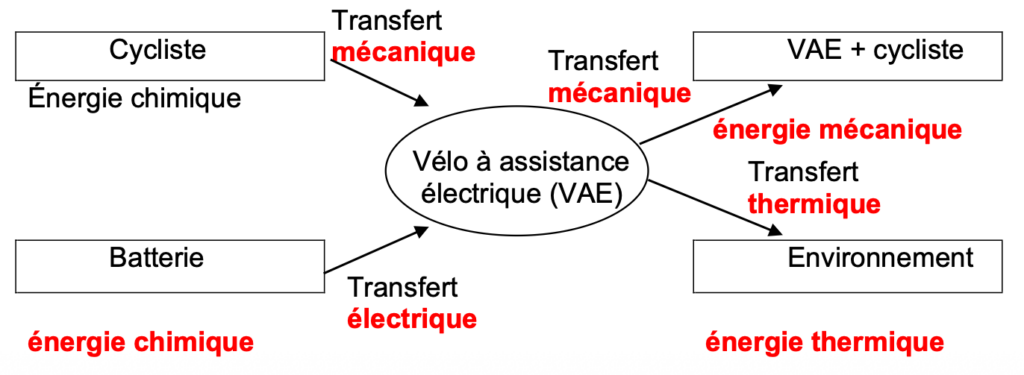
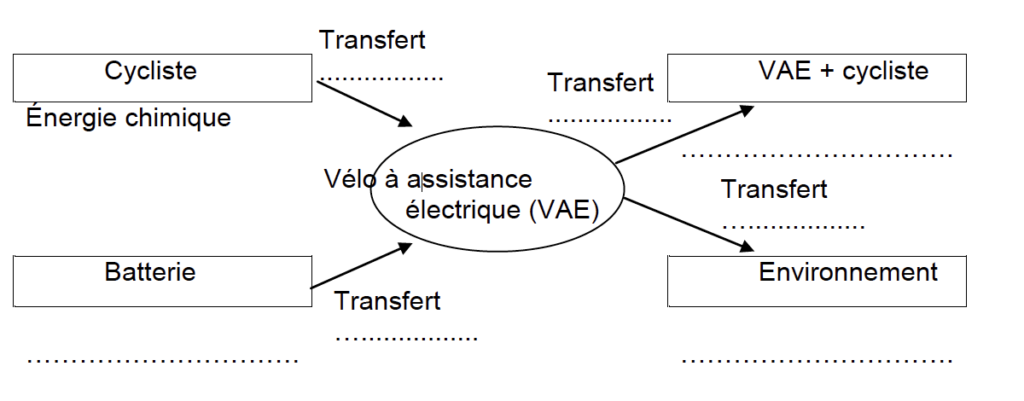
5. Compléter la chaîne énergétique en annexe à rendre avec la copie à l’aide des mots suivants : transfert thermique ; transfert mécanique ; transfert électrique ; énergie chimique ; énergie mécanique ; énergie thermique.
III. Transformation du glucose dans le muscle : comment le muscle du cycliste produit-il de l’énergie ?
Au cours de l’effort sportif, le glucose est dégradé par l’organisme en acide pyruvique. Selon les conditions d’oxygénation du cycliste, l’acide pyruvique sera dégradé à son tour soit en dioxyde de carbone et en eau (en milieu aérobie), soit en acide lactique (en milieu anaérobie).
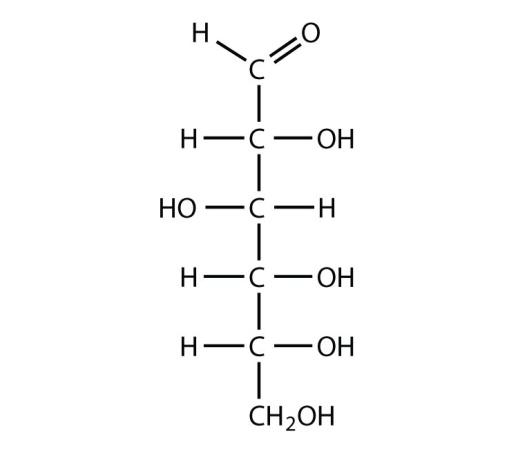
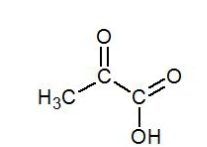
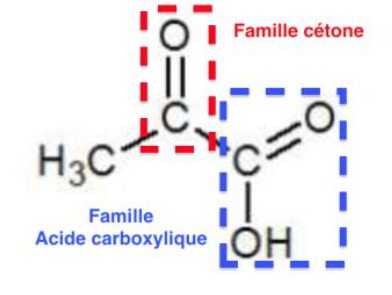
6. Quel est le nom des familles de fonctions correspondant aux deux groupes caractéristiques de l’acide pyruvique ?
C=O : groupe carbonyle – famille cétone
COOH : groupe carboxyle – famille acide carboxylique
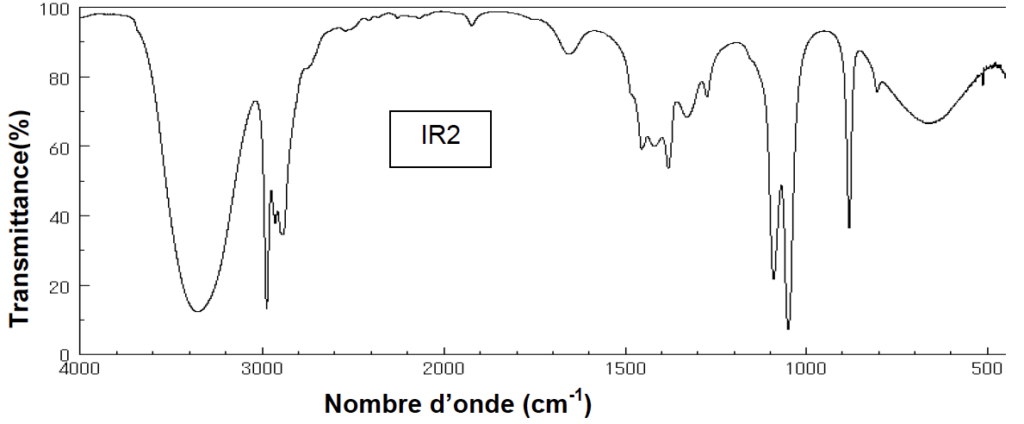
7. Parmi les spectres IR (IR1 et IR2) proposés ci-dessous, choisir, en justifiant, celui correspondant à l’acide pyruvique.
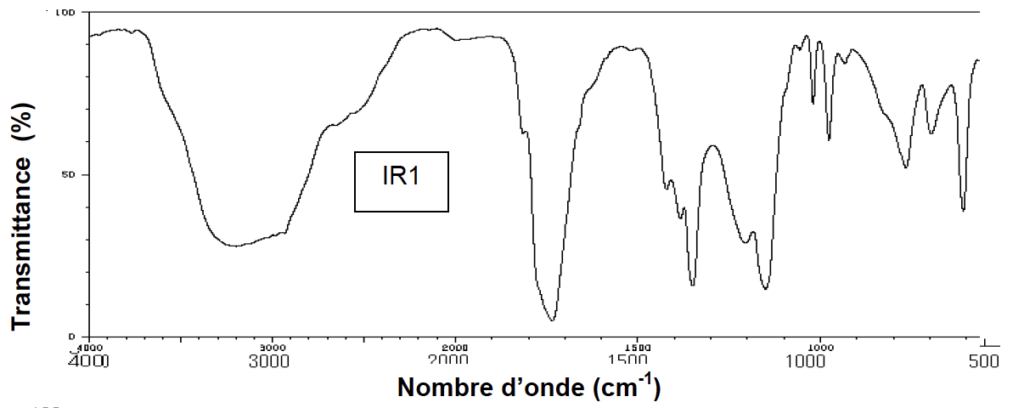
L’acide pyruvique comporte un groupe carbonyle et un groupe carboxyle.
Son spectre doit comporter :
| Liaison | nombres d’onde (cm-1) | Intensité |
| C = O aldéhyde et cétone | 1650 – 1730 | Forte |
| C = O acide carboxylique | 1680 – 1710 | Forte |
| O–H acide carboxylique | 2500 – 3200 | Bande large |
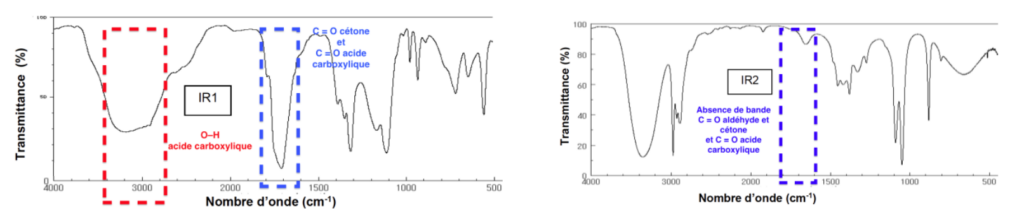
Le spectre 1 contient les bandes dues aux groupes de l’acide pyruvique.
Le spectre 2 ne contient pas les bandes dues aux groupes de l’acide pyruvique.
Celui correspondant à l’acide pyruvique est le spectre 1.
En milieu aérobie (présence de dioxygène), la transformation chimique du glucose dans un muscle peut être modélisée par la réaction d’équation :
C6H12O6(aq) + 6 O2(g) → 6 CO2(g) + 6 H2O(l)
L’énergie libérée par cette réaction est de 673 kcal pour une mole de glucose consommée par le muscle.
8. Calculer la valeur de la quantité de matière de glucose consommée par les muscles du cycliste afin de libérer une énergie Emusc = 640 kJ pour effectuer l’ascension maximale.
1 cal = 4,18 J
673 kcal=673\times4,18=2813 kJ
| quantité de matière | énergie libérée |
| 1 | 2813 kJ |
| x | 640 kJ |
$x=\frac{640\times1}{2813}=0,228 mol$
9. On suppose que la transformation chimique est totale. Compléter le tableau d’avancement en annexe à rendre avec la copie et calculer les valeurs de la masse de glucose et du volume de dioxygène consommés pour effectuer l’ascension.
Complétons le tableau d’avancement :
| C6H12O6(aq) | + 6 O2(g) | → 6 CO2(g) | + 6 H2O(l) | |
| État initial (mol) | 0,228 | Excès | 0 | Solvant |
| État final (mol) | 0,228 -xmax=0 | Excès | 6xmax | Solvant |
Calculons la masse de glucose consommé pour effectuer l’ascension :
$n=\frac{m}{M}$
$m=n\times M$
$m_{glucose}=n_{glucose}\times M_{glucose}$
$m_{glucose}=0,228\times180,0=41,0$ g
Calculons le volume de dioxygène consommé pour effectuer l’ascension :
$n_{O_2}=\frac{V_{O_2}}{V_m}$
$V_{O_2}=n_{O_2}\times V_m$
Or d’après l’équation :
$$\frac{n_{O_2}^{consommé}}{6}=\frac{n_{glucose}^{consommé}}{1}$$
$$n_{O_2}^{consommé}=6\ n_{glucose}$$
D’ou
$$V_{O_2}=6\ n_{glucose}^{consommé}\times V_m$$
$$V_{O_2}=6\times0,228\times24,0$$
$$V_{O_2}=32,8\ L$$
Annexe à rendre avec la copie
Question 5 : Compléter la chaîne énergétique avec les mots suivants : transfert thermique ; transfert mécanique ; transfert électrique ; énergie chimique ; énergie mécanique ; énergie thermique.
Question 9 : Compléter le tableau d’avancement et calculer les valeurs de la masse de glucose et du volume de dioxygène consommés pour effectuer l’ascension.
| C6H12O6(aq) | + 6 O2(g) | → 6 CO2(g) | + 6 H2O(l) | |
| État initial (mol) | 0,228 | excès | 0 | solvant |
| État final (mol) | …….. | excès | …….. | solvant |
