Asie 2022 Sujet 2
Exercice B – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 22-PYCJ2JA1
Sujet et corrigé
Mots-clés: synthèse organique, rendement.
Pour fabriquer un savon, on réalise une réaction de saponification consistant à faire réagir un corps gras avec de la soude. Dans le cas du savon de Marseille, le corps gras utilisé est de l’huile d’olive. Dans cet exercice, on s’intéresse à la fabrication d’un savon de Marseille.
Analyse d’un protocole de production industrielle
Pour produire du savon de Marseille, on fait réagir de l’huile d’olive avec de l’hydroxyde de sodium en solution. Pour simplifier, on fait l’hypothèse que l’huile d’olive n’est constituée que d’une seule espèce chimique appelée oléine.
La transformation chimique est modélisée par la réaction chimique d’équation :
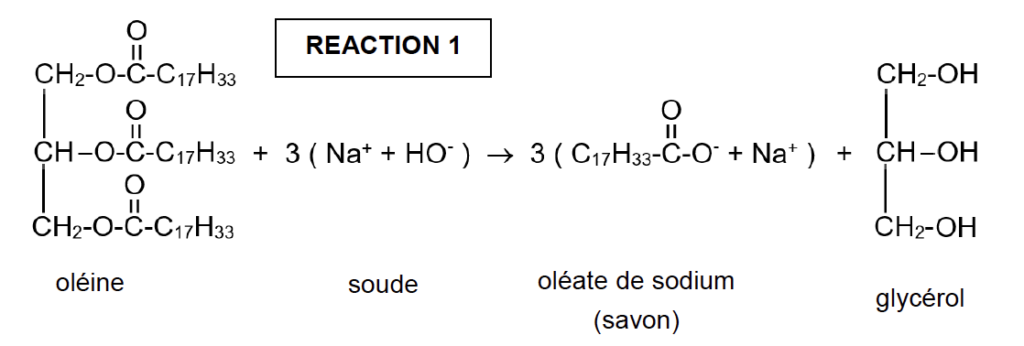
Dans le protocole ci-dessous, on rapporte les étapes réalisées en laboratoire pour produire du savon de Marseille selon un procédé industriel.
Protocole : Saponification réalisée au laboratoire selon le procédé industriel
Etape 1. Dans un ballon, introduire 10 mL d’huile d’olive, 10 mL d’éthanol et 10 mL d’hydroxyde de sodium (soude) de concentration 𝑐 = [HO–] = 10 mol · L−1. Ajouter quelques grains de pierre ponce. Adapter un réfrigérant à eau sur le ballon et chauffer à reflux pendant 30 min.
Etape 2. Verser le contenu du ballon dans un bécher contenant 100 mL d’eau salée saturée. Agiter avec une tige en verre. Cette opération s’appelle le relargage. Filtrer le mélange obtenu, très basique, et récupérer le savon formé. Laver le savon à l’eau froide puis le placer sur une coupelle et le laisser sécher.
Données :
- Masse volumique de l’oléine 𝜌 = 0,90 g ⋅ mL−1.
- Solution de soude : CORROSIVE. Le contact avec la peau peut causer des douleurs, des rougeurs et des brûlures. Peut causer une grave irritation du nez et de la gorge.
- L’ion oléate de formule C17H33COO− est la base conjuguée de l’acide oléique de formule C17H33COOH. Le pKa du couple acide oléique / ion oléate a pour valeur 4,8.
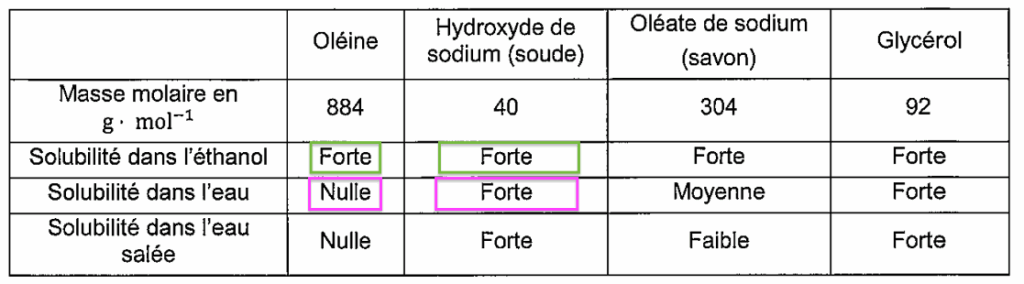
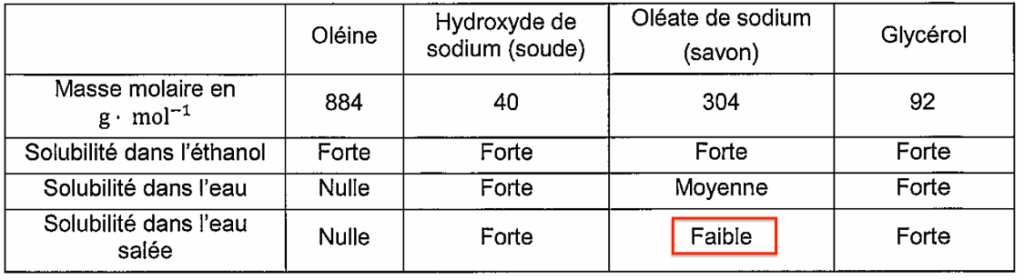
- Quelques données relatives aux espèces chimiques citées :
| Oléine | Hydroxyde de sodium (soude) | Oléate de sodium (savon) | Glycérol | |
| Masse molaire en g ⋅ mol−1 | 884 | 40 | 304 | 92 |
| Solubilité dans l’éthanol | Forte | Forte | Forte | Forte |
| Solubilité dans l’eau | Nulle | Forte | Moyenne | Forte |
| Solubilité dans l’eau salée | Nulle | Forte | Faible | Forte |
Analyse qualitative du protocole :
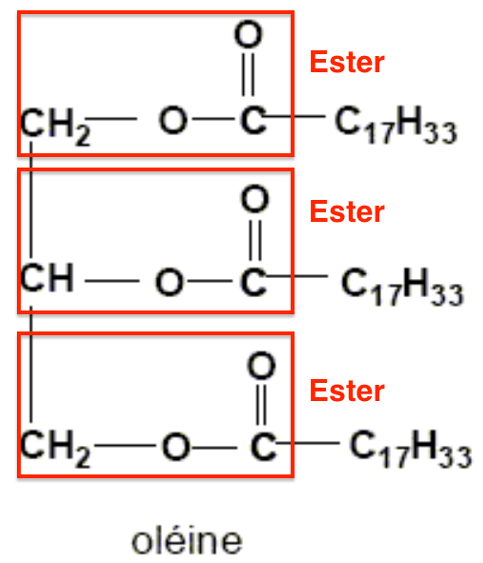
1. En analysant la formule chimique de l’oléine, justifier que l’oléine est un triester.
2. Citer deux règles de sécurité relatives à l’utilisation de la soude concentrée.
« La solution de soude est corrosive. Le contact avec la peau peut causer des douleurs, des rougeurs et des brûlures. Peut causer une grave irritation du nez et de la gorge. »
Règles de sécurités :
- Porter une blouse, des gants et lunettes de protection.
- Travailler sous hotte aspirante
3. Proposer une hypothèse sur le rôle de l’éthanol.
L’éthanol n’apparaît pas dans l’équation de réaction.
L’hydroxyde de sodium est une soluble dans l’eau. Or l’oléine n’est pas soluble dans l’eau. En solution aqueuse, ils ne peuvent donc pas réagir ensemble.
Dans l’éthanol l’hydroxyde de sodium est soluble et l’oléine également. Ils peuvent donc réagir ensemble.
4. Donner un argument permettant d’expliquer que l’ion oléate prédomine par rapport à l’acide oléique.
Diagramme de prédominance
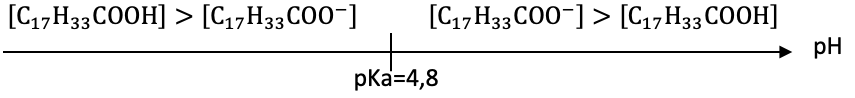
L’hydroxyde de sodium est une base forte. La solution est donc basique $pH > pK_a$ : ainsi $C_{17}H_{33}COO^-$ est prédominant.
5. Préciser le rôle du chauffage.
Le chauffage permet d’accélérer la réaction.
6. Expliquer pourquoi on utilise de l’eau salée et non de l’eau douce dans la phase de relargage.
L’oléate de sodium n’est pas soluble dans l’eau salée. Ainsi, le relargage permet de précipiter le savon et de le récupérer par filtration.
Rendement de la synthèse :
7. Montrer que l’oléine est le réactif limitant.
$$n_{oléine}^i = \frac{m_{oléine}}{M_{oléine}}$$
Or
$$\rho_{oléine} = \frac{m_{oléine}}{V_{oléine}}$$
$$m_{oléine} = \rho_{oléine} \times V_{oléine}$$
D’où
$$n_{oléine}^i = \frac{\rho_{oléine} \times V_{oléine}}{M_{oléine}}$$
$$n_{oléine}^i = \frac{0,90 \times 10 \times 884}{88400}$$
$$n_{oléine}^i = 1,0.{10}^{-2}\ mol$$
$$n_{soude}^i = C \times V$$
$$n_{soude}^i = 10 \times 10{.10}^{-3}$$
$$n_{soude}^i = 1,0{.10}^{-1}\ mol$$
$$x_{max1} = \frac{n_{oléine}^i}{1} = \frac{1,0.{10}^{-2}}{1} = 1,0.{10}^{-2}\ mol$$
$$x_{max2} = \frac{n_{soude}^i}{3} = \frac{1,0{.10}^{-1}}{3} = 3,3{.10}^{-2}\ mol$$
$x_{max1} < x_{max2}$ : l’oléine est le réactif limitant.
8 Justifier l’importance d’éliminer le réactif en excès par le lavage. Préciser quelle autre espèce chimique est également éliminée.
Le réactif en excès est la soude.
La soude est corrosive, il faut donc l’éliminer du savon qui sera en contact avec la peau.
L’autre produit de la réaction, le glycérol, est également éliminé.
9. Calculer le rendement de la synthèse sachant que l’on a obtenu une masse de savon mexp = 7,3 g.
$$x_{max} = x_{max1} = 1,0{.10}^{-2}\ mol$$
$$m_{savon}^{théorique} = n_{savon}^{théorique} \times M_{savon}$$
$$m_{savon}^{théorique} = 3 \times x_{max} \times M_{savon}$$
$$m_{savon}^{théorique} = 3 \times 1,0.{10}^{-2} \times 304$$
$$m_{savon}^{théorique} = 9,1\ g$$
$$\eta = \frac{m_{savon}^{exp}}{m_{savon}^{théorique}}$$
$$\eta = \frac{7,3}{9,1}$$
$$\eta = 0,80$$
$$\eta = 80%$$
10. Proposer une hypothèse susceptible d’expliquer quele rendement ne soit pas de 100 %.
Le rendement n’est pas de 100% car la réaction n’est pas totale.
