Métropole 2022 Sujet 2
Exercice A – (5 points) – au choix du candidat – Durée 0h53 – Calculatrice autorisée
Sujet n° 22-PYCJ2ME1
Sujet et corrigé
Mots-clés : chromatographie, titrage acide base
La vanilline (figure 1) et l’éthylvanilline (figure 2) sont responsables des arômes « vanille » utilisés dans les produits alimentaires. La vanilline peut être extraite des gousses de vanille mais elle est très majoritairement synthétisée pour diminuer son coût. L’éthylvanilline est quant à elle exclusivement issue de la synthèse.
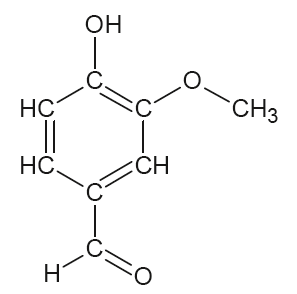
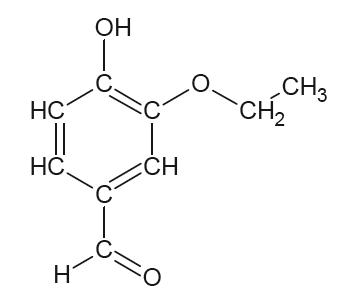
L’objectif de cet exercice est d’étudier la vanilline et de contrôler sa teneur dans un extrait de vanille.
Données :
- pKA du couple vanilline / ion vanillinate noté AH / A– à 25 °C : pKA = 7,4 ;
- masse molaire moléculaire de la vanilline : M = 152 g·mol–1 ;
- propriétés des espèces chimiques :
| Solution aqueuse de chlorure de sodium | Acétate d’éthyle | |
| Densité | Supérieure à 1 | 0,897 |
| Miscible avec l’eau | Oui | Non |
| Solubilité de la vanilline | Très peu soluble | Très soluble |
1. Étude de produits commerciaux « vanillés »
On souhaite étudier trois produits du commerce « vanillés » :
- produit 1 : produit commercial, liquide, obtenu par macération de gousses de vanille dans un mélange eau / éthanol ;
- produit 2 : sucre vanillé ;
- produit 3 : sucre vanilliné.
Q1. Indiquer si les molécules de vanilline et d’éthylvanilline sont des isomères de constitution. Justifier.
Vanilline : $C_8H_8O_3$
Ethylanilline : $C_9H_{10}O_3$
Leurs formules brutes sont différentes : les deux molécules ne sont pas isomères.
Q2. Représenter la formule topologique de la molécule de vanilline.
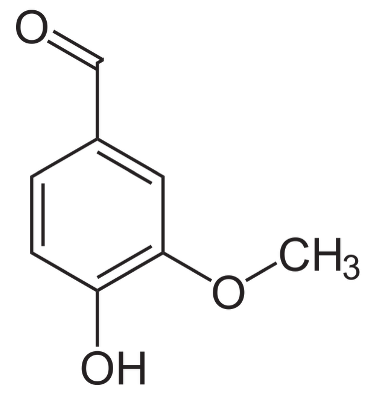
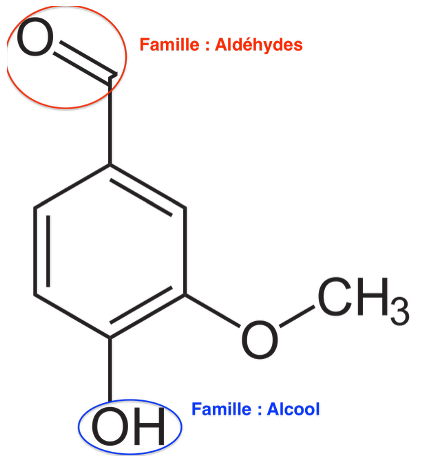
Q3. Sur la molécule représentée à la question Q2, entourer deux groupes caractéristiques présents et nommer pour chacun d’eux la famille fonctionnelle associée.
On extrait la vanilline potentiellement présente du produit 2 puis du produit 3 selon le protocole ci-dessous :
- introduire, dans un erlenmeyer, 30 mL d’eau distillée et 1,0 g de produit « vanillé » ;
- introduire la solution aqueuse dans une ampoule à décanter et y ajouter 10 mL d’acétate d’éthyle ainsi qu’une spatule de chlorure de sodium ;
- agiter l’ensemble et dégazer régulièrement ;
- laisser décanter le mélange puis récupérer la phase organique.
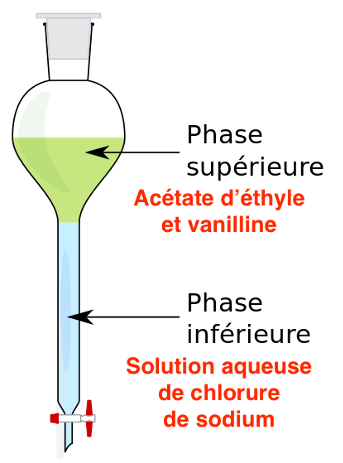
Q4. Schématiser l’ampoule à décanter après agitation dans le cas du produit 2 en précisant la position relative des phases et en indiquant celle qui contient la vanilline. Justifier.
La solution aqueuse de chlorure de sodium a une densité supérieure à celle de l’acétate d’éthyle.
La solution aqueuse de chlorure de sodium est en bas et l’acétate d’éthyle en haut de l’ampoule à décanter.
La vanilline est très soluble dans l’acétate d’éthyle. La vanilline se trouve dans la phase organique.
Pour vérifier la présence ou non de vanilline dans les trois produits du commerce, on réalise une chromatographie sur couche mince.
Après révélation sous lampe UV, on obtient le chromatogramme donné sur la figure 3.
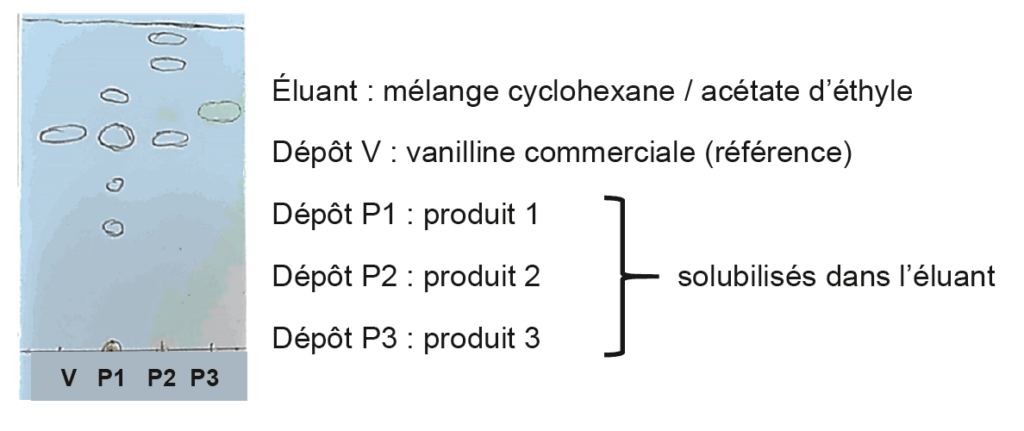
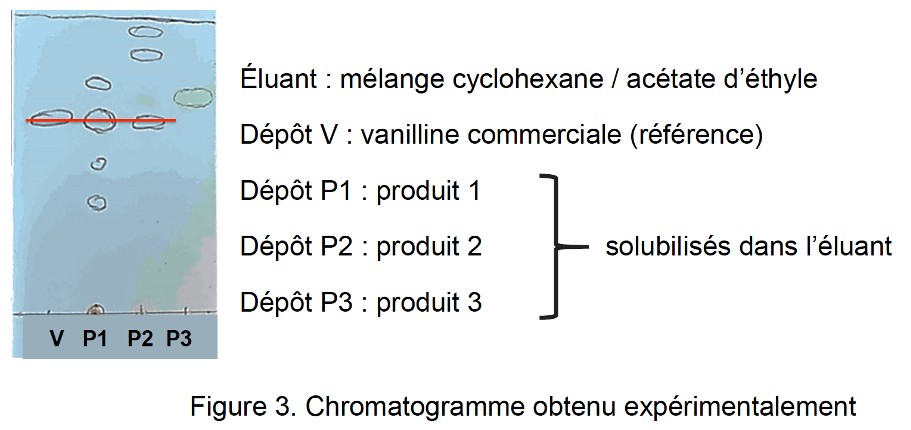
Figure 3. Chromatogramme obtenu expérimentalement
Q5. Identifier, en justifiant, les produits du commerce contenant de la vanilline.
Tous les produits ayant une tache à la même hauteur que la vanilline en contienne.
Les produits P1 et P2 contiennent donc de la vanilline.
2. Titrage de la vanilline contenu dans le produit 1
On s’intéresse dans cette partie au produit commercial obtenu par macération de gousses de vanille. La législation impose, pour obtenir l’appellation « extrait de vanille », une masse minimale de 2 g de vanilline par kilogramme d’extrait. Dans certains produits commercialisés, cette masse peut atteindre plusieurs dizaines de grammes.
Pour vérifier si le produit 1 répond à cette condition, on se propose de déterminer la masse de vanilline contenue dans un échantillon du produit commercial par un titrage suivi par pH-métrie.
On introduit 0,31 g de produit 1 dans une fiole jaugée de 100,0 mL que l’on complète jusqu’au trait de jauge avec une solution aqueuse d’hydroxyde de sodium. On note S la solution obtenue. On réalise le titrage d’une prise d’essai de 50,0 mL de solution S par une solution aqueuse d’acide chlorhydrique de concentration égale à 4,1×10–3 mol·L–1. La courbe du titrage est donnée en figure 4.
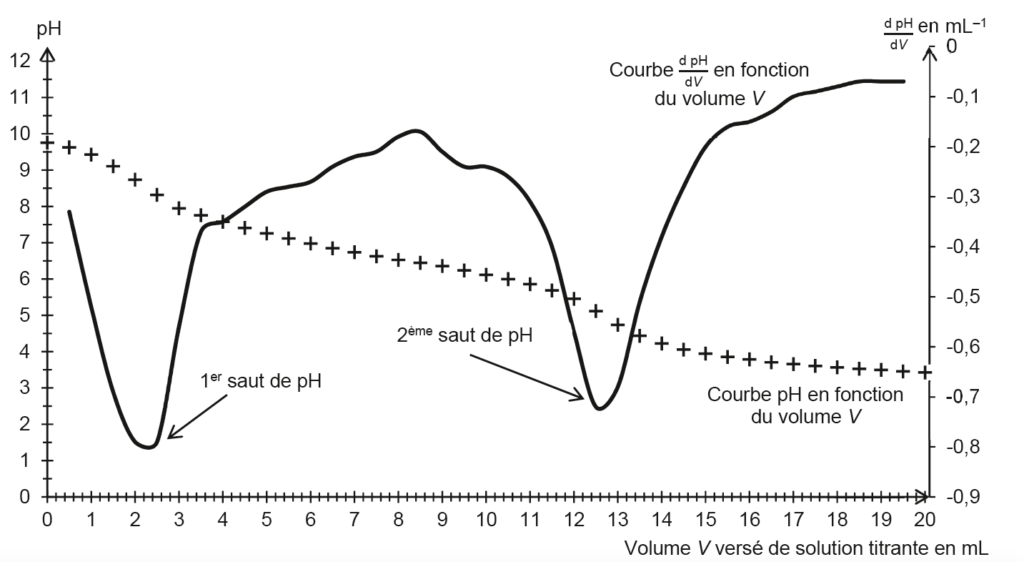
Figure 4. Courbes du titrage par suivi pH-métrique
Q6. Justifier que la vanilline se trouve sous forme d’ion vanillinate, noté A–, au début du titrage. La courbe de la figure 4 est composée de deux sauts de pH :
- un premier saut qui correspond au titrage des ions hydroxyde présents en excès ;
- un deuxième saut qui correspond au titrage de l’ion vanillinate.
Couple $AH/A^-$
Diagramme de prédominance :
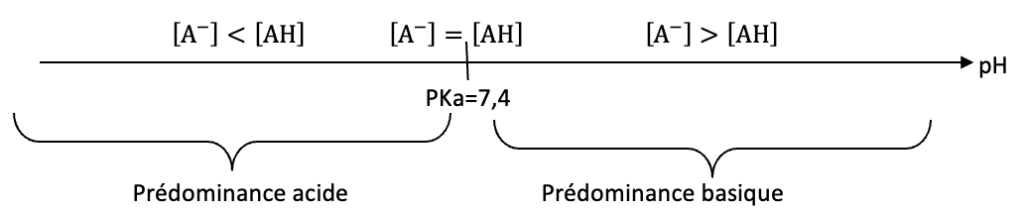
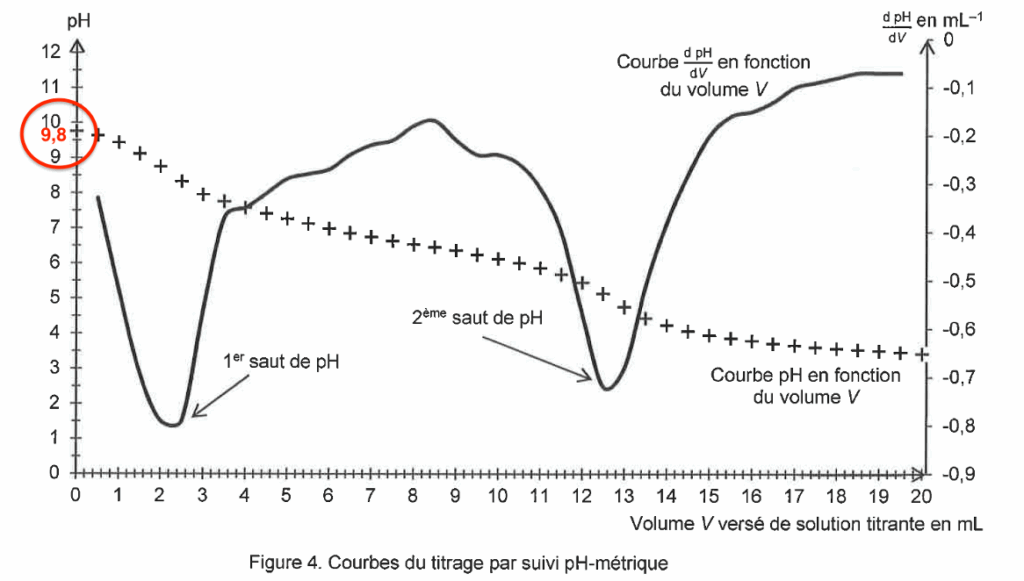
Au début du titrage pH=9,8 : pH>pKa . L’espèce prédominante est $A^-$.
On admet que le volume d’acide chlorhydrique nécessaire pour titrer l’ion vanillinate est égal à la différence des deux volumes entre les deux équivalences observées.
Q7. Écrire l’équation de la réaction support du titrage entre l’ion vanillinate et l’acide chlorhydrique.
$$A_{(aq)}^-+H_3O_{(aq)}^+\rightarrow{\rm AH}*{(aq)}+H_2O*{(aq)}$$
Q8. Vérifier si l’appellation « extrait de vanille » peut être attribuée à l’extrait étudié.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche suivie est évaluée et nécessite donc d’être correctement présentée.
À l’équivalence, les réactifs ont été introduits dans les proportions stœchiométriques :
$$\frac{n_{A^-}^i}{1}=\frac{n_{{H_3O}^+}^{eq}}{1}$$
On cherche une masse :
$$\frac{m_{A^-}}{M_{A^-}}=C_{Acide}\times V_{eq}$$
$$m_{A^-}=C_{Acide}\times V_{eq}\times M_{A^-}$$
D’après le texte : « on admet que le volume d’acide chlorhydrique nécessaire pour titrer l’ion vanillinate est égal à la différence des deux volumes entre les deux équivalences observées ».
On trouve graphiquement $V_{eq}$ :
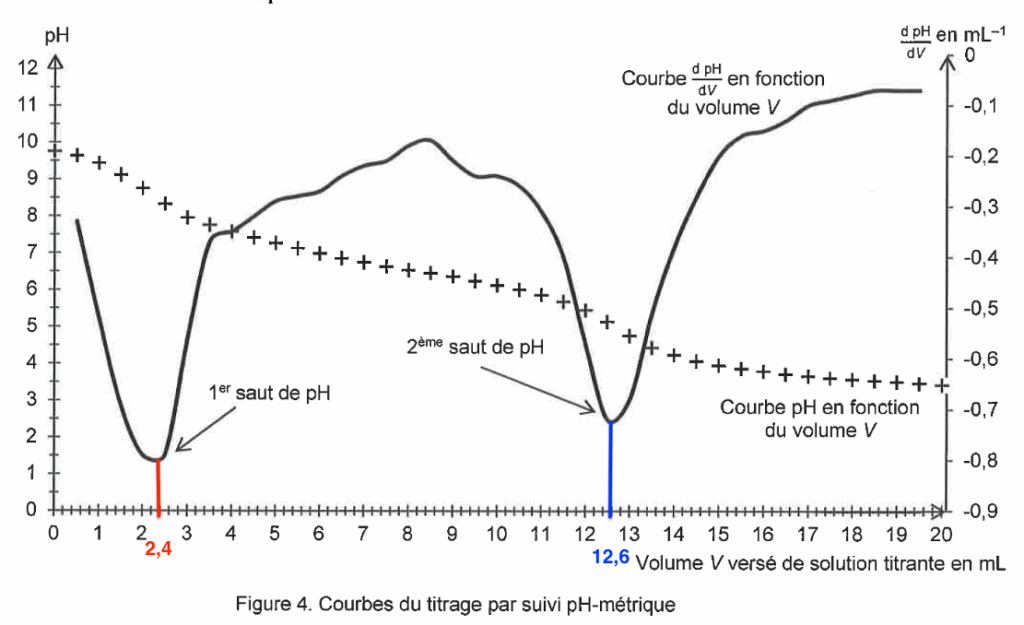
$$V_{eq}=12,6-2,4$$
$$V_{eq}=10,2\ \text{mL}$$
$$m_{A^-}=C_{Acide}\times V_{eq}\times M_{A^-}$$
$$m_A=C_{Acide}\times V_{eq}\times M_A$$
$$m_{A^-}=4,1\times 10^{-3}\times 10,2\times 10^{-3}\times 152$$
$$m_{A^-}=6,4\times 10^{-3}\ \text{g}$$
Masse dans 50,0 mL :
Dans 100,0 mL : ${m\prime}*{A^-}=2\times m*{A^-}=2\times 6,4\times 10^{-3}\ \text{g}=1,3\times 10^{-2}\ \text{g}$
Cherchons la masse dans un kilogramme d’extrait :
| Extrait | Masse de vanilline |
| 0,31 g | $1,3\times 10^{-2}$ g |
| 1000 g | m |
$$m=\frac{1000\times 1,3\times 10^{-2}}{0,31}$$
$$m=42\ \text{g}$$
L’appellation extrait de vanille peut être attribué à cet extrait.
D’après le texte : « cette masse peut atteindre plusieurs dizaines de grammes », c’est conforme au résultat trouvé.
