Bac Centres étrangers 2021 Sujet 1
Exercice 1 – (10 points) – Commun à tous les candidats – Durée 1h45 – Calculatrice autorisée
Sujet n° 21-PYCJ1G11
Sujet et corrigé
Depuis l’antiquité, les bières sont produites selon le même procédé à partir de quatre constituants : l’eau, le malt, le houblon et les levures. L’origine des ingrédients et les différentes étapes de transformation vont apporter à la bière sa couleur, sa saveur ou encore son amertume.
Entre 250 et 300 espèces chimiques présentes dans la bière proviennent des huiles essentielles du houblon, parmi lesquelles plus de 60 esters différents dont les plus importants sont l’acétate d’éthyle, l’acétate d’isoamyle, l’acétate d’isobutyle, l’acétate de phényle, l’hexanoate d’éthyle et le caprylate d’éthyle.
Afin d’intensifier la saveur fruitée d’une bière, on peut rajouter, en fin de fabrication, un ester dont la réaction de synthèse va être étudiée dans un premier temps (partie 1). La qualité de l’eau utilisée étant très importante dans la fabrication de la bière, l’analyse d’une eau de brassage sera effectuée dans un second temps (partie 2).
Partie 1 – Synthèse d’un ester au laboratoire
L’ester, noté E, dont la formule semi-développée est représentée ci-après, permet d’obtenir un arôme de fruits rouges qui peut servir pour intensifier le goût d’une bière.
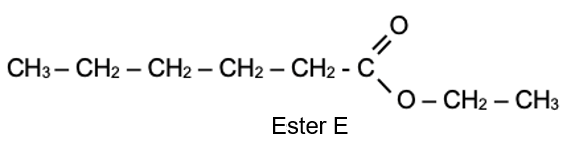
Cet ester peut être synthétisé au laboratoire à partir d’un acide carboxylique et d’un alcool. La réaction modélisant cette synthèse est appelée réaction d’estérification. L’équation de la réaction d’estérification, écrite dans le cas général avec R et R’ chaines carbonées, est la suivante :
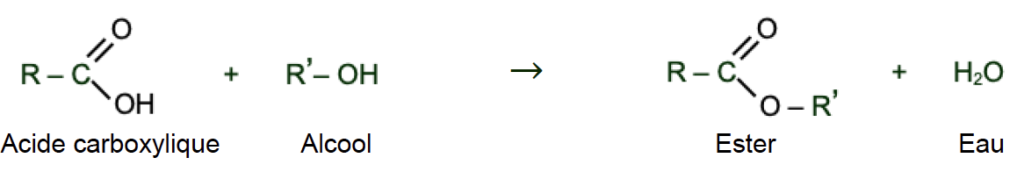
Données
– Préfixes utilisés dans les règles de nomenclature
| Nombre d’atomes de carbone | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Préfixe | méth- | éth- | prop- | but- | pent- | hex- | hept- | oct- |
- Masse volumique 𝜌 (en g ⋅ cm−3 ) à 25 °C
| acide carboxylique A | alcool B |
| 0,930 | 0,789 |
- Masse molaire (en g ⋅ mol−1)
| Acide A | Alcool B | Ester noté E |
| 116,2 | 46,1 | 144,2 |
- Extrait d’une table de spectroscopie infrarouge
| Liaison | Nombre d’onde (𝐜𝐦−𝟏) | Intensité |
| O-H alcool libre | 3500 – 3700 | forte, fine |
| O-H alcool lié | 3200 – 3400 | forte, large |
| O-H acide carboxylique | 2500 – 3200 | forte à moyenne, large |
| Ctri – H | 3000 – 3100 | Moyenne |
| Ctét – H | 2800 – 3000 | Forte |
| C = O | 1680 – 1740 | Forte |
Remarques :
Ctri signifie que l’atome de carbone est trigonal, c’est-à-dire relié à trois voisins.
Ctét signifie que l’atome de carbone est tétragonal, c’est-à-dire relié à quatre voisins.
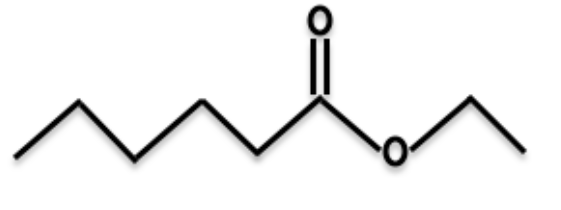
1. Nommer l’ester E et représenter sa formule topologique.
Nom : Hexanoate d’éthyle
Formule topologique :
2. Écrire les formules semi-développées de l’acide carboxylique A et de l’alcool B intervenant dans la synthèse de l’ester E et nommer chacun d’eux.
Formule de l’ester E :
Dans l’équation, l’ester E :
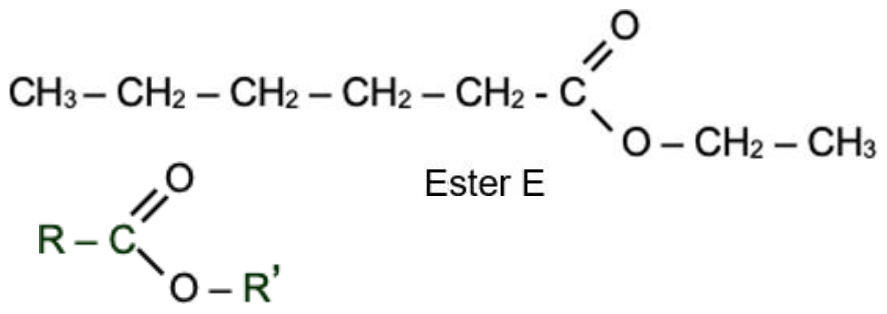
Par identification :
R est CH3-CH2-CH2-CH2-CH2
R’ est CH2-CH3
Ainsi, l’acide carboxylique :
Nom de cet acide carboxylique : acide hexanoique
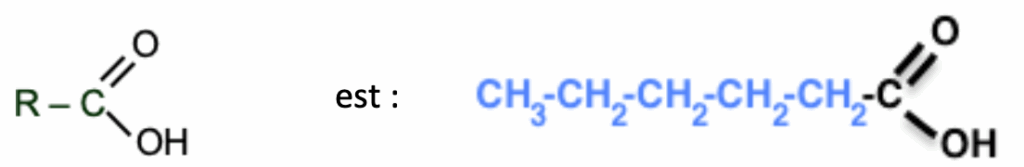
L’alcool R’-OH est CH3-CH2-OH
Nom de cet alcool : ethanol
Pour obtenir l’ester E, on chauffe à reflux un volume d’alcool Valcool= 20,0 mL avec un volume d’acide carboxylique Vacide = 43,0 mL, en présence d’acide sulfurique. On obtient, après séparation, rinçage et séchage, une masse 𝑚𝐸 = 33,1 g d’ester E.
3. Justifier le double intérêt d’un chauffage à reflux.
Le chauffage à reflux permet :
- d’accélérer la réaction
- sans perte de matière
4. L’acide sulfurique joue le rôle de catalyseur lors de cette synthèse. Citer la définition d’un catalyseur.
Un catalyseur est une espèce qui augmente la vitesse de réaction sans modifier l’état d’équilibre du système.
5. Montrer que les réactifs sont dans des proportions pratiquement stoechiométriques et déterminer la valeur du rendement de cette synthèse.
Soit une réaction : a A + b B → c C + d D
Les réactifs sont introduits dans les proportions stœchiométriques si: $ \frac{n(A)}{a} = \frac{n(B)}{b}$
Calculons les quantités de matières des réactifs :
$$n=\frac{m}{M}=\frac{\rho V}{M}$$
$$n_{acide\ carboxylique}=\frac{\rho_{acide\ carboxylique}V_{acide\ carboxylique}}{M_{acide\ carboxylique}}=\frac{0,930 \times 43,0}{116,2}=0,344\ mol$$
$$n_{alcool}=\frac{\rho_{alcool}V_{alcool}}{M_{alcool}}=\frac{0,789 \times 20,0}{46,1}=0,342\ mol$$
Ainsi $$\frac{n_{acide\ carboxylique}}{1}\approx\frac{n_{alcool}}{1}$$
Les réactifs sont donc introduits dans des proportions pratiquement stœchiométriques.
Le rendement est défini par : $$R=\frac{n_{exp}}{n_{theorique}}=\frac{m_{exp}}{m_{theorique}}$$
$$m_{theorique\ ester}=x_{max}M_{ester}$$
Or $$x_{max}=\frac{n_{réactif limitant}}{n_{coeff stoechiométriques}}=\frac{n_{alcool}}{1}$$
Soit $$m_{theorique\ ester}=n_{alcool}M_{ester}$$
D’ou $$R=\frac{m_{exp}}{m_{theorique}}=\frac{m_{exp}}{n_{alcool}M_{ester}}=\frac{33,1}{0,342 \times 144,2}=0,671=67,1\%$$
Pour améliorer le rendement de la synthèse, on réalise trois synthèses en faisant varier différents paramètres expérimentaux. Pour chaque synthèse, un suivi temporel de la concentration en acide carboxylique est réalisé par titrage. Ce suivi conduit aux tracés des courbes représentant l’évolution de la concentration de l’acide carboxylique en fonction du temps (figure 1).
| Volume d’acide | Volume d’alcool | Catalyseur | Température | |
| Synthèse 1 | 43 mL | 20 mL | Oui | 50 °C |
| Synthèse 2 | 43 mL | 25 mL | Oui | 50 °C |
| Synthèse 3 | 43 mL | 20 mL | Oui | 70 °C |
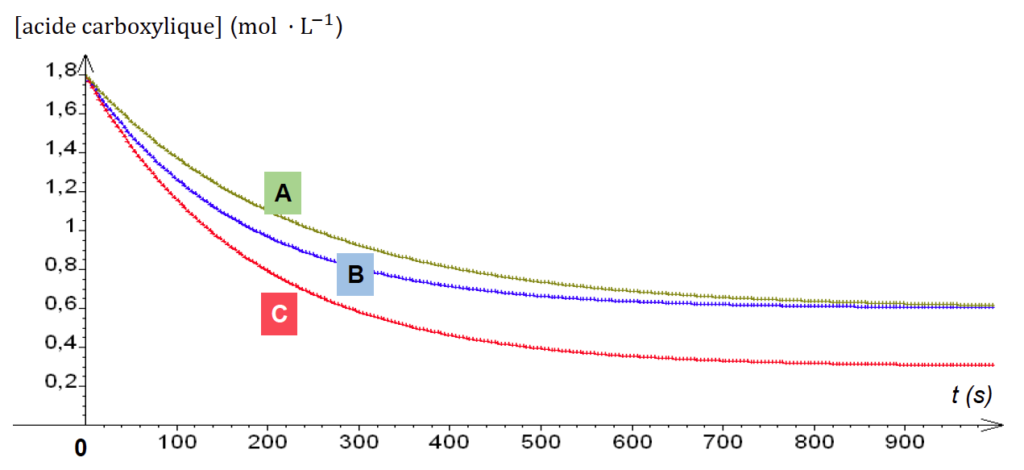
6. Identifier les conditions expérimentales, en précisant le numéro de la synthèse, pour lesquelles la réaction d’estérification est la plus lente. Préciser la courbe associée.
La vitesse de réaction dépend de :
- La concentration, plus elle est élevée, plus la vitesse de réaction est grande
- La température, plus elle est élevée, plus la vitesse de réaction est grande
- La présence d’un catalyseur, en présence d’un catalyseur la réaction est plus rapide.
La synthèse 1 et 3 ont les concentrations les plus basses (volume d’alcool le plus faible).
La synthèse 1 et 2 ont les températures les plus basses.
On en conclu que la réaction d’estérification est la plus lente pour la synthèse 1. Elle correspond à la courbe A.
7. Identifier les conditions expérimentales, en précisant le numéro de la synthèse, pour lesquelles le rendement de la réaction d’estérification est amélioré. Préciser la courbe associée.
Les 3 synthèses ont la même quantité initiale d’acide.
Les synthèses 1 et 3 ont la même quantité initiale d’alcool. Cependant, la synthèse 3 est faite à une température plus élevée, la réaction est plus rapide. La synthèse 1 correspond à la courba A et la synthèse 3 correspond à la courbe B.
La courbe C correspond donc à la synthèse 2. On remarque que concentration finale d’acide est plus faible que celle des autres synthèses. Or, avec ces quantités initiales, l’acide reste le réactif limitant (voir question 5). L’acide étant plus consommé, l’avancement final est plus grand et donc le rendement augmente.
Les spectres infrarouge de chacun des réactifs avant la synthèse et du produit organique isolé et purifié après la synthèse ont été réalisés. Ils sont reproduits ci-après.
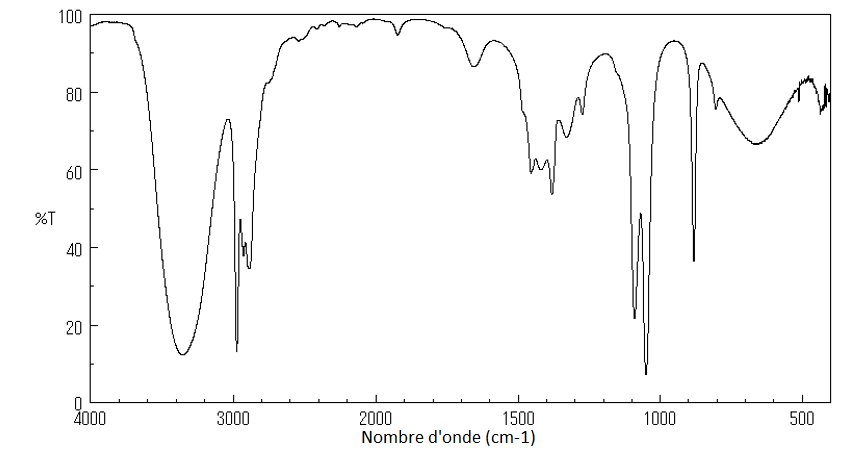
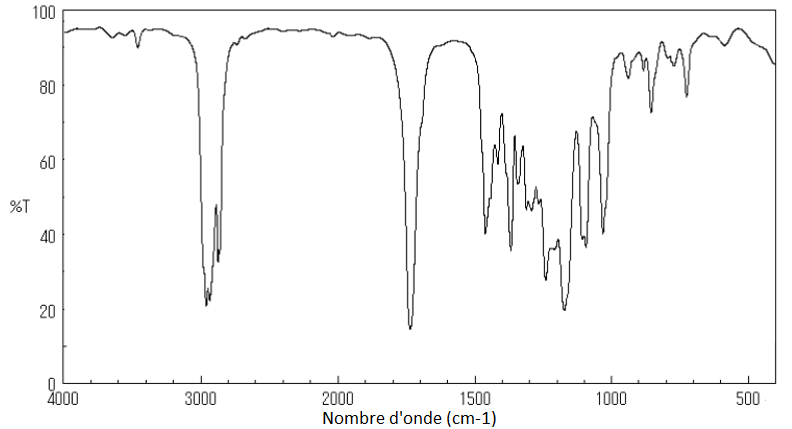
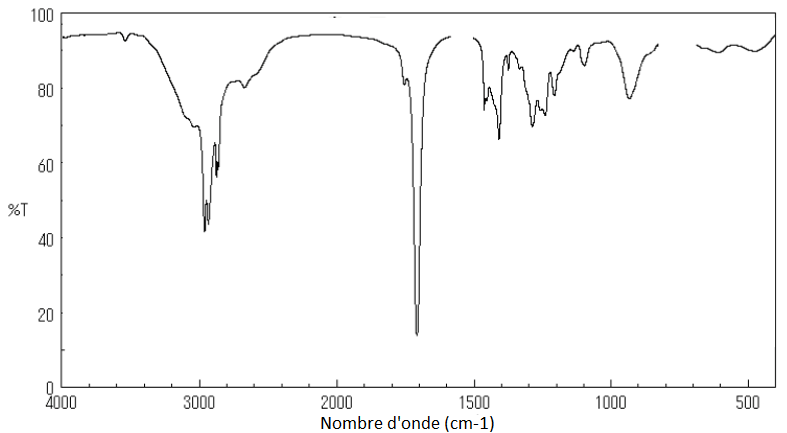
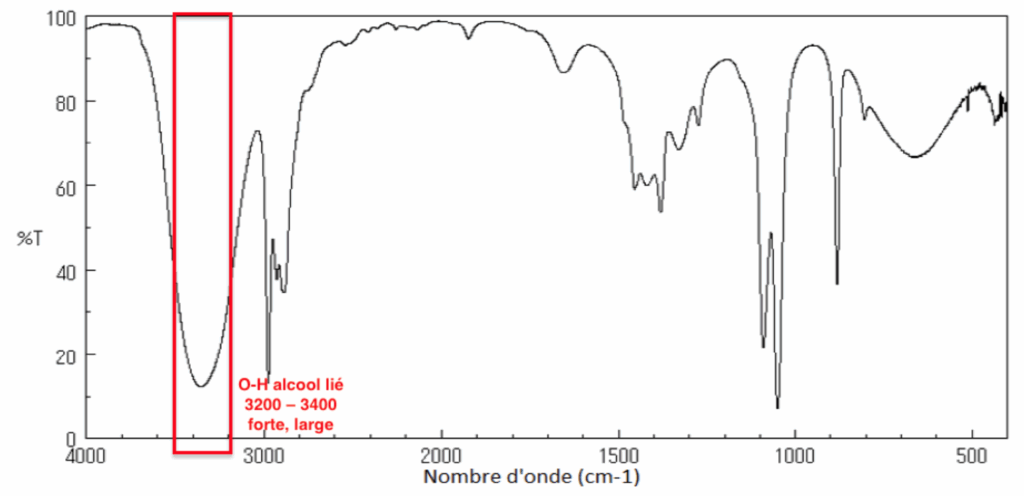
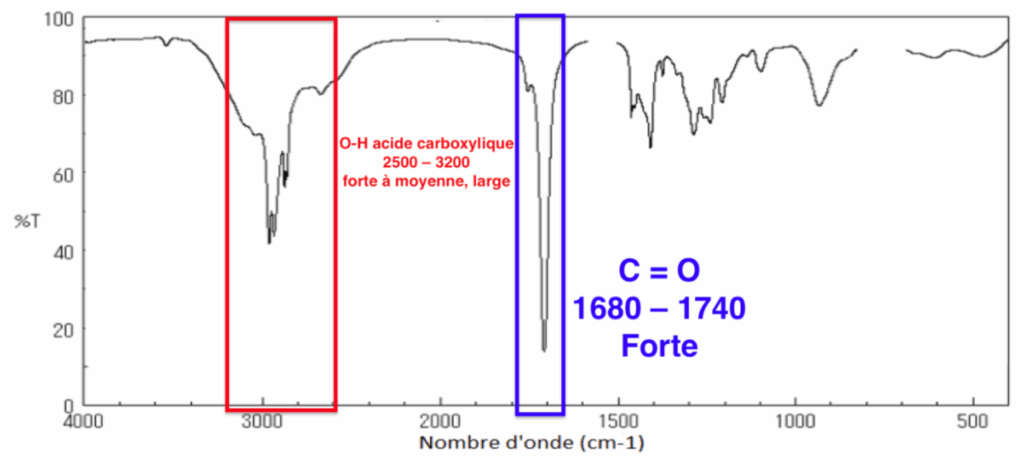
8. Parmi ces trois spectres infrarouge (page 5/15), identifier celui de l’ester E en précisant la démarche suivie.
Spectre 1
Spectre 2
Spectre 3
Le spectre 1 correspond à l’alcool.
Le spectre 2 correspond à l’ester.
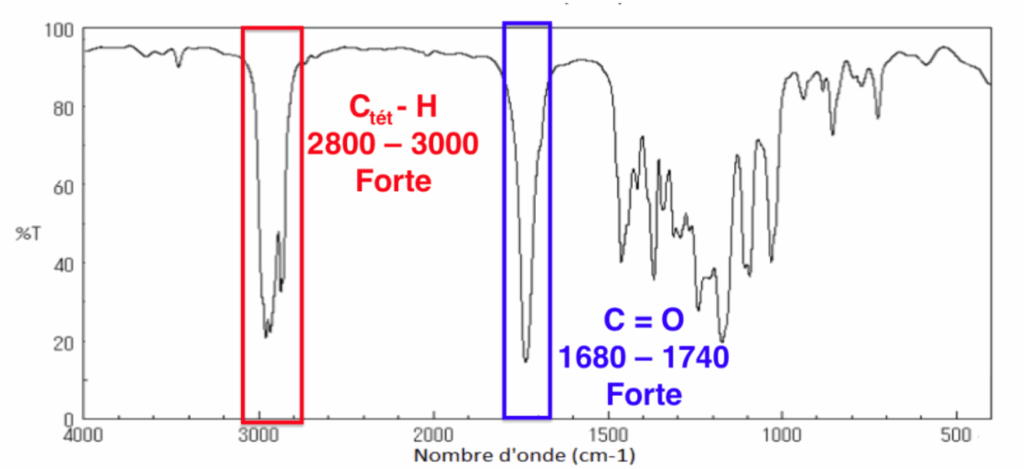
D’après le sujet Ctét signifie que l’atome de carbone est tétragonal, c’est-à-dire relié à quatre voisins. On prend donc Ctét car tous les carbones qui forment des liaisons C-H sont reliés à quatre voisin
Le spectre 3 correspond à l’acide carboxylique.
Partie 2 – Étude de l’eau de brassage d’une bière brune
La composition de l’eau utilisée pour la fabrication d’une bière a une influence sur sa saveur ou sa couleur. Dans le cas de la bière brune, l’eau utilisée doit contenir, entre autres, des ions chlorure à
une concentration massique comprise entre 100 et 200 mg ⋅ L−1.
Dans cette partie, on souhaite savoir si une eau de source peut convenir au brassage d’une bière.
À cette fin, les ions chlorure présents dans cette eau de source sont titrés par une solution de nitrate d’argent. Le titrage est suivi par conductimétrie.
Données :
Conductivités molaires ioniques à 25°C :
| ions | ion nitrate NO3− | ion chlorure Cℓ− | ion argent Ag+ | ion sodium Na+ |
| 𝜆 (mS ⋅ m2 ⋅ mol−1) | 7,1 | 7,7 | 6,2 | 5,0 |
- Masse molaire atomique du chlore : 𝑀(Cℓ) = 35,5 g ⋅ mol−1
Étude de la réaction support du titrage
Pour que la réaction entre les ions argent et les ions chlorure soit adaptée pour réaliser le titrage, il faut que la transformation associée soit rapide et totale. On souhaite s’assurer qu’elle respecte ces conditions.
Pour cela, on mélange, dans un tube à essai :
- un volume V1= 2,0 mL de solution aqueuse de chlorure de sodium (Na+(aq) , Cℓ− (aq)) de concentration C1 = 5,00 × 10–2 mol⋅L−1 ;
- et un volume V2 = 2,0 mL de solution aqueuse de nitrate d’argent (Ag+(aq) , NO3−(aq)) de concentration C2 = 4,25 × 10–2 mol⋅L−1.
On observe la formation immédiate d’un précipité blanc, solide identifié comme étant du chlorure
d’argent. L’équation de la réaction modélisant cette transformation est :
Ag+(aq) + Cℓ− (aq) → AgCℓ(s)
La valeur de la constante d’équilibre de cette réaction à 25°C est 𝐾 = 6,4 × 109.
9. Montrer qu’à l’équilibre du système chimique, l’avancement à l’équilibre xeq peut être déterminé par la résolution de l’équation :
$ \frac{(V_1+V_2)^2(C^0)^2}{(V_1C_1-x_{eq})(V_2C_2-x_{eq})}=K $ avec C0 = 1 mol⋅L−1
Cette équation du second degré en xeq admet deux solutions dont les valeurs arrondies sont :
x1 = 1 × 10−4 mol et x2 = 8,5 × 10−5 mol
Indiquer la solution qui peut être retenue pour ce système chimique.
Pour une réaction : aA(aq)+bB(aq)⇄cC(aq)+dD(aq)
La constante d’équilibre s’écrit :
$$Q_{r,\mathrm{eq}} = \frac{[C]{\mathrm{eq}}^c \, [D]{\mathrm{eq}}^d}{[A]{\mathrm{eq}}^a \, [B]{\mathrm{eq}}^b} = K$$
Remarque : Si A, B, C ou D est le solvant ou un solide, on remplacera sa « concentration » par le chiffre 1.
Ici : Ag+ (aq) + Cl− (aq) → AgCl(s)
$$K = \frac{(C^0)^2}{[Ag^+]{\mathrm{eq}}^1 \, [Cl^-]{\mathrm{eq}}^1}$$
Faisons un tableau d’avancement :
| Équation | Ag+ (aq) + Cl− (aq) → AgCl(s) | ||
| État initial | C2V2 | C1V1 | 0 |
| État intermédiaire | C2V2 – x | C1V1– x | x |
| État équilibre | C2V2 – xeq | C1V1 – xeq | Xeq |
$$[Ag^+]{\mathrm{eq}} = \frac{n{Ag^+}^{\mathrm{eq}}}{V_{\mathrm{total}} \ \text{de la solution}}
= \frac{C_2 V_2 – x_f}{V_1 + V_2}$$
$$[Cl^-]{\mathrm{eq}} = \frac{n{Cl^-}^{\mathrm{eq}}}{V_{\mathrm{total}} \ \text{de la solution}}
= \frac{C_1 V_1 – x_f}{V_1 + V_2}$$
On remplace dans la formule de K :
$$ K = \frac{(C^0)^2}{[Ag^+]{\mathrm{eq}} [Cl^-]{\mathrm{eq}}}$$
$$ K = \frac{(C^0)^2}{\dfrac{C_2 V_2 – x_f}{V_1+V_2} \cdot \dfrac{C_1 V_1 – x_f}{V_1+V_2}}$$
$$ K= \frac{(C^0)^2 (C_2 V_2 – x_f)(C_1 V_1 – x_f)}{(V_1 + V_2)^2}$$
Calculons $(x_{\max})$ :
$$C_1 V_1 – x_{\max 1} = 0 \quad \Rightarrow \quad x_{\max 1} = C_1 V_1$$
$$x_{\max 1} = 5,00 \times 10^{-2} \times 2,0 \times 10^{-3}$$
$$x_{\max 1} = 1,0 \times 10^{-4}\ \text{mol}$$
$$C_2 V_2 – x_{\max 2} = 0 \quad \Rightarrow \quad x_{\max 2} = C_2 V_2$$
$$x_{\max 2} = 4,25 \times 10^{-2} \times 2,0 \times 10^{-3}$$
$$x_{\max 2}= 8,5 \times 10^{-5}\ \text{mol}$$
Or :
$$ x_{\max 2} < x_{\max 1} $$
Donc :
$$ x_{\max} = x_{\max 2} = 8,5 \times 10^{-5}\ \text{mol} $$
Or pour toutes les réactions : $x_{eq} = x_{max}$
Donc la seule solution qui peut être retenue pour ce système chimique est $8,5 \times {10}^{-5}\ mol$.
10. Discuter si cette transformation est adaptée au titrage des ions chlorure.
Pour que la réaction entre les ions argent et les ions chlorure soit adaptée pour réaliser le titrage, il faut que la transformation associée soit rapide et totale.
Pour cette réaction $ \ \ x_{eq}=x_{max}$, la transformation est totale.
De plus, « On observe la formation immédiate d’un précipité blanc », cette transformation est donc rapide.
Cette transformation est donc adaptée au titrage des ions chlorure.
Dosage par titrage de l’eau de source envisagée pour le brassage
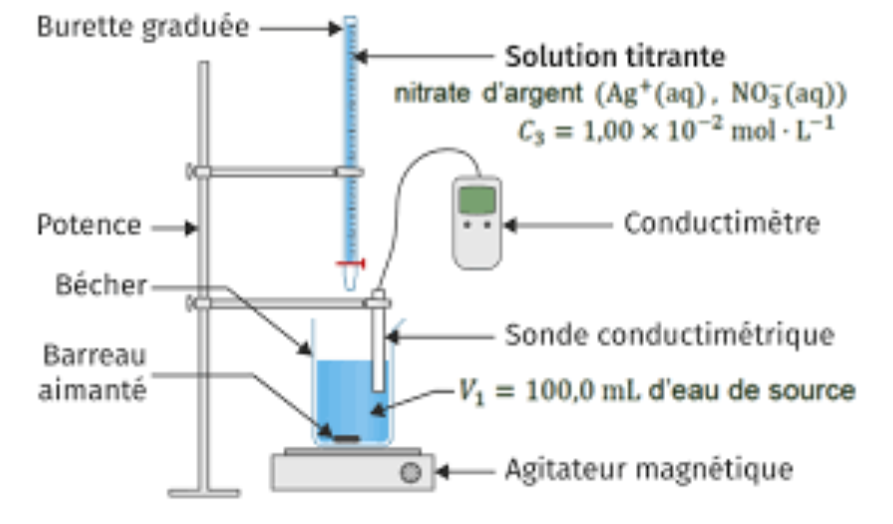
On prélève un volume V1 = 100,0 mL d’eau de source que l’on introduit dans un grand bécher dans lequel on plonge une cellule conductimétrique. À l’aide d’une burette graduée, on ajoute progressivement une solution aqueuse de nitrate d’argent (Ag+(aq) , NO3−(aq)) de concentration C3 = 1,00 × 10−2 mol⋅L−1.
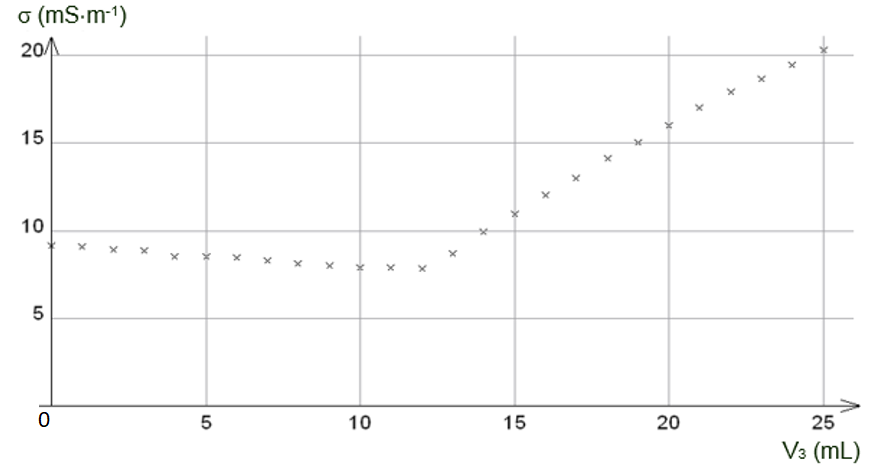
La conductivité 𝜎 du mélange dans le bécher, maintenu sous une agitation régulière, évolue en fonction du volume V3 de la solution de nitrate d’argent ajouté. Le tracé de cette évolution est représenté en figure 2.
11. Faire un schéma légendé du dispositif utilisé lors de ce titrage.
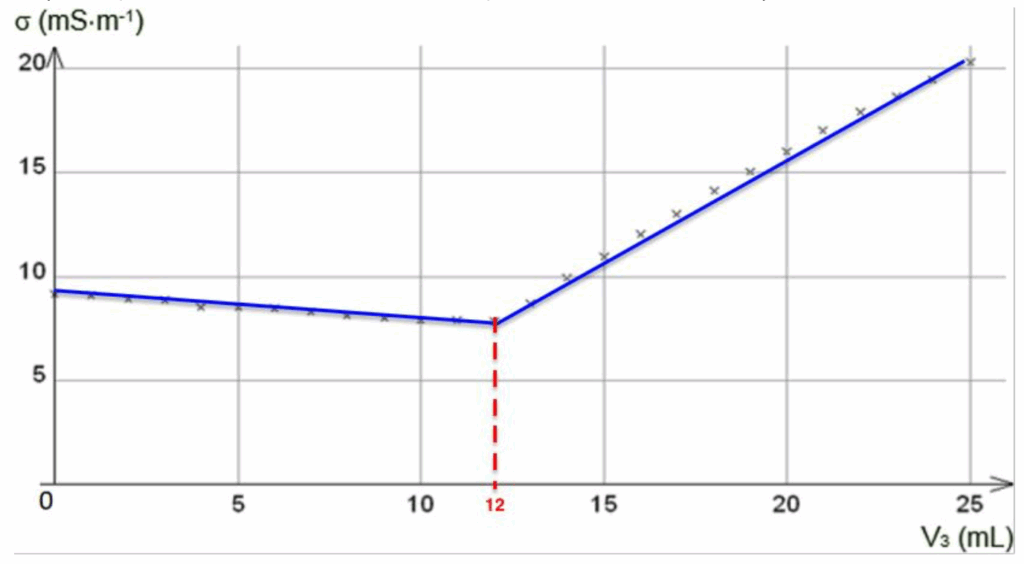
12. Justifier les évolutions de la conductivité 𝜎 de la solution contenue dans le bécher avant et après l’équivalence.
Ag+ (aq) + Cl− (aq) → AgCl(s)
| Ions | Avant l’équivalence | Après l’équivalence |
| Ag+ | 0 | ↗ |
| Cl− | ↘ | 0 |
| NO3− | ↗ | ↗ |
Avant l’équivalence :
- les ions Ag+ sont ajoutés et consommés immédiatement, ils constituent le réactif limitant, la concentration des ions Ag+ est nulle.
- les ions Cl− sont consommés, la concentration des ions Cl− diminue.
- les ions NO3− sont ajoutés, ils ne réagissent pas, la concentration des ions augmente.
Or , diminue donc avant l’équivalence.
Après l’équivalence :
- les ions Ag+ sont ajoutés et ne sont plus consommés, la concentration des ions Ag+ augmente.
- les ions Cl− n’existent plus, la concentration des ions Cl− est nulle.
- les ions NO3− sont ajoutés, ils ne réagissent pas, la concentration des ions augmente.
La concentration des ions augmente, ainsi augmente donc après l’équivalence.
13. Indiquer si la teneur en ions chlorure de l’eau analysée peut convenir pour la fabrication de la bière brune.
Le candidat est invité à prendre des initiatives, à indiquer les hypothèses qu’il est amené à formuler et à présenter la démarche suivie même si elle n’a pas abouti. La démarche suivie est évaluée et nécessite d’être correctement présentée.
« Dans le cas de la bière brune, l’eau utilisée doit contenir, entre autres, des ions chlorure à une concentration massique comprise entre 100 et 200 mg⋅L−1. »
Nous allons calculer la concentration massique des ions chlorure.
Ag+ (aq) + Cl− (aq) → AgCl(s)
A l’équivalence :
$$\frac{n_{{\rm Cl}^-}^i}{1}=\frac{n_{{\rm Ag}^+}^{eq}}{1}$$
$$C_1V_1=C_3V_{eq}$$
$$C_1=\frac{C_3V_{eq}}{V_1}$$
Veq se repère à l’intersection des deux portions de droite : Veq=12,0 mL
$$C_1=\frac{1,00 \times {10}^{-2} \times 12,0 \times {10}^{-3}}{100,0 \times {10}^{-3}}=1,20 \times {10}^{-3}\ mol.L^{-1}$$
Or
$$C_{m1}=C_1 \times M$$
$$C_{m1}=1,20 \times {10}^{-3} \times 35,5=4,26{ \times 10}^{-2}=42,6{ \times 10}^{-3}=42,6\ mg.L^{-1}$$
L’eau utilisée doit contenir, entre autres, des ions chlorure à une concentration massique comprise entre 100 et 200 mg.L−1. Notre eau à une concentration qui n’est pas comprise dans cet intervalle. Cette eau ne convient pas.
